胡桃楸种仁壳黄酮的纯化及抗氧化性研究
2012-10-25徐红艳褚凤艳包怡红
徐红艳,褚凤艳,包怡红,*
(1.东北林业大学林学院,黑龙江哈尔滨 150040;
2.延边大学农学院,吉林延吉 133000)
胡桃楸种仁壳黄酮的纯化及抗氧化性研究
徐红艳1,2,褚凤艳1,包怡红1,*
(1.东北林业大学林学院,黑龙江哈尔滨 150040;
2.延边大学农学院,吉林延吉 133000)
研究大孔树脂纯化胡桃楸种仁壳黄酮工艺条件,并对纯化前后黄酮的抗氧化活性进行了测定。以黄酮回收率为指标,考察大孔树脂对胡桃楸种仁壳黄酮的静态吸附与解吸、动态吸附与解吸性能;采用分光光度法,测定胡桃楸种仁壳黄酮对ABTS+·、DPPH·、·OH的清除能力和对金属离子的鳌合作用。结果表明,HPD-600大孔树脂适合纯化胡桃楸种仁壳黄酮,纯化工艺为:上样量1/3BV、吸附时间2h、上样pH6,上样浓度1.2mg/mL,用4BV的蒸馏水和2BV的90%乙醇洗脱,纯化后黄酮纯度由18.6%提高到37.7%。胡桃楸种仁壳黄酮具有明显的清除ABTS+·的能力,有较强清除DPPH·和·OH的能力,对铁离子具有一定的鳌合作用,且抗氧化活性与黄酮含量呈剂量效应关系。经与VC、Na2EDTA和BHT比较,抗氧化活性强于BHT,弱于VC、Na2EDTA。胡桃楸种仁壳黄酮具有显著的抗氧化作用。
胡桃楸种仁壳,黄酮,纯化,抗氧化
胡桃楸(Juglans mandshurica)又名山核桃、核桃楸,为胡桃科胡桃属落叶乔木。主要分布于小兴安岭、完达山脉、长白山区及辽宁东部,在大兴安岭东南部也有少量分布。目前关于胡桃楸根、茎、叶、树皮等方面的研究较多[1],活性成分及其药用价值[2]也已得到公认。胡桃楸种子作为林业副产品,因其种仁营养价值很高,已成为关注的热点,但在种仁加工的过程中,产生大量的种仁壳废弃物,目前对于各类坚果壳的利用和研究仅限于制备活性炭及加工工艺品方面[3],而关于胡桃楸种仁壳生物活性成分的研究更是罕见报道。随着食品和医药科技的不断发展,天然产物活性成分的研究和应用越来越受到关注[4]。黄酮类化合物是植物中分布十分广泛的天然活性成分,是植物在长期自然选择过程中产生的一些次级代谢产物[5],因其特有的结构,使其具有抗肿瘤、抗菌、抗病毒、抗炎、镇痛及治疗心血管疾病等诸多生理活性[6]。大孔树脂多以苯乙烯和丙烯酸酯为单体,加入交联剂和致孔剂,相互聚合形成的多网孔穴骨架结构,其吸附作用是依靠范德华力或产生氢键,筛选解吸作用主要由本身的多孔性结构决定,从而实现分离纯化物质的目的[7]。因其理化性质稳定,不溶于酸、碱及有机溶剂,易再生且可反复多次使用,在医药及食品研究与规模化生产中得到广泛应用。本实验是以胡桃楸种仁壳为原料,对经超声波辅助提取的总黄酮采用大孔树脂进行纯化,并对其体外抗氧化活性进行测定,旨在为胡桃楸种子的综合开发利用和种仁壳活性成分的深入研究提供理论依据。
1 材料与方法
1.1 材料与仪器
胡桃楸种子 黑龙江省牡丹江地区林业局提供;大孔树脂AB-8、X-5、D101 南开大学化工厂;大孔树脂NKA-Ⅱ、HPD-600、LS303 天津欧瑞生物科技有限公司;DPPH(2,2-Di(4-tert-octylphenl)-1-picrylhydrazyl)、ABTS(2,2’-Azino-bis-(3-ethyl benzoth-iazoline-6-sulfonic acid)、Ferrozine monosodium salt、BHT(2,6-Di-tert-butyl-4-methylphenol)
Sigma公司;VC天津市天力化学试剂有限公司;Na2EDTA 天津市科密欧化学试剂开发中心;其他试剂 均为分析纯。
RE-52A旋转蒸发器 上海亚荣生化仪器厂;TU-1810紫外可见分光光度计 北京普析通用仪器有限公司;FA2004电子天平 上海天平仪器厂;LGJ-18A真空冷冻干燥机 北京四环科学仪器有限公司。
1.2 实验方法
1.2.1 胡桃楸种仁壳黄酮的制备 取出种子内果仁,壳粉碎,过60目筛。称取一定量的种仁壳粉,按前期实验优化的提取工艺条件[8],加60%乙醇、料液比1∶31、超声波功率250W、超声波时间31m in进行超声波辅助提取,胡桃楸种仁壳总黄酮得率为6.62mg/g。提取液真空抽滤,45℃减压浓缩,得总黄酮浸膏,4℃冰箱保存备用,于纯化上样前稀释调整使用。
1.2.2 大孔树脂预处理[9]大孔树脂用95%乙醇浸泡24h后湿法装柱,然后用95%的乙醇在柱上流动洗脱,检测乙醇流出液至与蒸馏水1∶5混合不呈现白色浑浊为止,再用蒸馏水洗去乙醇,最后转入酸碱处理,即用2BV的5%HCl溶液缓慢通过树脂层,并浸泡3h,而后用蒸馏水洗至出水pH为中性;再用2BV的5%NaOH溶液缓慢通过树脂层,并浸泡3h,而后用蒸馏水洗至出水pH为中性,备用。
1.2.3 大孔树脂静态吸附量与解吸率考察 称取预处理好的6种大孔树脂各5.0g(过滤后称重)装于具塞三角瓶中,准确加入质量浓度为0.553mg/m L的胡桃楸种仁壳黄酮样品溶液50m L,于25℃恒温水浴振荡器上振荡24h,过滤,测定滤液黄酮质量浓度,按式(1)和(2)计算每种树脂的吸附量和吸附率:

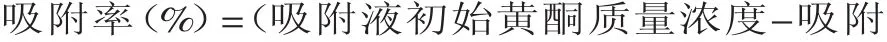

将按上述方法已吸附饱和的树脂分别用30m L蒸馏水水洗后,装入具塞三角瓶中,准确加入60%乙醇溶液50m L,于25℃恒温水浴振荡器上振荡24h,过滤,测定洗脱液黄酮质量浓度,按照式(3)计算每种树脂的解吸率:


式中:c为按标准曲线求出的黄酮质量浓度(mg/m L);n为样品液测定时的稀释倍数;v为样品液的体积(m L);m为样品的质量(mg)。
1.2.9 Fe3+总还原力的测定 采用铁氰化钾还原法[11]。向试管中加入提取液0.5m L,再分别加入pH 6.6的磷
1.2.4 大孔树脂静态吸附动力学考察 根据吸附量和解吸率,选择3种较理想的树脂做进一步的静态吸附动力学考察。称取大孔树脂5.0g(过滤后称重)装入具塞三角瓶中,准确加入质量浓度为0.793mg/m L的胡桃楸种仁壳黄酮样品溶液50m L,于25℃恒温水浴振荡器上振荡,自振荡开始每隔1h各取出1.0m L溶液,测定黄酮浓度并计算吸附量,绘制静态吸附动力学曲线。
1.2.5 大孔树脂动态吸附与解吸性能考察 通过静态吸附与解吸性能实验,对筛选出的一种理想大孔树脂,以黄酮回收率为考察指标,进行动态吸附动力学、上样液pH、上样液浓度、水洗体积、洗脱剂浓度、动态解析等动态吸附与解吸性能的考察。
装柱:将预处理好的大孔树脂按径高比1∶25湿法装入分离柱1.5cm×37.5cm,1BV为66cm3。边装边用橡皮棒敲打柱子压实树脂,以保证纯化效果。
1.2.6 纯化工艺中试放大实验 对经分离柱(1.5cm× 37.5cm)单因素确定的纯化工艺,在径高比1∶12的分离柱(8cm×96cm)上进行中试放大实验,分段收集流份,减压浓缩,真空冷冻干燥,得到纯化各段产品干粉。测各段产品纯度和Fe3+总还原力,以验证胡桃楸种仁壳黄酮纯化工艺的可行性。
1.2.7 标准曲线绘制 采用NaNO2-A l(NO3)3比色法[10]。准确称取芦丁标准品5.0mg,用60%乙醇定容50m L,配制质量浓度为0.10mg/m L的芦丁标准溶液。精确移取0、0.5、1.0、1.5、2.0、2.5、3.0m L的芦丁标准溶液于10m L容量瓶中,分别用60%乙醇补至3m L,再分别向各容量瓶中加5%的NaNO2溶液0.4m L,摇匀,静置6m in;加10%的A l(NO3)3溶液0.4m L,摇匀,静置6min;最后加入1mol/L的NaOH溶液4m L,定容至刻度,放置20m in,在510nm波长处测定其吸光度,以芦丁质量浓度X(mg/m L)为横坐标、以吸光度Y为纵坐标绘制标准曲线,得到标准曲线回归方程为Y= 13.536X-0.0005,相关系数R2=0.9994。
1.2.8 黄酮纯度测定 精密称取纯化各段产品干粉和粗提物干粉,并溶于60%乙醇溶液中,按制作标准曲线方法测溶液黄酮浓度,按式(4)计算纯度:酸缓冲液2.5m L、5%铁氰化钾2.5m L,混匀后密封50℃水浴20min,然后冰浴急速冷却,再加入10%的三氯乙酸2.5m L,混匀并离心10m in(4000r/m in)。取上清液2.5m L,加入2.5m L蒸馏水,再加入0.5m L三氯化铁显色,静置10m in,700nm波长处测定其吸光值A1,以蒸馏水代替提取液为A0,Fe3+总还原力=A1-A0,A1-A0越大说明Fe3+总还原力越强。
1.2.10 抗氧化活性研究
1.2.10.1 清除ABTS+·作用 按Kim等[12]方法略有改动。准确称取100mg过硫酸钾于50m L容量瓶中蒸馏水定容,配成2.6mmol/m L的过硫酸钾溶液;准确称取203mg ABTS于50m L容量瓶中甲醇定容,配成7.4mmol/m L的ABTS甲醇溶液,将上述两溶液混合后室温避光静置24h,即为ABTS+·储备液,于4℃避光储存备用。临用前稀释,使其在734nm波长下吸光值为0.700±0.020,即为ABTS+·工作液。
取ABTS+·工作液2.85m L,加样品液0.15m L,立即混匀,室温避光放置10min,在734nm波长下测A1,以蒸馏水代替ABTS+·工作液的吸光度为A2,以甲醇代替样品液的吸光度为A0。按式(5)计算清除率:

1.2.10.2 清除DPPH·作用[13]准确称取0.0928g DPPH于100m L容量瓶中无水乙醇定容,配成0.15mmol/L的DPPH储备液,4℃避光储存备用。临用时稀释,使其在517nm波长下吸光值为0.700±0.020,即为DPPH工作液。
取DPPH工作液2m L,加样品液2m L,立即混匀,室温避光放置30m in,在517nm波长下测A1,以无水乙醇代替DPPH工作液的吸光度为A2,以无水乙醇代替样品液的吸光度为A0。按式(5)计算清除率。
1.2.10.3 清除羟自由基(·OH)作用 采用Fenton反应产生羟基自由基(·OH)[14]。取6mmol/L的FeSO4·7H2O溶液2m L,加入6mmol/L的H2O2溶液2m L,立即混匀,加入1m L样品液混匀,静置10m in。再加入6mmol/L的水杨酸溶液2m L,37℃水浴30m in,然后4000r/m in离心10min,取上清液510nm波长测定吸光度A1,蒸馏水代替水杨酸溶液的吸光度为A2,蒸馏水代替样品液的吸光度为A0,按式(5)计算清除率。
1.2.10.4 金属离子螯合作用 按Wong的方法略有改动[15]。取样品液1m L于试管中,加入2mmol/L的FeCl2溶液0.1m L,再加入5mmol/L的Ferrozine mono-sodium salt溶液0.2m L和无水乙醇3.7m L,混匀后反应10min,在562nm波长处测定吸光度A1,蒸馏水代替Ferrozine mono-sodium salt溶液的吸光度为A2,蒸馏水代替样品液的吸光度为A0,按式(5)计算清除率。
2 结果与分析
2.1 不同类型大孔树脂对胡桃楸种仁壳黄酮静态吸附与解吸效果
大孔树脂内部具有三维空间立体孔结构,其筛选吸附性能与比表面积关系密切,比表面积越大,吸附能力越强。6种大孔树脂对胡桃楸种仁壳黄酮的静态吸附量与解吸率,结果见表1。
曹保庆家里3口人都患有慢性病,无经济来源,是建档立卡贫困户。曹保庆对自家的户容户貌进行整治,通过了驻村工作队的卫生考核,获得20积分;积极参加村集体组织的活动,获得5积分;对帮扶措施和扶贫政策较为熟悉,又获得15积分……靠自己的劳动所得,曹保庆在爱心超市如愿兑换到了自己需要的生活用品。
由表1可知,AB-8、X-5、HPD-600 3种大孔树脂对胡桃楸种仁壳黄酮的静态吸附与解吸效果较好,其中,HPD-600大孔树脂具有最大的吸附量,同时其解吸率也最高。
2.2 3种大孔树脂对胡桃楸种仁壳黄酮静态吸附动力学曲线

图1 HPD-600、AB-8、X-5大孔树脂静态吸附动力学曲线Fig.1 Static adsorption kinetic curves of HPD-600,AB-8 and X-5macroporous resins on flavonoids from seed shell of Juglansmandshurica
选择AB-8、X-5、HPD-600 3种大孔树脂进行静态吸附动力学考察,结果见图1。由图1可知,随着吸附时间的延长,3种大孔树脂的吸附量都增加,并且在2h内,大孔树脂吸附接近饱和,属快速平衡型,其中HPD-600大孔树脂吸附量最大,这与静态吸附量与解吸率的实验结果一致,因此选择HPD-600大孔树脂用于纯化胡桃楸种仁壳黄酮,并将后续实验的吸附时间定为2h。
2.3 HPD-600大孔树脂对胡桃楸种仁壳黄酮的动态吸附与解吸性能
2.3.1 动态吸附动力学曲线 将质量浓度为
0.795mg/m L的胡桃楸种仁壳黄酮动态吸附上样,控制流速1m L/m in,自上样开始收集流出液,5m L/份,连续收集20份,测每份流出液黄酮质量浓度,绘制动态吸附动力学曲线,结果见图2。
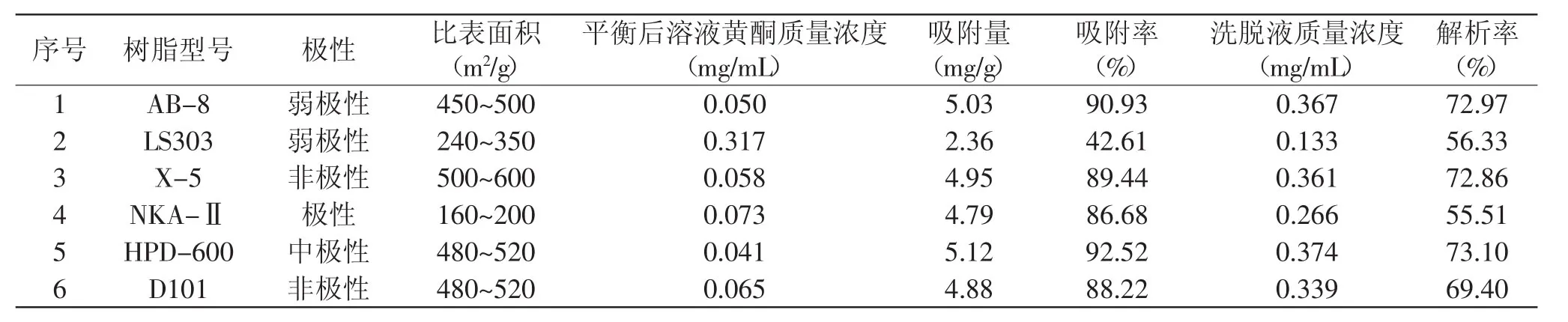
表1 6种大孔树脂对胡桃楸种仁壳黄酮静态吸附量与解吸率Table 1 Adsorption and desorption capacity of 6macroporous resins on flavonoids from seed shell of Juglansmandshurica

图2 HPD-600大孔树脂对胡桃楸种仁壳黄酮动态吸附动力学曲线Fig.2 Dynamic adsorption kinetic curves of HPD-600 macroporous resins on flavonoids from seed shell of Juglansmandshurica
2.3.2 上样液pH对黄酮回收率的影响 将质量浓度为0.795mg/m L的胡桃楸种仁壳黄酮各25m L分别调pH为4、5、6、7、8并动态上样,控制流速为1m L/min。然后用3BV的蒸馏水洗树脂柱,再用3BV的60%乙醇洗脱,控制洗脱流速1m L/m in,测洗脱液黄酮浓度,计算黄酮回收率,结果见图3。

图3 上样液pH对黄酮回收率的影响Fig.3 Effectof pH of liquid sample on recovery yield of total flavonoids
由图3可知,随着上样液pH的增大,黄酮回收率增加,当pH为6时,黄酮回收率达到最大,之后pH再增加,黄酮回收率下降,故选最佳上样液pH为6。
2.3.3 上样液浓度对黄酮回收率的影响 将pH为6、质量浓度分别为0.4、0.8、1.2、1.6、2.0、2.4mg/m L的胡桃楸种仁壳黄酮25m L动态上样,控制流速1m L/m in。先用3BV的蒸馏水洗树脂柱,再用3BV的60%乙醇洗脱,控制洗脱流速1m L/m in,测洗脱液黄酮浓度,计算黄酮回收率,结果见图4。
由图4可知,随着上样液浓度的增大,黄酮回收率增加,当浓度为1.2mg/m L时,黄酮回收率达到最大,之后浓度再增加,黄酮回收率呈下降趋势,故选最佳上样液浓度为1.2mg/m L。

图4 上样液浓度对黄酮回收率的影响Fig.4 Effectof concentration of liquid sample on recovery yield of total flavonoids
2.3.4 水洗体积对黄酮回收率的影响 将pH为6、质量浓度为1.2mg/m L的胡桃楸种仁壳黄酮25m L分别动态上样,控制流速1m L/min。然后分别用2、3、4、5、6、7、8BV的蒸馏水洗树脂柱,再用3BV的60%乙醇洗脱,控制洗脱流速1m L/min,测洗脱液黄酮浓度,计算黄酮回收率,结果见图5。

图5 水洗体积对黄酮回收率的影响Fig.5 Effectof volum ofeluting distilled water on recovery yield of total flavonoids
由图5可知,随着水洗体积的增加,黄酮回收率呈下降趋势,2BV水洗,水洗液仍浑浊;4BV以上水洗,水洗液透明无浑浊;而5BV以上水洗,则黄酮回收率下降过快,可能是水洗体积过大,导致水溶性黄酮类成分过多流失的缘故。因此选最佳水洗体积为4BV。
2.3.5 洗脱剂乙醇浓度对黄酮回收率的影响 将pH为6、质量浓度为1.2mg/m L的胡桃楸种仁壳黄酮25m L分别动态上样,控制流速1m L/m in。先用4BV的蒸馏水洗树脂柱,再用3BV的不同体积分数的乙醇溶液洗脱,控制洗脱流速1m L/min,测洗脱液黄酮浓度,计算黄酮回收率,结果见图6。

图6 乙醇浓度对黄酮回收率的影响Fig.6 Effectof concentration of ethanol on recovery yield of total flavonoids
由图6可知,随着乙醇浓度的增加,黄酮回收率呈上升趋势,考虑尽可能多的回收黄酮,并且后期实验会进一步进行纯化,因此选90%乙醇溶液为洗脱剂。
2.3.6 动态解析曲线 将pH为6、质量浓度为1.2mg/m L的胡桃楸种仁壳黄酮25m L动态上样,控制流速1m L/m in。先用4BV的蒸馏水洗树脂柱,再用90%的乙醇溶液洗脱,控制洗脱流速1m L/m in,洗脱液每10m L收集一份,共收集15份,测每份洗脱液黄酮浓度,计算黄酮含量,结果见图7。

图7 动态解析曲线Fig.7 Curves of dynamic desorption
由图7可知,洗脱初期,洗脱液中未见黄酮成分,之后随洗脱剂体积的增加,洗脱液中黄酮含量逐渐增加,在第7管即洗脱液体积达到1BV左右时,黄酮含量达到最大值,之后洗脱液中黄酮含量迅速下降,2BV时洗脱液中黄酮含量已很少。说明2BV 90%的乙醇就可将大部分吸附在树脂上的黄酮洗脱下来。而且动态解析曲线的峰形窄而高,这样有利于集中收集洗脱下来的黄酮成分,并能节约洗脱剂。因此,确定洗脱剂用量为2BV。
2.4 胡桃楸种仁壳黄酮纯化工艺中试放大实验效果

图8 纯化各段产品与粗提物纯度比较Fig.8 Purity of puritied products and crude extraction

图9 纯化各段产品与粗提物Fe3+总还原力比较Fig.9 Total reducing power of puritied products and crude extraction
将质量浓度为1.2mg/m L的胡桃楸种仁壳黄酮1600m L调pH为6后动态上样,控制流速为2m L/min。然后用4BV的蒸馏水洗树脂柱,再用2BV的90%乙醇溶液洗脱,控制洗脱流速3m L/m in,洗脱液每250m L收集一份,并逐份进行紫外光谱扫描,峰型相同的进行合并,共得到5段流份。各段产品的纯度和Fe3+总还原力测定结果,见图8和图9。
由图8和图9可知,经大孔树脂纯化后,一、二、三段产品的纯度和Fe3+总还原力都比粗提物有所提高,其中一、二段产品的纯度分别由粗提物的18.6%提高到41.7%和37.7%,三段产品也略高于粗提物,但考虑一段产品的量比较少,综合考虑后续实验的需要,故选择纯化二段产品进行进一步的研究。
2.5 抗氧化活性
机体在正常生物代谢过程中会产生超氧阴离子自由基(O2-)、羟自由基(·OH)、单线态氧(1O2)、过氧化氢(H2O2)等自由基,当机体产生过量的自由基并在体内积聚时,就会导致机体脂质过氧化,自由基在细胞损伤以及加速机体衰老等方面所产生的作用已引起学者的广泛重视[16]。
2.5.1 对ABTS+·的清除作用 ABTS+·自由基常被用于衡量天然产物的总抗氧化能力[17]。胡桃楸种仁壳黄酮对ABTS+·的清除作用结果见图10。
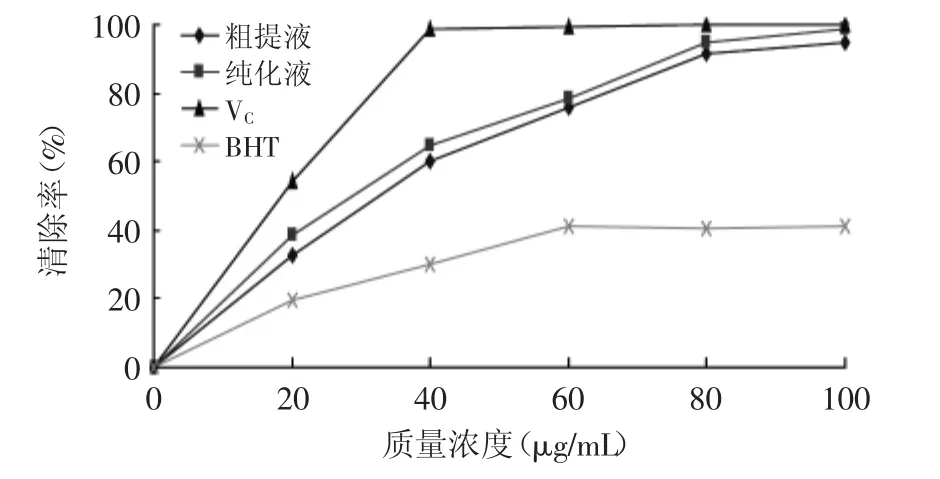
图10 胡桃楸种仁壳黄酮对ABTS+·的清除作用Fig.10 Scavenging activities of flavonoid from seed shell of Juglansmandshurica on ABTS+·
由图10可知,胡桃楸种仁壳黄酮对ABTS+·的清除能力随黄酮质量浓度的增加而增强,当质量浓度为100μg/m L时,粗提液的清除率为94%,纯化液的清除率为99%。IC50值分别为:粗提液33μg/m L,纯化液26μg/m L。但仍然与VC的清除率有一定差距,VC在质量浓度为40μg/m L时,其清除率已达98%;与BHT相比,相同质量浓度的胡桃楸种仁壳黄酮对ABTS+·的清除能力明显更强。说明胡桃楸种仁壳黄酮对ABTS+·有明显的清除作用。
2.5.2 对DPPH·的清除作用 DPPH自由基清除能力被广泛用于天然产物抗氧化活性评价中[18]。胡桃楸种仁壳黄酮对DPPH·的清除作用结果见图11。
由图11可知,胡桃楸种仁壳黄酮对DPPH·的清除能力随黄酮质量浓度的增加而增强,当质量浓度为2mg/m L时,纯化液的清除率就已超过60%,IC50值分别为粗提液2.76mg/m L,纯化液1.22mg/m L。相同质量浓度的胡桃楸种仁壳黄酮对DPPH·的清除能力不及VC,但明显高于BHT。说明胡桃楸种仁壳黄酮对

图11 胡桃楸种仁壳黄酮对DPPH·的清除作用Fig.11 Scavenging activities of flavonoid from seed shell of Juglansmandshurica on DPPH·
3.2 胡桃楸种仁壳黄酮具有很好的清除ABTS+·、DPPH·、·OH的能力和螯合铁离子的作用,并且呈现量效关系。纯化后抗氧化活性呈增强趋势,在清除ABTS+·、DPPH·和·OH作用中,黄酮纯化前后IC50值分别为33、26μg/m L,2.76、1.22mg/m L和1.44、0.59mg/m L。但对铁离子螯合作用则表现出纯化后降低的趋势,并且不及Na2EDTA。相同浓度胡桃楸种仁壳黄酮对ABTS+·、DPPH·、·OH的清除能力不及VC,但优于BHT。说明胡桃楸种仁壳黄酮具有很好的体外抗氧化活性,但其黄酮成分的具体组成、分子结构及抗氧化机理以及体内抗氧化作用有待于进一步研究。DPPH自由基有清除作用,并且纯化液的清除作用更显著。
2.5.3 对·OH的清除作用 羟自由基被认为是引发机体内组织细胞病变,导致疾病与加速衰老最直接的自由基[19]。胡桃楸种仁壳黄酮对·OH的清除作用结果见图12。

图12 胡桃楸种仁壳黄酮对·OH的清除作用Fig.12 Scavenging activities of flavonoid from seed shell of Juglansmandshurica on hydroxyl radical
由图12可知,随黄酮质量浓度的增加,对·OH的清除能力逐渐增强,纯化液最大清除率可达86%,IC50值分别为:粗提液1.44mg/m L,纯化液0.59mg/m L。相同质量浓度的胡桃楸种仁壳黄酮对·OH的清除能力低于VC,但明显高于BHT。说明胡桃楸种仁壳黄酮对·OH有明显的清除作用。
2.5.4 对铁离子螯合能力 胡桃楸种仁壳黄酮对铁离子螯合能力结果见图13。
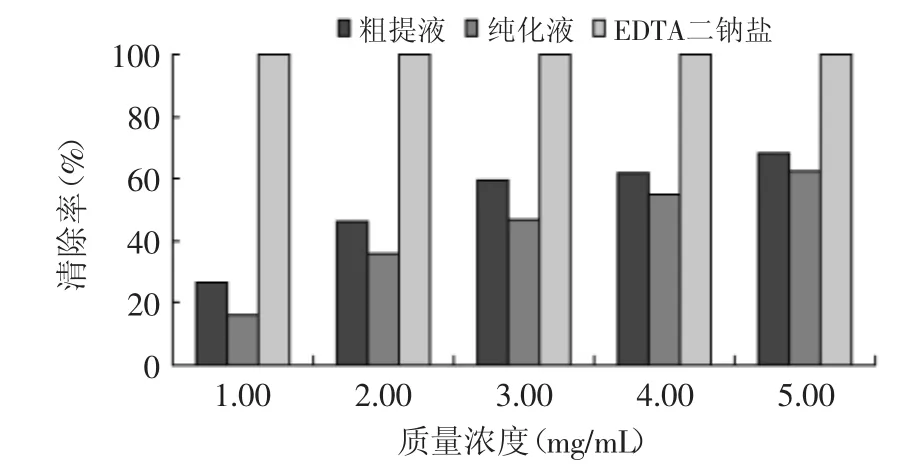
图13 胡桃楸种仁壳黄酮对铁离子螯合作用Fig.13 Chelating effectof flavonoid from seed shell of Juglansmandshurica on ferrous ions
由图13可知,随黄酮质量浓度的增加,对铁离子螯合作用逐渐增强,IC50值分别为:粗提液2.75mg/m L,纯化液3.61mg/m L,显示出较好的螯合作用。相同质量浓度的胡桃楸种仁壳黄酮对铁离子的螯合作用明显低于Na2EDTA。说明胡桃楸种仁壳黄酮对铁离子具有螯合作用。
3 结论
3.1 大孔树脂纯化胡桃楸种仁壳黄酮工艺条件为:HPD-600大孔树脂,吸附时间2h,上样液pH6,上样量1/3BV,上样浓度为1.2mg/m L,水洗体积4BV,用2BV的90%乙醇基本可洗脱完全,纯化后胡桃楸种仁壳黄酮纯度由18.6%提高到37.7%。
[1]崔哲.胡桃楸的研究进展[J].现代医药卫生,2008,24(20):3061-3062.
[2]詹苗,张咏莉.山核桃树及树皮的化学成分及药理作用研究进展[J].热带医学杂志,2008,8(1):87-89.
[3]欧阳娜娜,杨焰.核桃壳制活性炭的工艺研究[J].湖南林业科技,2006,33(1):26-27.
[4]Kim B J,Kim J H,Kim H P,et al.Biological screening of 100 plant extracts for cosmetic use(Ⅱ):anti-oxidative activity and free radical scavenging activity[J].Int JCosmet Sci,1997,19(6):299-307.
[5]徐任生.天然产物化学[M].北京:科学出版社,2004:526-528.
[6]李荣,李俊.黄酮类化合物药理活性及其构效关系研究进展[J].安徽医药,2005,9(7):481-483.
[7]汪茂田,谢培山,王忠东,等.天然有机化合物提取分离与结构鉴定[M].北京:化学工业出版社,2004,8:101-103.
[8]徐红艳,包怡红,杨丽芸.响应面法优化超声波辅助提取胡桃楸种仁壳总黄酮工艺[J].食品工业科技,2012,33(17):248-251.
[9]阎欲晓,黄玥.甘蔗叶黄酮分离纯化及生理活性研究[J].食品工业科技,2011,32(3):149-152.
[10]张玉,曾凡坤,吴剑.响应面法优化柑橘皮渣中类黄酮的超声波提取工艺[J].食品科学,2010,31(8):28-32.
[11]张宇思,龚祝南,石雪萍.花椒总黄酮的抗氧化作用[J].食品科学,2011,32(15):70-73.
[12]Kim JS,Lee Y S.Antioxidant activity of Maillard reaction products derived from aqueous glucose/glycine,diglyeine,and trigtycine model systems as a function of heating time[J].Food Chemistry,2009,116:227-232.
[13]杨乐,王洪新.笋壳黄酮分离纯化工艺及其抗氧化性[J].食品发酵与工业,2010,36(8):184-189.
[14]周丽萍.Ralls苹果多酚分离及抗氧化与脂肪代谢调节作用研究[D].哈尔滨:东北林业大学,2010.
[15]Wong J Y,Fook Y C.Antioxidant properties of selected tropical wild edible mushrooms[J].Journal of Food Composition and Analysis,2009,22:269-277.
[16]Lee J,Koo N,Min DB.Reactive oxygen species,aging,and antioxidative nutraceuticals[J].Comprehensive Reviews in Food Science and Food Safety,2004(3):21-33.
[17]郑善元,陈填烽,郑文杰,等.单丛茶水提物清除DPPH和ABTS自由基的光谱学研究[J].光谱学与光谱分析,2010,30(9):2417-2423.
[18]Lee YL,Yen MT,Mau JL.Antioxidant properties of various extracts from Hypizigus marmoreus[J].Food Chemistry,2007,104:1-9.
[19]董晓慧,杨原志.自由基与维生素E的抗氧化作用[J].饲料研究,2003(6):15-18.
Research of purification and antioxidant activity of flavonoids from seed shellof Juglans mandshurica
XU Hong-yan1,2,CHU Feng-yan1,BAO Yi-hong1,*
(1.Forestry College of Northeast Forestry University,Harbin,150040,China;
2.Agricultural College of Yanbian University,Yanji133000,China)
The purified cond ition of flavonoids from seed shell of Jug lans mandshurica was investigated by mac roporous resin,and antioxidant ac tivity of flavonoids were evaluated.Absorp tion and desorp tion of mac roporous resin on flavonoids were investigated as recovery yield of total flavonoids as index.Add itionally,scavenging ability of flavonoids on ABTS+·,DPPH·,·OH and chelating effec t on ferrous ions were determ ined by spec trophotometry to evaluate antioxidant activity.Results showed that using HPD-600 resin to purify flavonoids from seed shell of Jug lans mandshurica,the op timal cond itions were as follows:quantity of liquid sam p le 1/3BV,time of absorp tion 2h,pH6,concentration of liquid samp le 1.2mg/m L,bed ofmacroporous resin were eluted using 4BV distilled water and 2BV 90%ethanol,purity of flavonoids was increased from 18.6%to 37.7%.Flavonoids from seed shell of Jug lans mandshurica could significantly scavenge ABTS+·,could scavenge DPPH·and·OH,and had chelating effect on ferrous ion,there were dose-effect relationship. Com pared w ith VC,Na2EDTA and BHT,antioxidantactivity was stronger than BHT,weaker than VCand Na2EDTA. Flavonoids from seed shellof Jug lans mandshurica had significantly antioxidanteffect.
Jug lans mandshurica;seed shell;flavonoids;purification;antioxidant
TS255.1
A
1002-0306(2012)22-0113-07
2012-06-18 *通讯联系人
徐红艳(1975-),女,博士研究生,讲师,主要从事天然产物转化与功能性食品研究。
中央高校基本科研业务费专项(LD09C14)。
