重组人内皮抑素的大鼠药代动力学研究
2012-10-25蔡永明刘昌孝张宗鹏
蔡永明 曾 勇 姜 凌 张 骏 刘昌孝 张宗鹏,*
(1.天津大学化工学院制药工程专业,天津 300072;2.天津药物研究院释药技术与药代动力学国家重点实验室,天津 300193;3.天津市新药安全评价研究中心,天津 300301)
内皮抑素(recombinant human endostatin)是O'Reilly M S等[1]于1997年从小鼠血管内皮瘤细胞培养上清液中分离得到,羧基端为胶原蛋白ⅩⅧ,相对分子量为20 000的蛋白质[2]。内皮抑素是一种新生血管抑制因子,特异性地抑制内皮细胞增生和迁移,对血管形成及肿瘤生长呈明显抑制作用[3-4]。临床上使用内皮抑素抑制肿瘤内新生血管的形成来抑制肿瘤生长和转移,为目前肿瘤抗血管生成疗法中较具潜力的生物蛋白类药物[5-6]。本文所研究的重组人内皮抑素(recombinant human endostanin,rhEndostatin)是通过基因重组技术,利用大肠杆菌(Escherichia coli)表达制备获得的重组蛋白[7],在完成小鼠抑瘤药效学和动物毒理学试验的基础上,首次采用同位素示踪法研究大鼠静脉注射不同剂量rhEndostatin后的药代动力学、组织分布及排泄等药物代谢特性,为临床试验提供有价值的实验数据。
1 材料和方法
1.1 试验药物
重组人内皮抑素(rhEndostatin),由江苏吴中生物医药研究所有限公司提供(批号20021201),浓度10 mg/mL,5 mL/瓶,HPLC 纯度 >98%,SDS-PAGE 纯度>96%。4℃保存。
1.2 125I-rhEndostatin 的制备
由中国原子能科学研究院同位素研究所标记并提供,采用氯胺T法进行125I标记rhEndostatin,经高效液相色谱法分离纯化125I-rhEndostatin,纸层析鉴定放射化学纯度为95.1%,放射比活度为97.7 mCi/mg(3 615 MBq/mg)。Western blotting法鉴定125I-rhEndostatin免疫活性显示,同位素标记前后rhEndostatin免疫活性没有明显变化。
1.3 实验动物
健康SD大鼠,雌雄兼用,体质量(200±10)g,由北京大学医学部实验动物科学部提供〔动物生产合格证:SCXK(京)2002-0001号〕。实验前动物至少适应饲养1周。
1.4 药代动力学研究
大鼠分别静脉注射rhEndostatin 5、10和20 mg/kg(给药体积2.5 mL/kg体质量,含125I-rhEndostatin 50 μCi/kg)后,于 2、5、10、15、20、30、45、60、90、120、180、240、360和480 min从眼静脉丛采血,分离血清,取200 μL标准液置于测定管中,在γ计数器(FJ630G/12型微机多探头γ计数器,北京核仪器厂出品)上测定总放射性(radioactivity,RA法)。然后每管各加入20%三氯醋酸(trichloroacetic acid-radioactivity,TCA)200 μL,振荡混匀,3 000 r/min离心20 min弃上清,测定沉淀物中的放射性计数(TCA-RA法)。每一个时间点取6只动物(3雌/3雄)采样。
1.5 组织分布研究
大鼠静脉注射rhEndostatin 10 mg/kg(给药体积2.5 mL/kg 体质量,含125I-rhEndostatin 50 μCi/kg)后,分别于5、30、60和120 min处死动物,取脑、心、肺、肝、肾、脾、胃、肠、肌肉、脂肪、子宫、卵巢和睾丸,每种组织脏器用蒸馏水按1∶5的比例制成匀浆,取200 μL进行总放射性测定(radioactivity,RA法),再根据组织校正曲线计算出各脏器组织中的药物含量,每一个时间点6只动物(雌雄各半)。在上述已测定过总放射性的组织样品中,各加20%三氯醋酸200 μL,涡旋混匀,3 000 r/min离心20 min,弃上清,测定沉淀物中的放射性(TCA-RA法),根据组织沉淀校正曲线计算出各组织的药物含量。
1.6 尿、粪和胆汁排泄试验
6只大鼠(雌雄各3只)静脉注射rhEndostatin 10 mg/kg(给药体积2.5 mL/kg体质量,含125I-rhEndostatin 50 μCi/kg)后放入代谢笼内,分别收集 0~2、2~4、4 ~6、6 ~8、8 ~10、10 ~20、20 ~32、32 ~48、48 ~72、72~96 h不同时间段的尿液和粪样,以及0~2、2~4、4~6、6~8、8~10、10~20和20~24 h的胆汁,分别取200 μL测定总放射性,根据尿、粪和胆汁的各自标准曲线计算药物排泄量和排泄速率。
1.7 数据处理及药动参数计算
血药浓度-时间数据采用3P97药动程序拟合分析并计算药动参数,包括消除半衰期(elimination halflife,t1/2β)及清除率(systemic clearance,CL)等参数;药物时间曲线下面积(area under the serum concentration-time curve,AUC)采用梯形法计算;实验数据均以均数±标准差(±s)表示。对低、中和高3个剂量的t1/2β、AUC和CL等主要药动参数进行统计学分析,对满足正态性用单因素方差分析法进行组间比较,同时进行方差齐性检验(若方差齐性,用LSD法;方差不齐性,用Tamhane’s T2法)。不满足正态性的数据用非参数检验中的多组秩和检验(Kruskal-Wallis H法)。采用统计软件SPSS 17.0进行统计分析。
2 结果
2.1 药代动力学研究
大鼠分别静脉注射rhEndostatin 5、10和20 mg/kg,3个剂量血清药物浓度随时间变化曲线详见图1(RA法)和图2(TCA-RA法)。不同时间血药浓度实验数据经拟合符合二房室模型,药代参数详见表1。消除半衰期(t1/2β)和清除率(CL)呈非剂量依赖性改变,t1/2β变化范围在243~265 min〔(254±11)min〕、CL 在2.4~2.6 mL·(kg·min)-1〔(2.52 ±0.10)mL·kg-1·min-1〕,血药浓度和AUC(0~480min)随剂量的增加而增大。低、中和高3个剂量的AUC(0~480min)经单因素方差分析组间比较结果显示(P<0.05);而t1/2β和CL采用非参数检验结果为P>0.05;统计学结果支持了 AUC(0~480min)与剂量呈正相关(相关系数均为0.999),t1/2β和CL与剂量呈非相关的药代动力学特征。
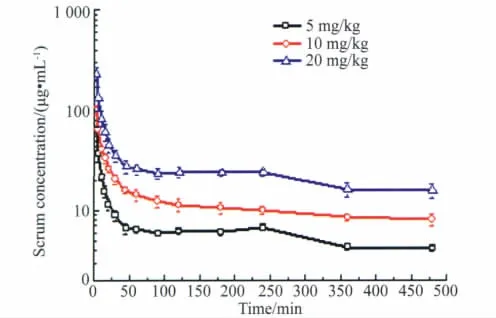
图1 RA法测得大鼠静脉注射rhEndostatin(5、10和20 mg/kg)后的平均药物时间曲线Fig.1 Mean serum concentration-time profiles by RA method following intravenoues administration of different doses of rhEndostatin(5,10 and 20 mg/kg,respectively)to rats(x¯±s,n=6)
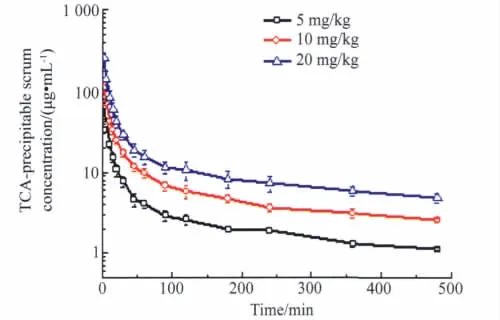
图2 TCA-RA法测得大鼠静脉注射rhEndostatin(5、10和20 mg/kg)的平均药物时间曲线Fig.2 Mean serum concentration-time profiles by TCA-RA method following intravenoues administration of rhEndostatin at different doses(5,10 and 20 mg/kg)to rats(±s,n=6)
2.2 组织分布结果
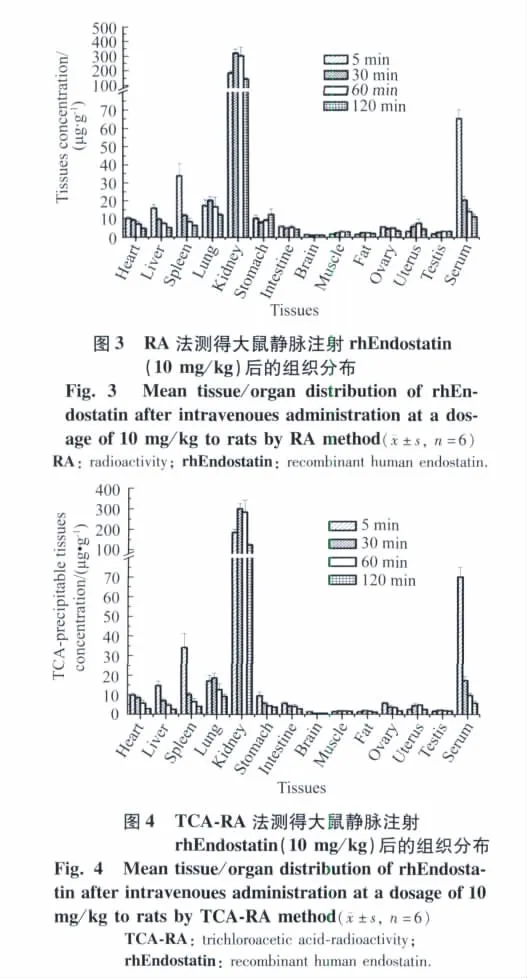
大鼠静脉注射rhEndostatin 10 mg/kg后,组织分布结果详见图3(RA法)和图4(TCA-RA法)。结果显示,药物主要分布在肾脏,其次为脾、肺和肝;再其次为胃、心肠、卵巢、子宫和睾丸,肌肉、脂肪和脑含量最低。RA和TCA-RA两种方法测定结果基本一致。
2.3 尿、粪和胆汁排泄试验结果
大鼠静脉注射rhEndostatin 10 mg/kg后,尿、粪和胆汁排泄结果详见图5(RA法)。排泄试验结果显示,大鼠静脉注射rhEndostatin10mg/kg后,96h内由尿累积排泄量占给药总量的86.9%,在粪中可回收到给药量的5.8%,尿和粪的总回收率达到92.7%;给药后24 h内由胆汁排出的药量占给药量的1.3%;表明rhEndostatin主要经肾由尿排泄。
表1 大鼠静脉注射rhEndostatin(5、10和20 mg/kg)后测定的主要药动参数Tab.1 The mean pharmacokinetic parameters following intravenoues administration of rhEndostatin at different doses(5,10 and 20 mg/kg)to rats(±s)(n=6)

表1 大鼠静脉注射rhEndostatin(5、10和20 mg/kg)后测定的主要药动参数Tab.1 The mean pharmacokinetic parameters following intravenoues administration of rhEndostatin at different doses(5,10 and 20 mg/kg)to rats(±s)(n=6)
t1/2α:absorption half-life;t1/2β:elimination half-life;AUC:area under the serum concentration-time curve;CL:systemic clearance;Vd:volume of distribution;rhEndostatin:recombinant human endostatin;RA:radioactivity;TCA-RA:trichloroacetic acid-radioactivity.
Parameter Dose/(mg·kg-1)(RA)5 10 20 t1/2α/min 5.10 ±1.15 6.99 ±1.73 5.23 ±1.22 t1/2β/min 620.3 ±59.5 507.0 ±67.3 523.2 ±90.8 AUC0~480 min/(min·μg·mL-1) 3 184±302 5 863±818 12 052±1 651 CL/(mL·kg-1·min-1) 0.74 ±0.10 0.89 ±0.16 0.86 ±0.12 Vd/(mL·kg-1) 70.9 ±7.8 99.1 ±10.5 78.2 ±11.9 Parameter Dose/(mg·kg-1)(TCA-RA)5 10 20 t1/2α/min 7.11 ±2.17 9.26 ±2.46 7.28 ±1.38 t1/2β/min 243.1 ±40.6 252.7 ±33.2 265.2 ±38.4 AUC0~480 min/(min·μg·mL-1) 1 626±232 3 424±427 6 419±804 CL/(mL·kg-1·min-1) 2.61 ±0.30 2.41 ±0.28 2.53 ±0.34 Vd/(mL·kg-1)83.6 ±7.7 106.1 ±12.4 89.7 ±9.5
3 讨论
放射性同位素标记示踪法是一种分析测定蛋白质、多肽或寡核苷酸类等生物技术药物较为经典的方法,具有较高灵敏度和快速检测等优点。但如何定量检测原型药物是放射性同位素测定法中的关键技术。其原因为,药物进入体内后会被降解,或存在游离碘的干扰,故检测总放射性并不能代表原型药物。因此,基于本文所研究的蛋白质的特点,采用TCA沉淀目标蛋白后测定其125I-rhEndostatind放射性,以排除了蛋白分解产物及游离125I的干扰,与测定总放射性(RA)法相比,更能反映原型药物的浓度。采用RA和TCA-RA两种方法测定大鼠静脉注射后的血药浓度和组织中药物浓度均显示TCA-RA方法的测定结果低于RA方法,但趋势基本一致。
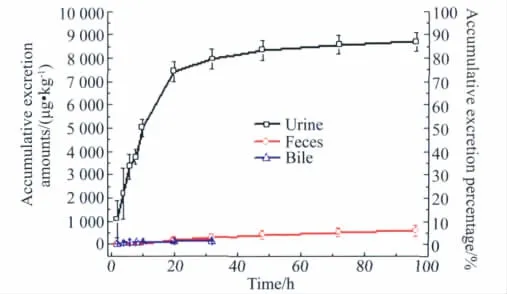
图5 大鼠静脉注射rhEndostatin(10 mg/kg)后尿、粪和胆汁排泄曲线Fig.5 The excretion curve of rhEndostatin(intravenoues,10 mg/kg)in urine,feces and bile in rats(±s,n=6)
本文首次报道了采用同位素示踪法研究大鼠静脉注射基因重组人血管内皮抑素rhEndostatin后的吸收、分布、排泄及药代动力学特征。大鼠静脉注射不同剂量的rhEndostatin(5、10和20 mg/kg)后,3组动物的血药浓度和AUC均随剂量增加而增大,呈一定的剂量效应关系;消除半衰期t1/2β和清除率CL呈非剂量依赖性改变,提示药物消除符合线性动力学特征。本课题组也曾采用酶联免疫分析法研究猕猴单次静脉滴注rhEndostatin(3 mg/kg)的药物代谢动力学行为,6只猕猴的消除半衰期在180~450 min间,与TCA-RA法测定大鼠的t1/2β(243~265 min)比较接近。
大鼠静脉注射rhEndostatin 10 mg/kg后,组织分布呈特异性靶向分布,且肾脏是主要的靶组织(肾的含药量最高),该结果也基本反映了rhEndostatin主要经肾由尿排泄的消除途径。文献报道[8-10],多肽或蛋白类药物(例如重组人白介11和抗IgE抗体)主要分布在肾脏或肝脏代谢和排泄器官中,与rhEndostatin具有相似的分布和代谢模式。本试验研究结果为该药临床试验提供了有价值的实验数据。
[1]O’Reilly M S,Boehm T,Shing Y,et al.Endostatin:an endogenous inhibitor of angiogenesis and tumor growth[J].Cell,1997,88:277-285.
[2]Pufe T,Petersen W J,Miosge N,et al.Endostatin/collagen ⅩⅧ——an inhibitor of angiogenesis——is expressed in cartilage and fibrocartilage[J].Matrix Biol,2004,23(5):267-276.
[3]Jia Y,Liu M,Huang W,et al.Recombinant human endostatin endostar inhibits tumor growth and metastasis in a mouse xenograft model of colon cancer[J].Pathol Oncol Res,2012,18(2):315-323.
[4]邢静,樊燕蓉,冯志英,等.重组人内皮抑素DOPS胶束的制备及抑瘤效应研究[J].药学与临床研究,2010,18(6):516-519.
[5]乔路,夏杰,陆兵,等.重组人内皮抑素层析复性的相关研究[J].华东理工大学学报(自然科学版),2008,34(2):203-207.
[6]毕华,饶春明,史新昌,等.重组人内皮抑素的氨基酸组成分析[J].药物分析杂志,2007,27(6):857-859.
[7]Hu B,Zhu H W,Zhu L P,et al.Bioactivity,pharmacokinetics,and immunogenicity assays in preclinical and clinical trials for recombinant human endostatin[J].Acta Pharmacol Sin,2008,29(11):1357-1369.
[8]Fox J A,Hotaling T E,Struble C,et al.Tissue distribution and complex formation with IgE of an anti-IgE antibody after intravenous administration in cynomolgus monkeys[J].J Pharmacol Exp Ther,1996,279(2):1000-1008.
[9]Takagi A,Masuda H,Takakura Y,et al.Disposition characteristics of recombinant human interleukin-11 after a bolus intravenous administration in mice[J].J Pharmacol Exp Therm 1995,275(2):537-543.
[10]Hu Z,Niu H,Yang X,et al.Recombinant human parathyroid hormone 1-34:pharmacokinetics,tissue distribution and excretion in rats[J].Int J Pharm,2006,317(2):144-154.
