大鼠抑郁障碍与心血管组织炎性标记物的相关性研究
2012-10-25陈莹常志文翟艳苓张勇杨琳林文娟
陈莹 常志文 翟艳苓 张勇 杨琳 林文娟
抑郁症在冠心病患者中颇为常见[1],已有许多文献报道抑郁症对冠心病的发生、发展及预后有负面影响。早在20世纪30年代,就有医师观察到抑郁症患者(当时叫忧郁症melancholia)死于心血管疾病的比例高于常人。近年来对于抑郁症影响动脉粥样硬化形成的机制越来越多地成为基础研究的热点,部分学者提出抑郁障碍通过炎症反应促进动脉粥样硬化发生发展,然而有关抑郁障碍与炎性标记物相关性的资料报道较少,且观点不一致[2-4]。核因子-κB(nuclear factor-kappa B,NF-κB)的激活是动脉粥样硬化发生发展的始动机制之一,本研究探讨抑郁障碍是否通过启动NF-κB表达来促进冠心病的发生发展,以及抗抑郁治疗阻断NF-κB表达能否为临床治疗冠心病开辟新的途径。
1 材料和方法
1.1 主要药品和试剂
氟西汀和丙咪嗪(Sigma公司),血清高敏C反应蛋白(hypersensitive C-reaction protein,hsCRP)检测试剂(上海基恩科技有限公司),血清单核细胞趋化 因 子 1(monocyte chemoattractantprotein-1,MCP-1)检测试剂(RB公司),鼠抗人NF-κB p65单克隆抗体、山羊抗鼠MCP-1多克隆抗体,兔抗人κB抑制蛋白(inhibitory kappa B,IκB)多克隆抗体,Actin内参(Santa Cruz Biotechnology)。
1.2 动物分组、模型复制及给药方案
雄性SD大鼠50只,平均体质量(175±24)g,2.5月龄,购自北京维通利华实验动物中心,合格证号 SCXK(京)20050003。于 24℃、12/12 h 光照/黑暗交替实验环境饲养,正常饮食,适应饲养环境1周后,随机抽签分为5组,每组10只:CS组为对照组,又给予生理盐水腹腔注射;CI组也为对照组,给予丙咪嗪10 mg/kg腹腔注射;SS组为游泳应激组,给予生理盐水腹腔注射;SF组为氟西汀干预组,游泳应激同时给予氟西汀10 mg/kg腹腔注射;SI组为丙咪嗪干预组,游泳应激同时给予丙米嗪10 mg/kg腹腔注射。行为绝望大鼠模型参照文献[5]并加以改进。具体方法如下:每日不定时将大鼠置于水温10℃、水深为30 cm的水池(2.0 m×1.0 m×1.5 m)中强迫其游泳,连续21 d,每日1次,每次1只,强迫游泳时间为每次5 min。游泳结束后迅速用干毛巾、吹风机将游泳大鼠皮毛擦干,然后放回笼中。
1.3 行为学观察指标
(1)open-field旷场:观察大鼠水平移动距离、直立动作、探究行为、修饰动作和排泄行为。(2)基础糖水/纯水消耗试验:计算大鼠的糖水消耗、纯水消耗、总液体消耗、糖水偏爱(糖水偏爱=糖水消耗/总液体消耗×100%)。(3)体质量变化:观察体质量增长量的变化。
1.4 大鼠外周血hsCRP、MCP-1含量测定
应激结束后48 h内,将大鼠断头处死,应用不含抗凝剂真空采血管采集血液3 ml,离心提取上清液,-80℃低温冰箱保存。血清MCP-1检测采用酶联免疫夹心法(ELISA),并用自动酶标仪(波长490 nm)分析结果。
1.5 大鼠血管组织MCP-1、NF-κB p65检测
分离胸主动脉,留取主动脉弓向下1 cm处血管组织置于10%中性甲醛溶液中固定待检,另留取血管组织置于-80℃低温冰箱冻存待检。石蜡包埋,5 μm连续切片、脱蜡、入水,3%H2O2去离子水室温孵育5 min,消除内源性过氧化物酶活性,抗原修复,滴加适当比例兔来源一抗,4℃冰箱过夜,PBS冲洗,滴加山羊抗兔IgG抗体-HRP多聚体,室温孵育30 min,PBS冲洗,DAB显色,脱水、透明、封片、镜检,应用真彩色医学图像分析软件(Image Pro Plus 5.0,Midia Cybemetics公司)对 MCP-1、NF-κB p65 表达结果进行半定量分析,比较MCP-1、NF-κB p65在不同组间阳性表达的平均面积。
1.6 大鼠血管组织 NF-κB p65、MCP-1、IκB-α 检测
蛋白电泳应用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis,SDS-PAGE)。
1.7 统计学方法
2 结果
2.1 应激前后各组大鼠体质量和行为学指标变化
游泳应激前各组大鼠体质量差异无统计学意义,行为学指标差异无统计学意义(P>0.05),提示各组大鼠应激前在体质量、行为上大致相同。
游泳应激后各组大鼠体质量增长不同(P=0.001),SS组大鼠体质量增长最低,CS组大鼠体质量增长最快,实验过程中8只大鼠死亡。
游泳应激后行为学指标检测结果中,各组间也存在不同程度的差异,其中水平活动距离检测中,SS组和SF组大鼠水平活动距离最短,CS组和CI组大鼠水平活动距离最长(P=0.004);直立动作和探究行为检测中,SS组、SF组和SI组大鼠得分最低,CS组和CI组大鼠得分最高(P=0.000和P=0.000);修饰动作和排泄次数检测中,SS组大鼠得分最高,CS组、CI组、SF组和SI组大鼠得分均明显低于SS组(P=0.001和P=0.014)(表1)。
2.2 应激对各组大鼠液体消耗的影响
应激前各组大鼠基线糖水消耗、纯水消耗、总液体消耗和糖水偏爱百分比差异均无统计学意义。
游泳应激21 d后,SS组的糖水消耗和糖水偏爱百分比都显著低于CS组、CI组和SF组,而纯水消耗量则显著高于CS组、CI组和SF组,总液体消耗各组间差异无统计学意义。SI组糖水消耗介于SS组和CS组之间,与两组差异均无统计学意义,糖水偏爱百分比与SS组相同,而显著低于CS组、CI组和SF组,纯水消耗量也与SS组相同,而显著高于CS组、CI组和SF组,总液体消耗与各组间差异无统计学意义(表2)。
2.3 应激后各组大鼠外周血hsCRP和MCP-1含量
游泳应激后各组大鼠外周血hsCRP和MCP-1含量差异有统计学意义(P=0.004,P=0.000),SS组大鼠外周血hsCRP和MCP-1含量明显高于CS和CI组(表3)。
2.4 免疫组化法检测应激后各组大鼠MCP-1和NF-κB p65 表达
SS组大鼠血管内皮细胞MCP-1呈阳性表达,为环绕胞膜及胞浆内棕黄色颗粒,且阳性表达的平均面积显著高于CS和CI组(P<0.05)。SI组也可看到部分血管内皮细胞MCP-1呈阳性表达,但与CS和CI组差异无统计学意义。NF-κB活化后即发生核转位,由胞质转移至胞核,SS组大鼠血管内皮细胞NF-κB呈阳性表达,为胞核浓染棕黄色颗粒,阳性表达的平均面积显著高于CS和 CI组(P<0.05)(表4,图1~2)。
2.5 蛋白印迹法检测应激后各组大鼠MCP-1和NF-κB p65/IκB-α 表达
检测大鼠血管组织细胞MCP-1、NF-κB p65水平,CS组和CI组大鼠血管组织细胞MCP-1几乎无表达,SS组、SI组和 SF组大鼠血管组织细胞MCP-1、NF-κB p65表达水平明显上调。胞浆中IκB-α 表达显著减少(表5)。
表1 应激后各组大鼠行为学指标()
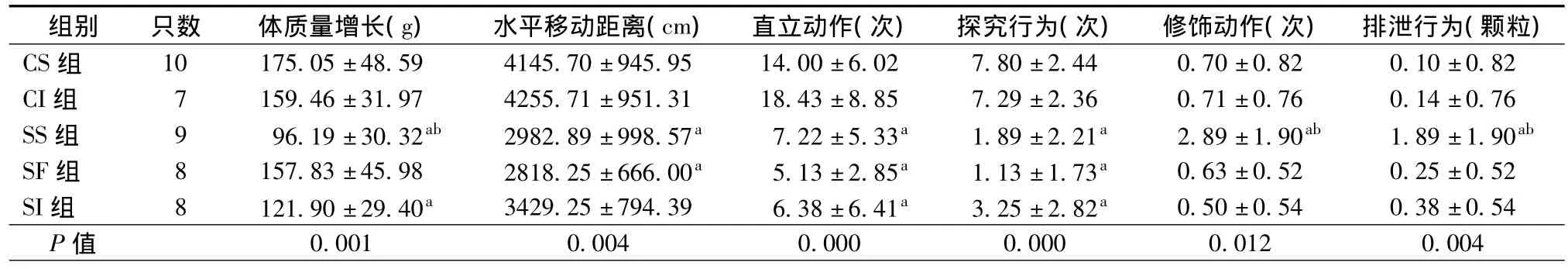
表1 应激后各组大鼠行为学指标()
注:与CS组比较,aP<0.05;SS组与SF组或SI组比较,bP<0.05
?
表2 应激后各组大鼠液体消耗实验()

表2 应激后各组大鼠液体消耗实验()
注:与CS组比较,aP<0.01;SS组或SF组与SI组比较,bP<0.01;SF组与SI组比较,cP<0.01
?

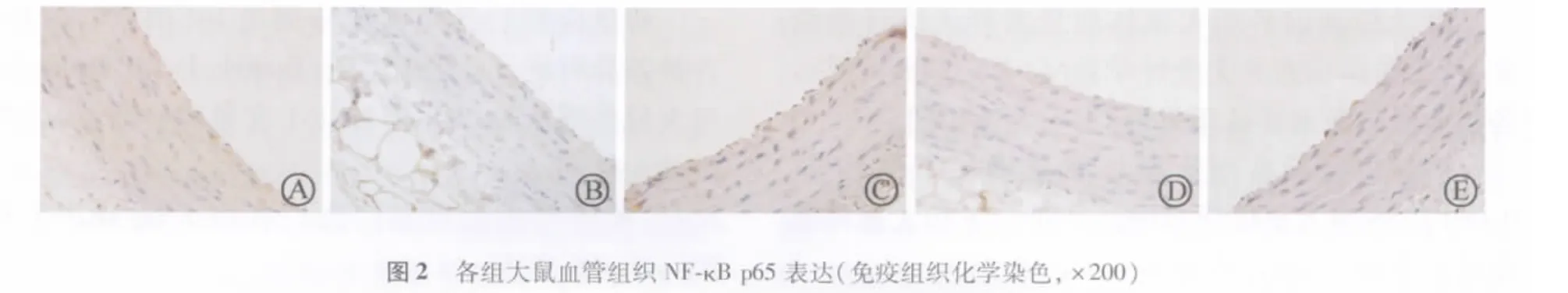
表3 应激后各组大鼠外周血hsCRP和MCP-1水平()
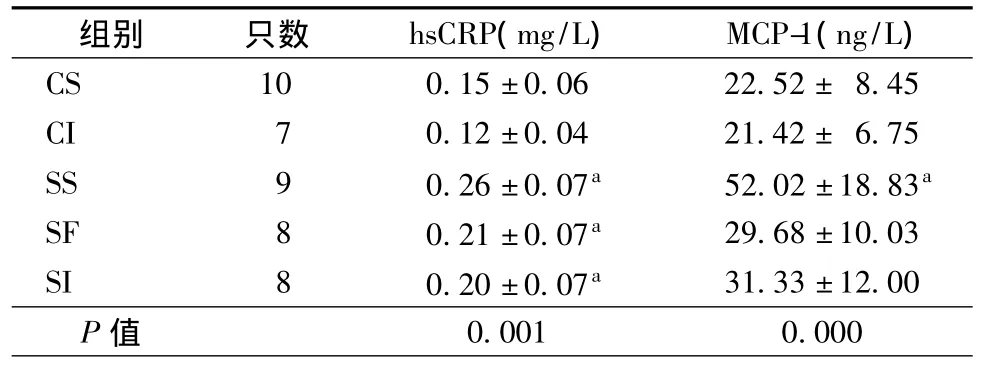
表3 应激后各组大鼠外周血hsCRP和MCP-1水平()
注:与CS组比较,aP<0.01
组别 只数 hsCRP(mg/L) MCP-1(ng/L)CS 10 0.15±0.06 22.52± 8.45 CI 7 0.12±0.04 21.42± 6.75 SS 9 0.26±0.07a 52.02±18.83a SF 8 0.21±0.07a 29.68±10.03 SI 8 0.20±0.07a 31.33±12.00 P值0.001 0.000
表4 应激后各组大鼠血管组织MCP-1和NF-κB p65表达()

表4 应激后各组大鼠血管组织MCP-1和NF-κB p65表达()
注:与CS组比较,aP<0.05
组别 只数 MCP-1 NF-κB p65 CS 10 25.3±6.1 20.2±5.6 CI 7 25.1±5.0 18.6±5.6 SS 9 35.6±7.5a 31.2±6.5a SF 8 26.6±5.1 25.4±4.4a SI 8 28.0±5.7 23.1±6.2
表5 Western blot检测各组大鼠血管组织MCP-1、NF-κB p65、IκB-α表达()
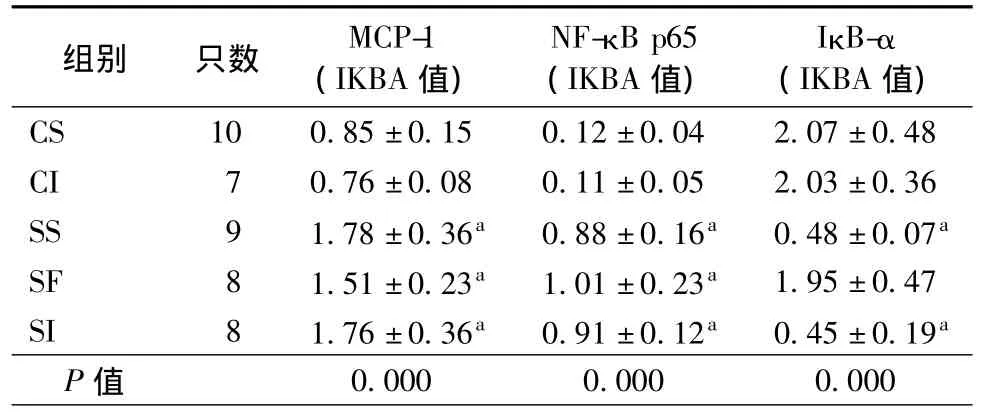
表5 Western blot检测各组大鼠血管组织MCP-1、NF-κB p65、IκB-α表达()
注:与CS组比较,aP<0.013
组别 只数 MCP-1(IKBA值)NF-κB p65(IKBA值)IκB-α(IKBA值)CS 10 0.85±0.15 0.12±0.04 2.07±0.48 CI 7 0.76±0.08 0.11±0.05 2.03±0.36 SS 9 1.78±0.36a 0.88±0.16a 0.48±0.07a SF 8 1.51±0.23a 1.01±0.23a 1.95±0.47 SI 8 1.76±0.36a 0.91±0.12a 0.45±0.19a P值0.000 0.000 0.000
3 讨论
动脉粥样硬化是冠心病的病理基础,炎症又是动脉粥样硬化的基本特征。大量研究表明,冠心病的发生发展与炎症密切相关[6-8]。抑郁症患者体内炎性标记物水平的变化是近几年来各国学者新的发现,那么抑郁症和炎症反应谁起始动作用,各国学者们均做了进一步研究[9]。冠心病患者中抑郁障碍颇为常见,因此部分学者提出抑郁障碍通过炎症反应促进动脉粥样硬化发生发展。本研究结果显示,游泳应激组大鼠不仅外周血炎性标记物水平增高,而且血管壁炎性标志物NF-κB p65和MCP-1呈阳性表达,NF-κB p65和MCP-1蛋白水平增高,提示抑郁模型建立过程中启动了炎症反应。
MCP-1基因启动子中含有 NF-κB结合位点,NF-κB是转录因子家族的重要成员,主要由p50和p65二亚基所组成。细胞静息状态下,NF-κB与其抑制因子IκB相结合,使NF-κB以无活性的形式存在于胞质中,当细胞受到各种刺激后,IκB发生快速泛蛋白化及蛋白酶解,NF-κB即被活化,并很快易位到核中,与靶基因的启动子区域κB基序结合,启动基因的转录和蛋白合成。作为重要的转录因子,NF-κB对多种促炎症细胞因子、黏附分子、趋化因子和生长因子等的表达起着关键的调控作用。NF-κB参与炎症过程中的多种信号传导途径,并且在动脉粥样硬化晚期参与平滑肌细胞增殖的生长因子亦由NF-κB调控,因而认为NF-κB的激活是动脉粥样硬化发生发展的始动机制之一。本实验结果显示,应激组大鼠血管组织中NF-κB p65和MCP-1表达均增强,血管组织胞浆中 IκB-α 表达下降,表明NF-κB p65核转位是由 NF-κB 的抑制因子 IκB 降解所致,提示NF-κB/IκB信号通路可能介导了大鼠血管组织MCP-1表达,活化的NF-κB p65可能通过促进MCP-1表达而诱导单核细胞黏附于血管壁并穿入内皮下吞噬脂质形成泡沫细胞,形成动脉粥样硬化早期病理改变。
抑郁症属于情感性精神障碍性疾病,是一种以显著而持久的心境低落为主要特征的综合征。本研究对21 d强迫游泳试验后的大鼠进行了相关行为学测试,实验结果显示SS组大鼠open-field旷场实验得分,包括水平移动距离、直立动作和探究行为,以及体质量增长均低于正常对照组,而修饰动作和排泄行为均高于正常对照组,反映出游泳应激组大鼠处于抑郁情绪状态,在行为学方面表明了该模型的成功建立。
本研究选用传统三环类抗抑郁药物丙咪嗪和目前临床上常用的抗抑郁剂选择性5-HT重摄取抑制剂氟西汀,对比药物干预组大鼠与对照组在炎性标记物方面的差异,分析药物干预对于上述检测指标的影响效果。研究结果提示抗抑郁剂均发挥了一定抗抑郁疗效,外周血炎性标记物含量检测和应用免疫组织化学染色、Western印迹检测结果提示,抗抑郁药的应用可不同程度地减少大鼠外周血炎性标记物含量,下一步的研究应设定不同药物剂量及增加观测时间点,进一步明确抗抑郁治疗对于动脉粥样硬化发生发展的影响。
本研究结果表明抑郁障碍通过启动炎症因子NF-κB表达,在冠心病发生发展中发挥一定作用,抗抑郁治疗可改善抑郁相关症状并可能通过降低外周血、血管组织炎性标记物水平,为冠心病治疗提供了新思路。
[1]Frasure-Smith N,Lespérance F.Depression and cardiac risk:present status and future directions.Heart,2010,86:193-196.
[2]Panagiotakos DB, Pitsavos C, Chrysohoou C, et al.Inflammation,coagulation,and depressive symptomatology in cardiovascular disease-free People;the ATTICA study.Eur Heart J,2004,25:492-499.
[3]Davidson KW,Schwartz JE,Kirkland SA,et al.Relation of inflammation to depression and incident coronary heart disease(from theCanadian NovaScotiaHealth SurveyNSHS95 Prospective Population Study).Am J Cardiol,2009,103:755-761.
[4]Pozuelo L,Tesar G,Zhang J,et al.Depression and heart disease:what do we know,and where are we headed?Cleve Clin J Med,2009,76:59-70.
[5]Porsolt RD,Anton G,Blavet N,et al.Behavioural despair in rats:a new model sensitive to antidepressant treatments.Eur J Pharmacol,1978,47:379-391.
[6]Danesh J,Pepys MB.C-reactive protein and coronary disease:is there a causal Link?Circulation,2009,120:2036-2039.
[7]Schillinger M,Exner M,Mlekusch W,et al.Inflammation and carotid artery——risk for atherosclerosis study(ICARAS).Circulation,2005,111:2203-2209.
[8]Deguchi JO,Aikawa M,Tung CH,et al.Inflammation in atherosclerosis:visualizing matrix metalloproteinase action in macrophages in vivo.Circulation,2006,114:55-62.
[9]Empana JP,Sykes DH,Luc G,et al.Contributions of depressive mood and circulating inflammatory markers to coronary heart disease in healthy European men: the Prospective Epidemiological Study of Myocardial Infarction (PRIME).Circulation,2005,111:2299-2305.