滨州地区鸡大肠杆菌的分离鉴定及药敏试验
2012-10-24齐凤云孙少丽山东农业大学动物科技学院271018山东省滨州第二高级技师学院
齐凤云 孙少丽(①山东农业大学动物科技学院 271018 山东省滨州第二高级技师学院)
滨州地区鸡大肠杆菌的分离鉴定及药敏试验
齐凤云①②孙少丽②(①山东农业大学动物科技学院 271018 ②山东省滨州第二高级技师学院)
从滨州地区各养鸡场的发病鸡中分离出大肠杆菌,经常规方法培养、纯化、镜检及生理生化鉴定,分离出的18株鸡致病性大肠杆菌12株分离株被鉴定出血清型,血清型主要有078、035、036、01、02、05、018。药敏试验结果表明:分离的大肠杆菌对氟苯尼考,丁胺卡那霉素,新霉素,庆大霉素敏感,对环丙沙星,强力霉素,诺氟沙星中度敏感,而对红霉素,青霉素,链霉素产生了耐药。
鸡 大肠杆菌 分离鉴定 耐药
大肠杆菌病是由大肠埃希氏菌(Escherchia Coli)的某些血清型菌株所引起的一类传染病的总称。此试验是采集滨州地区鸡的病料进行分离鉴定和耐药试验,从而为当地农户提供帮助,提高经济效益。
1 材料与方法
1.1 材料
1.1.1 病料来源 病料来源于滨州地区各养殖场及养殖户送检的病、死鸡,临床剖检有典型心包炎、肝周炎、气囊炎或卵黄性腹膜炎,疑似为大肠杆菌病。
1.1.2 培养基 营养琼脂、营养肉汤、麦康凯琼脂均购于上海伯奥生物科技有限公司。微量生化发酵管,购于杭州天和微生物试剂有限公司。
1.1.3 药敏试纸 红霉素、环丙沙星、青霉素、氟苯尼考、链霉素、庆大霉素、氟呱酸、丁胺卡那霉素、强力霉素、新霉素等10种药敏试纸片购自杭州天和微生物试剂有限公司。
1.1.4 试验动物 小鼠购自山东省医学实验动物中心。
1.1.5 主要仪器 超净工作台,上海市跃进医疗器械一厂;培养箱,上海市跃进医疗器械一厂;高压蒸汽灭菌器,山东新华医疗股份有限公司;光学显微镜、电子天平,上海市跃进医疗器械一厂。
1.2 方法
1.2.1 培养基的制备 血琼脂平板的制备:按常规法(谢正肠等,1994)制备,加入5%的绵羊血,冷却后置于4℃冰箱中备用。营养琼脂平板和麦康凯琼脂平板的制备:按常规法(谢正肠等,1994)制备,冷却后于37。C温箱培养16~24h,检查无菌后置于4℃冰箱备用。营养肉汤的制备:按常规法(谢正肠等,1994)制备,冷却后于4℃冰箱中备用。
1.2.2 细菌分离鉴定 选择疑似大肠杆菌病死鸡的病料接种于普通营养琼脂平板上,经过37℃培养16~24h,然后对可疑菌株再进行操作。
1.2.3 染色镜检 按常规步骤进行染色。
1.2.4 病原菌的分离纯化及生化试验 取病料无菌接种于普通营养琼脂平板上,经过37℃培养18~24h后,观察结果。选取具有隆起、圆形、光滑、湿润、半透明的近无色的菌落,分别划线接种于麦康凯琼脂和伊红美兰琼脂平板上,置37℃培养18~24h,4℃保存备用。分别作各种糖发酵试验吲哚试验、三糖铁试验、尿素酶试验、MR、V-P。
1.2.5 致病力测定 随机抽取麦康凯上纯培养的菌落,接种于营养肉汤中,取24h内培养物作注射液,腹腔接种于健康1日龄小鸡,每只小鸡注射0.2ml,每株菌注射2只小鸡,并作对照。24h内发病并死亡者,判定为高致病力菌株。24~48h内发病并死亡者,判定为中致病力菌株记录死亡数,48h后死亡者判定为低致病力菌株。然后,从死亡鸡的心、肝中回收接种菌。
1.2.6 分离菌的血清型鉴定 (1)抗原的制备。将纯培养的被检验菌株接种于普通琼脂斜面小管和普通肉汤小瓶培养基(50ml),于37℃培养24h,期间震荡肉汤数次。用0.5%石炭酸生理盐水洗下普通琼脂斜面小管培养物,然后以2000r/min离心5min,取上悬液以2000r/min离心10min,取沉淀物制成浓稠菌悬液,放于小圆底试管中,再与普通肉汤小瓶培养物一起于121℃高压2h,4℃保存备用。(2)血清的稀释。多价血清的配制:将多种大肠埃希氏菌因子冻干血清混合溶解于0.5%石炭酸生理盐水10ml,装入小瓶,盖紧,4℃冰箱保存。单因子血清的配制:将每种大肠埃希氏菌因子血清溶解于5ml 0.5%石炭酸生理盐水中,置于小瓶,盖紧,置4℃冰箱保存。(3)玻板凝集反应。取试管己制成的高压抗原,先与大肠埃希氏菌多价血清进行玻板凝集反应,然后再与大肠埃希氏菌单因子血清进行玻板凝集反应。把高压抗原和血清各取一铂金耳置玻板上混匀,0.5min内出现明显凝集者为“阳性”。同时以高压抗原与0.5%石炭酸生理盐水混合物作对照,观察有无自凝集现象。最终结果判定:以“++”作为被检抗原的效价终点。
1.2.7 药敏试验 接种环挑取适量细菌培养物,以划线方式将细菌涂布到平皿培养基上,将平皿培养基置于37℃温箱中培养24h后,观察效果。判定标准见表1。

表1 药敏纸片的种类及判定标准抑菌圈直径 (mm)
2 结果
2.1 细菌分离鉴定
2.1.1 细菌分离 37℃培养24h后,普通肉汤呈均匀混浊,试管底部有淡白色粘稠沉淀,轻轻摇晃呈云雾状散开,并有臭粪味。在营养琼脂平板上,为圆形微凸起,表面光滑湿润,中等大小,浅灰色半透明菌落,在血液琼脂上出现边缘整齐,菌落较大,并有隆起的灰白色菌落,多数不溶血。在麦康凯琼脂平板上,形成中等大小表面光滑湿润的粉红色菌落。在伊红美蓝琼脂平板上,形成带有金属光泽的紫黑色小菌落。
2.1.2 细菌鉴定 从滨州不同的乡镇的20多个鸡场病例中,共分离到18株疑似大肠杆菌。病死鸡心、肝组织及培养物涂片染色镜检可见大多数分散排列,两端钝圆,偶尔有2~3个连在一起,两端浓染的革兰氏阴性短杆菌。分离到的18株菌,各菌均对大多数糖类(葡萄糖、果糖、乳糖、麦芽糖、甘露糖,缓慢发酵蔗糖)产酸产气,MR试验阳性,V-P试验阴性,产生靛基质,三糖铁底层产酸,尿素酶试验阴性。见表2。
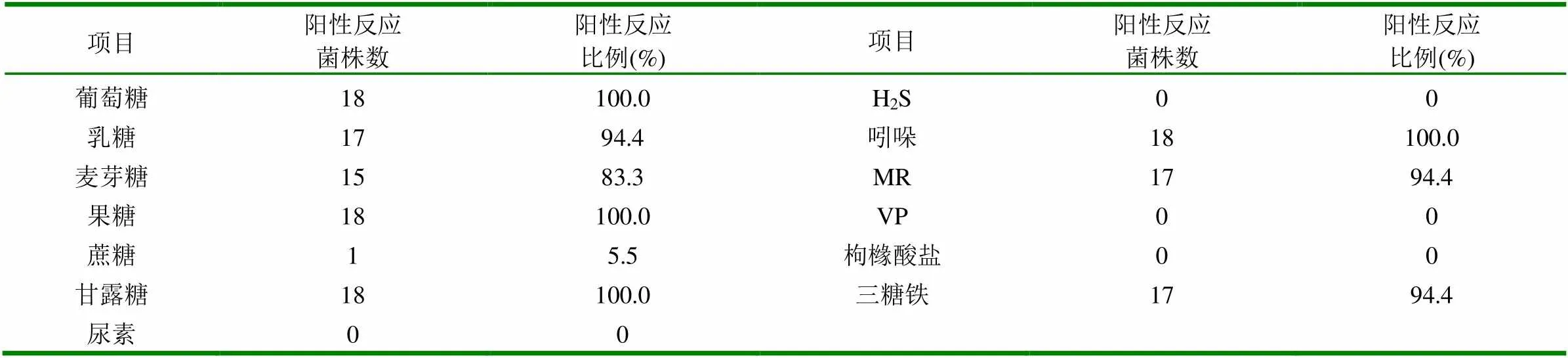
表2 18株分离菌的生化鉴定结果
2.2.3 分离菌株的致病性结果 根据雏鸡及小鼠接种大肠杆菌后出现的症状、剖检变化的不同及死亡时间,可以将所分离的大肠杆菌分为3组。强毒组,有10株接种后24h内小鼠及雏鸡全部死亡;剖检呈急性败血症变化,死亡雏鸡在剖检时,表现为纤维素性心包炎,心包积液,心包膜心外膜有大量纤维蛋白沉着;气囊炎,气囊表面及气囊中有量黄白色干酪样渗出物;脾脏肿大、出血肝周炎、肝脏表面被一层薄膜状的纤维素性渗出物班盖。中毒组,有5株接种后24h内小鼠及雏鸡各死亡2/3,雏鸡及小鼠均出现腹泻,精神沉郁等症状。弱毒组,有3株接种后24h内1/3的小鼠及雏鸡致死,雏鸡、小鼠出现精神沉郁、腹泻等症状。从死亡鸡及小鼠肝脏、心血及脾脏回收细菌的染色、生化特性与接种菌一致。
2.2.4 血清型鉴定结果

表3 18株分离菌血清型鉴定结果
从表3中可以看到:18株分离的菌株中,定型菌株有12株,6株未定型。血清型主要有078、035、036、01、02、05、018。其中078共有4株占33.3%,035共有3株占25%为滨州的优势血清型。
2.2.5 药敏试验结果见表4。
由表4可以看出:分离的大肠杆菌对氟苯尼考,丁胺卡那霉素,新霉素,庆大霉素不同方位高度敏感,对环丙沙星,强力霉素,诺氟沙星中度敏感,而对红霉素,青霉素,链霉素产生了耐药。
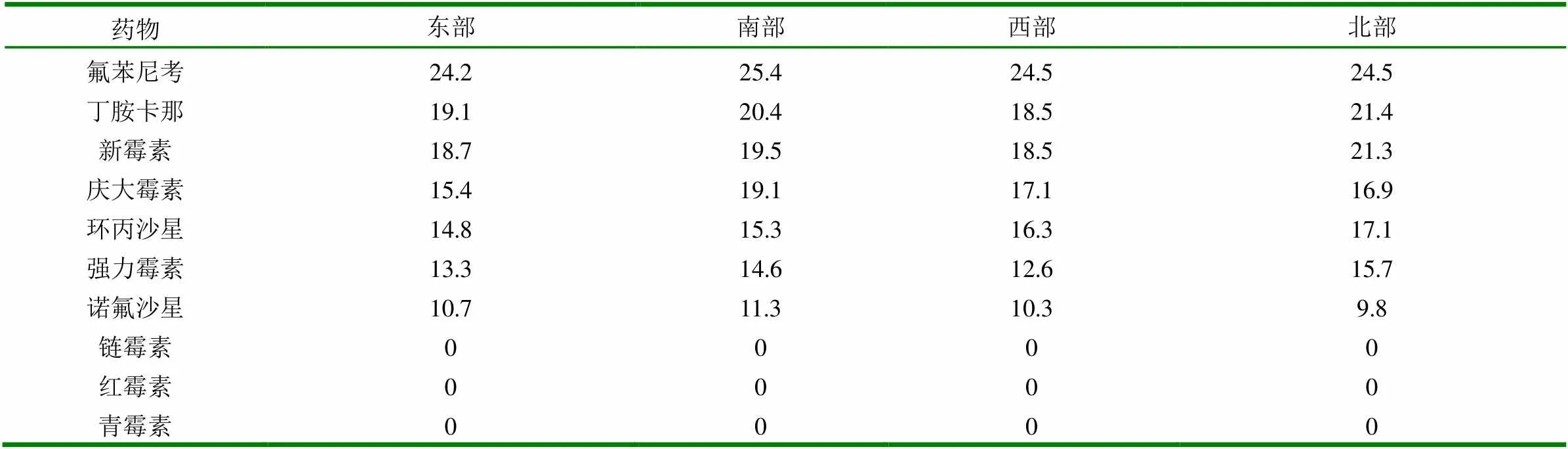
表4 滨州地区不同方位分离菌平均抑菌圈直径 (mm)
3 讨论
3.1 病原的特点
试验结果表明:从8个不同镇20个鸡场分离到的18株菌对大多数糖类产酸产气,V-P试验阴性,产生靛基质,MR试验阳性,三糖铁底层产酸,尿素酶试验阴性。这都符合大肠杆菌的特征;分离菌株接种雏鸡均具有致病性。其中55.56%的分离菌株具有高致病性,27.78%的分离菌株具有中致病性,16.67%的分离菌株具有低致病性。由此可见,鸡大肠杆菌病给生产带来巨大的损失。
3.2 病原的来源
致病型大肠杆菌优势血清型在我国不同地区种类差异很大,本次试验分离的078、035是滨州地区的优势血清型。同一地区,血清型差异也很大,这可能与鸡苗的来源不同有关系。鸡苗的大流通可能带来了大肠杆菌的传播。
3.3 病原变异的原因
环境中大肠杆菌耐药性菌株越来越多,这主要是与以下几种因素有关:首先用药过程中剂量、选药、疗程不当;其次是严重滥用抗生素。现在几乎所有的养鸡户都在滥用抗菌素的现象。临床中,抗菌素也能造成鸡病,对养鸡业造成一定危害。
3.4 影响药敏结果的因素
(1)培养基:应根据试验菌的营养需要进行配制。倾注平板时,厚度合适约5~6nm,不可太薄,一般直径的培养皿90nm,倾注18~20ml培养基为宜。培养基内应尽量避免有抗菌药物的拮抗物质,如钙、镁离子能使氨基糖营类的抗菌活性降低,胸腺嚓陡核普和对氨苯甲酸能拮抗磺胺药和TMP的活性。(2)细菌接种量:细菌接种量应该稳定,如果太多,抑菌圈就会变小,能产酶的菌株更可破坏药物的抗菌活性。(3)药物浓度:抑菌试验的结果受药物的浓度和总量直接影响,需精确配制。商品药应严格按照其推荐治疗量配制。(4)培养时间:一般培养温度和时间为37℃ 9~20h,有些抗菌药扩散慢。如多粘菌素,可将已放好抗菌药的平板培养基,先置5℃冰箱内2~5h,使抗菌药预扩散,然后培养在37℃温箱中,可以延长细菌的生长,而得到较大的抑菌圈。
3.5 防治的药物
临床用氟苯尼考、丁胺卡那霉素、庆大霉素、硫酸新霉素可以达到比较好的效果。但随着耐药菌株的日益增多,抗生素对大肠杆菌的防治效果越来越差,而且现在药物用量也越来越大,最后会导致药物残留,从而影响家禽产品质量,威胁人类的健康。因此,加强生物安全措施,合理使用疫苗,选择有效的抗生素,才是控制大肠杆菌最经济有效的方法。
4 结论
(1)从滨州地区分离到鸡致病性大肠杆菌18株菌株,通过O因子血清学鉴定,定型菌株有12株,6株未定型。血清型主要有078、035、036、01、02、05、018。其中078共有4株占33.3%,035共有3株占25%为滨州地区的优势血清型。(2)药敏试验结果表明,分离的大肠杆菌对氟苯尼考,丁胺卡那霉素,新霉素,庆大霉素敏感,对环丙沙星,强力霉素,诺氟沙星中度敏感,而对红霉素,青霉素,链霉素产生了耐药。(3)致病性试验中,高致病性菌株有10株,中度致病菌株有5株,低致病性菌株有3株,分别占试验菌株总数的55.6%、27.8%、16.7%。
[1] 林维庆. 鸡大肠杆菌病[J]. 华南农业大学学报,1991, 12(3): 7-13.
[2] 邵华斌等. 湖北省鸡大肠杆菌病流行情况调查及病原分离鉴定[J]. 中国兽医科技, 1998, 28(9):14-15.
[3] 陆承平主编. 兽医微生物学汇[M]. 第3版. 北京: 中国农业出版社, 2001.215-223.
[4] 丁伯良等. 天津地区鸡致病性大肠杆菌血清型分布及其优势血清型的外膜蛋白型研究[J]. 动物医学研究进展, 2003, 24(2): 94-96.
[5] 高轩等. 河北省禽病原性大肠杆菌的血清型鉴定[J]. 河北农业大学学报, 1998, 21(1): 56-59. 1996,26(3): 15-17.
[6] Chulasiri,M and O.Suthienkul.Antimicrobial resistance of Escherichia coli isolated from chichens[J].Vet microbion.1989,21,189-194.
[7] Lior, H. Classification of Escherichia coli.In C. L. Gyles(ed). Escherichia coli in Domestic Animals and Humans. CAB.Int’l, Wallingf-Ord, United Kingdom, pp. 1994. 31-72
(2012–02–23)
S858.31
A
1007-1733(2012)05-0004-03
