劳盆地热液喷口沉积物微生物多样性初步研究
2012-10-23郭文婷刘晓曦
郭文婷, 刘晓曦, 王 鹏
(同济大学 海洋地质国家重点实验室, 上海 200092)
劳盆地热液喷口沉积物微生物多样性初步研究
郭文婷, 刘晓曦, 王 鹏
(同济大学 海洋地质国家重点实验室, 上海 200092)
采用聚合酶链式反应限制性片段长度多态性分析(PCR-RFLP)技术对劳盆地热液区TVG9站位沉积物中细菌、古菌多样性进行了调查, 并构建其细菌、古菌种群的16S rRNA基因文库。研究结果表明, 该站位细菌包含变形杆菌(Proteobacteria)、硝化螺旋菌(Nitrospira), 疣微菌(Verrucomicrobia)等3个类群, 其中变形杆菌占据优势地位, 由Alphaproteobactria, Gamaproteobactria, Deltaproteobactria等 3个亚群组成。古菌包含泉古菌(Crenarchaeota)和广古菌(Euryarchaeota), 其中泉古菌占优势,由MGⅠ(Marine GroupⅠ)和MCG(Miscellaneous Crenarchaeotal Group)两类群组成, 而广古菌主要由MBGE(Marine Benthic Group E)组成。旨在揭示深海热液区的微生物多样性, 为生态环境的研究提供理论支持。
劳盆地; 热液喷口; 沉积物; 微生物多样性; 聚合酶链式反应限制性片段长度多态性分析(PCR-RFLP)
1977年人类首次在加拉帕戈斯海岭发现热液喷口, 之后在东北太平洋 Juan de Fuca、大西洋中脊Rainbow热液区、Lost City热液区、印度洋中脊、北冰洋洋中脊等处都有类似发现。深海热液喷口具有高温、高压等特征, 不断释放出含有高浓度有毒元素(硫和重金属)的缺氧热液羽流, 在与周围冷海水逐渐混合过程中, 呈现出急剧变化的温度、化学梯度,为生理、代谢机制及系统发育有所不同的微生物提供了巨大的潜在栖息地[1]。热液喷口是深海极端环境中的极端, 尤其是其中不依赖于太阳能的黑暗食物链的发现, 激发起人们对深海生物多样性及生命起源和进化的极大兴趣[2-3]。由于传统微生物培养手段的局限性及深海生境的特殊性,自沉积物和洋壳中分离得到的微生物数量非常有限[4-5]。20世纪 80年代末至90年代, 分子生物学技术开始被广泛应用于微生物群落结构的分析[6-7]。近年来, 不依赖培养的16S rRNA基因鉴定技术揭示出大量先前未被发现的独特的微生物群落[8-9], 使对未培养微生物进行分析成为可能。多种分子生物学技术联合应用, 还可以弥补单一技术的不足, 因而成为微生物生态学研究中的常见手段[10]。
劳盆地位于西南太平洋汤加岛以西, 是残留岛弧(劳海岭)与活动火山弧(Tofua火山弧)之间的一个弧后盆地, 是第一个被认为由于火山岛弧扩张形成的年轻海盆[11]。1989年Nautile号潜水艇在此发现了众多活跃的热液喷口, 它们与在洋中脊的热液在生物群落、化学成分、温度、矿石成分等方面都有明显的差异[12]。以往的研究多集中在洋中脊热液区, 对弧后盆地热液区的微生物生态系研究还很少[13-14]。本文采用聚合酶链式反应限制性片段长度多态性分析(PCR-RFLP)技术, 对劳盆地深海热液喷口一个沉积物站位中的细菌和古菌分布进行了初步研究, 旨在了解该区域微生物生态系的组成及多样性, 为揭示微生物在海洋沉积物和洋壳中的生物地球化学作用[15-16]奠定基础, 进而促进深海热液生物资源的研究和利用。
1 材料与方法
1.1 材料
本文研究的样品来自“大洋一号”科考船2007年5月在劳盆地东劳扩张中心热液区的DY-19-4 TVG9站(176.6018°W, 22.1813°S), 由电视抓斗采样器采集。样品为铁红色沉积物。采用无菌方式进行二次取样后立即保存于-20℃, 运回实验室保存于-80℃。
1.2 方法
1.2.1 总DNA的提取、纯化
DNA提取采用Wang[17]等的方法。粗提DNA产物用QIAquik PCR纯化试剂盒(QIAGEN)纯化, 用于后续实验。
1.2.2 16S rRNA 基因PCR扩增和纯化
采用细菌 16S rRNA 基因通用引物(27F:5′—AGAGTT TGA TCM TGG CTC AG—3′; 1492R:5′—GGT TAC CTT GTT ACG ACT T—3′; M为A或C)[18]和古菌16S rRNA基因通用引物(21F:5′—TTC CGG TTG ATC CYG CCG CCG GA —3′; 958R:5′—YCC GGC GTT GAM TCC AAT T —3′; Y 为 C 或 T, M 同上)[19]进行 PCR扩增。扩增反应在 PTC-221热循环仪(BIO-RAD)上进行。细菌 PCR 扩增条件: 95℃3 min; 94℃ 1 min, 55℃ 1 min, 72℃ 1.5 min, 33 个循环; 72℃ 10 min。古菌PCR扩增条件: 95℃ 3 min;94℃ 1 min, 55℃ 1 min, 每个循环降低0.2℃, 72℃1.5 min, 35个循环; 72℃ 10 min。UNIQ-10柱式胶回收试剂盒(上海生工)纯化PCR产物。
1.2.3 克隆文库构建和RFLP 分析
将回收的 PCR 产物克隆到 PMD-18T载体(TaKaRa)上, 转化到E. coli DH5α感受态细胞中,涂布接种于含有X-gal和氨苄青霉素的LB培养基上,37℃培养16 h左右, 蓝白斑筛选法挑取阳性克隆子,进行菌落 PCR扩增。所得产物用限制性内切酶MspⅠ/HpaⅡ(Fermentas)37℃过夜酶切, 经 3%凝胶电泳得到RFLP酶切图谱。
1.2.4 测序与系统发育分析
挑选不同带型的克隆子测序(上海英俊生物技术有限公司), 将所得序列提交到 RDP Ⅱ(ribosomal database project)数据库, 利用在线工具 CHIMERA CHECK进行序列有效性验证; 通过 BLASTN程序(www.Ncbi.nlm.nih.gov/BLAST)搜索相似性序列,采用 Clustal X(version 1.8)对比分析序列, 利用MEGA(version 4)软件中的 Neighbor-Joining法构建系统发育树。
2 结果
2.1 DNA提取和PCR扩增
从5 g沉积物样品中抽提的环境基因组DNA片段大小集中在23 kb左右, 纯化后的扩增产物条带单一, 细菌和古菌的片段大小分别为1 500 bp和900 bp,表明扩增效果较好。
2.2 克隆文库的构建和RFLP分析
自克隆文库中随机挑选 88个细菌克隆子和96个古菌克隆子, 限制性内切酶酶切后进行 RFLP分析。根据酶切图谱和系统发育树构建结果, 细菌克隆文库可归属于50个OUTs(Operational Taxonomic Units), 3个优势 OUTs分别占总细菌文库的 18.0%,14.0%, 12.0%, 其余相对丰度较低, 仅含有1~3个克隆子。古菌可归属于16个OUTs, 其中4个优势OUTs分别为66.7%, 7.3%, 5.2%和4.2%, 其余12个OUTs的相对丰度较低, 仅含有1~2个克隆子。
2.3 细菌16S rRNA基因文库多样性分析
细菌文库可划分出 3个类群(图 1), 变形杆菌(Proteobacteria)占绝对优势(88.6%), 该门又可分为Alphaproteobactria, Gamaproteobactria, Deltaproteobactria三个亚群, 分别占细菌文库总量的 57.3%,27.4%和3.9%。其他类群含量相对较少: 8.0%归属于硝化螺旋菌(Nitrospira), 3.4%归属于疣微菌(Verrucomicrobia)。变形杆菌类群在海洋沉积物中分布广泛, 往往是热液流和海水相互作用环境中优势种群[20],但其比例和优势亚群有所差异。如在Rainbow热液区沉积物中Gamaproteobactria是最为优势的类群, 大约一半属于该变形菌门[21]。在劳盆地沉积物检测中发现, 基因型TVG9B-122(9个克隆子)和 TVG9B-97(7个克隆子)与地壳热流中的序列有很高的相似性(97%~98%), 其余基因型与来自西太平洋暖池等其他海洋环境沉积物中序列有 91%~99%相似性。
2.4 古菌16S rRNA基因文库多样性分析
泉古菌(Crenarchaeota)和广古菌(Euryarchaeota)分别占古菌总量的 70.8%和 29.2%, 序列与深海环境相关序列有较高的同源性。泉古菌包含MGⅠ(Marine Group Ⅰ)和 MCG (Miscellaneous Crenarchaeotal Group) 2个类群(图2)。其中以MGⅠ为主, 占古菌文库的 59.4%, MCG占古菌文库的11.4%。结果表明, 在TVG9站位的古菌类群中MGⅠ为优势菌群, 它的同源序列分别来自南冲绳海槽热液流和马里亚纳海槽南部地热流, 相似性依次为98%, 99%。MGⅠ在海洋中分布广泛, 在海水和沉积物中都被检测到过。如在对Juan de fuca热液口沉积物的研究发现[22], 所得到的克隆子全部属于 MGⅠ,认为热液环境中的氨氧化古菌可能来自于这个类群,参与氮的循环。MCG最初在海洋中被发现, 后来在陆地和海洋沉积物中都被检测到[4,23]。该类群同源序列分别来自马里亚纳海槽地热流、武尔卡诺岛地热井和瓜伊玛斯海盆地热喷口沉积物。
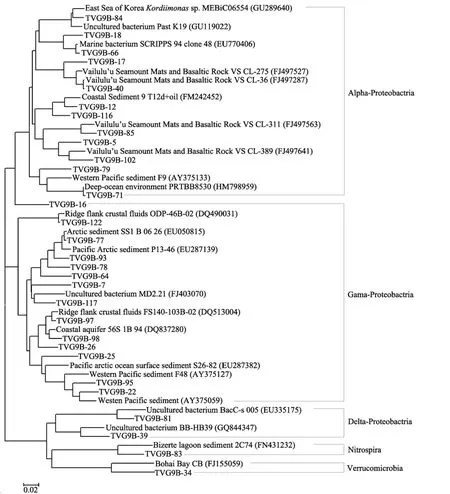
图1 基于16S rRNA基因的TVG9沉积物细菌系统发育树Fig. 1 Bacterial phylogenetic tree based on partial 16S rRNA clones from the sediment sample of TVG9
广古菌以 MBGE(Marine Benthic Group E)(19.6%)为主, 是一种与甲烷代谢有关的古菌类群[24],与劳盆地东扩张区及马里亚纳海槽南部热液区得到的克隆子相似性均为 99%。其他类群占 9.6%, 本研究中得到克隆子在劳盆地和其他热液环境下得到的基因型相似性较高(98%~99%)。
3 结论
本研究结果表明, 所构建细菌和古菌文库中的克隆子大多与热液活动相关, 说明该区域受热液活动的影响显著。探究造成劳盆地和其他热液研究中微生物种群组成差异性的原因, 认为可能是由于劳盆地热液区独特的洋壳化学组成[25-27]与热液喷口活动的协同作用下, 逐渐形成了与其相适应的微生物生态结构。

图2 基于16S rRNA基因的TVG9沉积物古菌系统发育树Fig. 2 Archaeal phylogenetic tree based on partial 16S rRNA clones from the sediment sample of TVG9
[1] Takail K, Nakagawa S, Reysenbach A L, et al. Microbial ecology of mid-ocean ridges and back-arc basins[C]//Christie D M, Fisher C R, Lee S M, et al.Back-Arc Spreading Systems Geological, Biological,Chemical, and Physical Interactions(166). Washington,DC: American Geophysical Union, 2006: 185-213.
[2] Baross J A, Hoffman S E. Submarine hydrothermal vents and associated gradient envirments as sites for the origin and evolution of life [J]. Origins of Life, 1985,15:327-345.
[3] Summit M, Baross J A. A novel microbial habitat in the mid-ocean ridge subseafloor [J]. Proc Natl Acad Sci USA,2001, 98(5): 2158-2163.
[4] Barns S M, Fundyga R E, Jeffries M W, et al. Remarkable archaeal diversity detected in a Yellowstone National Park hot spring environment [J]. Proc Natl Acad Sci USA, 1994,91: 1609-1613.
[5] Parkes R J, Cragg B A, Wellsbury C P. Recent studies on bacterial populations and processes in subseafloor sediments[J]. Hydrogeology Journal, 2000, 8: 11-28.
[6] Rooe-Amsaleg C L, Garnier-Sillam E, Harry M. Extraction and purification of microbial DNA from soil and sedmient samples [J]. Applied Soil Ecology, 2001, 18:47-60.
[7] Morris C E, Bardin M, Berge O, et al. Microbial biodiversity: approaches to experimental design and hypothesis testing in prmiary scientific literature from 1975 to 1999[J]. Microbiology and Molecular Biology Reviews, 2002,66(4): 592-616.
[8] Haddad A, Camacho F, Durand P, et al. Phylogenetic characterization of the epibiotic bacteria associated with the hydrothermal vent polychaete alvinella pompejana [J].Appl Environ Microbiol, 1995, 61: 1679-1687.
[9] Takai K, Horikoshi K. Genetic diversity of archaea in deep-sea hydrothermal vent environments [J]. Genetics,1999, 152: 1285-1297.
[10] Hélène M, David M, Marie-Anne C B, et al. Uncultured archaea in a hydrothermal microbial assemblage: phylogenetic diversity and characterization of a genomefragment from a euryarchaeote [J]. FEMS Microbiol Ecol,2006, 57: 452-469.
[11] Karig D E. Ridges and basins of the Tonga-Kermadec island arc system[J]. Journal of geophysical research, 1970,75(2): 239-254.
[12] Fouquet Y, Stackellberg U V, Charlou J L, et al. Hydrothermal activity and metallogenesis in the Lau back-arc basin [J]. Nature, 1991,349: 778-781.
[13] Antoine E, Cilia V, Meunier J R, et al.Thermosipho melanesiensissp. nov., a new thermophilic anaerobic bacterium belonging to the orderThermotogales, isolated from deep-sea hydrothermal vents in the Southern Pacific Ocean [J]. International Journal of Systematic Bacteriology, 1997, 47(4): 1118-1123.
[14] Durand P, Benyagoub A, Prieur D. Numerical taxonomy of heterotrophic sulfur-oxidizing bacteria isolated from southwestern Pacific hydrothermal vents [J]. Canadian Journal of Microbiology, 1994, 40: 690-697.
[15] 汪品先. 我国的地球系统科学研究向何处去 [J]. 地球科学进展, 2003, 18(6): 837-851.
[16] Newman D K, Banfield J F. Geomicrobiology: how molecular-scale interactions underpin biogeochemical systems [J]. Science, 2002, 296(5570): 1071-1077.
[17] Wang Peng, Wang Fengping, Xu Meixiang, et al. Molecular phylogeny of methylotrophs in a deep-sea sediment from a tropical west Pacific warm pool [J]. FEMS Microbiol Ecol , 2004, 47: 77-84.
[18] Gurtler V, Stanisich V A. New approaches to typing and identification of bacteria using the 16S-23S rDNA spacer region [J]. Microbiology, 1996, 142: 3-16.
[19] DeLong E F. Archaea in coastal marine environments [J].Proc Natl Acad Sci USA, 1992, 89: 5685-5689.
[20] López-García P, Duperron S, Philippot P, et al. Bacterial diversity in hydrothermal sediment and epsilonproteobacterial dominance in experimental microcolonizers at the Mid-Atlantic Ridge[J]. Environmental Microbiology,2003, 5(10): 961-976.
[21] Nercessian O, Fouquet Y, Pierre C, et al. Diversity of bacteria and archaea associated with a garbonate-rich metalliferous sediment sample from the rainbow vent field on the mid-atlantic ridge[J]. Environmental Microbiology,2005, 7(5): 698-714.
[22] 王淑芳. 深海热液口硫化物及沉积物微生物多样性及其与环境相互关系研究[D]. 青岛: 中国海洋大学, 2008.
[23] Zeng Runying, Zhao Jing, Zhang Rui, et al. Bacterial community in sediment from the western Pacific warm pool and its relationship to environment [J].China Environmental Science, 2005, 48: 282-290.
[24] Knittel K, LÖsekann T, Boetius A, et al. Diversity and distribution of methanotrophic archaea at cold seeps [J].Applied and Environmental Microbiol, 2005, 71: 467-479.
[25] Kormas K A, Tivey M K, Damm K V, et al. Bacterial and archaeal phylotypes associated with distinct mineralogical layers of a white smoker spire from a deep-sea hydrothermal vent site (9°N, East Pacific Rise) [J]. Environmental Microbiology, 2006, 8(5): 909-920.
[26] Hsu-Kim H, Mullaugh K M, Tsang J J, et al. Formation of Zn- and Fe-sulfides near hydrothermal vents at the Eastern Lau Spreading Center: implications for sulfide bioavailability to chemoautotrophs [J]. Geochemical Transactions,2008, 9: 6.
[27] Proskurowski G, Lilley M D, Kelley D S, et al. Low temperature volatile production at the Lost City hydrothermal field, evidence from a hydrogen stable isotope geothermometer [J]. Chemical Geology, 2006, 229: 331-343.
Phylogenetic analysis of microbial diversity of the sediment from Lau basin
GUO Wen-ting, LIU Xiao-xi, WANG Peng
(State Key Laboratory of Marine Geology, Tongji University, Shanghai 200092, China)
May,24,2011
Lau Basin; hydrothermal vent; sediment; microbial diversity; polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP)
The bacterial and archaeal diversity of the deep-sea sediment collected at Lau Basin TVG9 sites were analyzed using a polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP) analysis of 16S rRNA gene sequences. The 16S rRNA gene libraries were constructed. The results showed that there were three phyla in the Bacteria domain, including Proteobacteria, Nitrospira, Verrucomicrobia, and the phylum Proteobacteria is predominant, which has three sub-groups including Alphaproteobactria, Gamaproteobactria and Deltaproteobactria. In the Archaea domain, Crenarchaeota dominates over Euryarchaeota. There were two divisions in the Crenarchaeota kingdom, MGⅠ(Marine Group Ⅰ)and MCG(Miscellaneous Crenarchaeotal Group). The MBGE(Marine Benthic Group E) is the dominant group in the Euryarchaeota. This study has uncovered the microbial diversity in the deep-sea hydrothermal region, and provided more evidence for the ecology environmental research.
Q938
A
1000-3096(2012)07-0023-05
2011-05-24;
2012-04-24
国家自然科学基金(91028005)
郭文婷(1977-), 女, 辽宁盘锦人, 讲师, 在读博士研究生,主要从事海洋地质微生物学研究, E-mail: wenting.g@163.com; 王鹏,通信作者, 电话: 021-65982012, E-mail: pengwang@tongji.edu.cn
(本文编辑:刘珊珊)
