一株海水细菌的分离鉴定及其脱硫效果的初步验证
2012-10-21王李宝万夕和张朝晖
王李宝,沈 辉,凌 云,黎 慧,万夕和,钟 非,张朝晖
(江苏省海洋水产研究所,江苏南通 226007)
沉积物是各种海洋污染物的源和汇,随着海洋污染的加剧,沉积物中的有机质、氮、磷、重金属、硫化物等的含量逐渐增加,不但危害底栖生物的生存环境和水产品质量,而且容易造成水体的二次污染,这种情况在海水养殖池塘里表现得尤为突出[1]。因此,去除沉积环境中的污染物,或对受污染的沉积环境进行生物修复,是维持海水养殖健康发展的有效手段。
迄今为止,已报道的自然界中有关氧化硫化物的微生物主要有丝状硫细菌、光合硫细菌和无色硫细菌[2],其中脱硫杆菌属Thiobacillus的8种杆菌能在厌氧条件下,利用硝酸盐为电子受体同步去除硫化物[3]。由于以上脱硫微生物作为自养菌耐有机负荷的能力相对均较弱,且同步脱氮脱硫理论目前绝大部分是应用在工业领域。本研究从异养硝化细菌中分离得到一株脱硫细菌NG6-3,并从形态学、生理生化及分子生物学方面对该菌进行了初步研究,为今后利用该菌株对沉积物环境中硫化物进行生物降解奠定一定的基础。
1 材料和方法
1.1 硫化物氧化细菌的筛选和形态观察
1.1.1 沉积物样品
启东吕四镇某海水养殖池塘,多年虾蟹混养池,离池底液面5~10 cm的暗黑色泥样。
1.1.2 分离和筛选培养基
1.1.2.1 分离培养基
采用普通的2116E培养基。
1.1.2.2 筛选培养基
(NH4)2SO40.5 g,蔗糖 5.00 g ,牛肉膏 1.00 g,Na2S 饱和液 1.5 mL,1 000 mL 陈海水,pH 7.6~7.8。
1.1.3 分离和筛选步骤
1.1.3.1 异养硝化细菌的分离
按彭光浩等[4]方法,采用稀释平板法分离得到菌株,并在平板上用格里斯(Griess)试剂直接点滴判定硝化活性,选取硝化活性较强者在分离培养基平板上划线纯化,作为脱硫细菌筛选的供试菌株。得纯菌113株。
1.1.3.2 脱硫细菌的筛选
将上述纯133株菌株分别接至2116E培养基(不含琼脂)中,37℃培养24 h,再按2%(v/v)的接种量转接至筛选培养基中,37℃培养,适时测定培养基中硫化物含量,以筛选出具有硫化物降解能力的菌株。在113株菌株中筛选得到一株具有较强硫化物降解能力的菌株,编号NG6-3,用于后续研究。
1.2 细菌初步鉴定
1.2.1 形态学观察
将菌株NG6-3在分离培养基上,观察菌落形态,在光学显微镜下观察革兰氏染色情况、鞭毛形态及芽孢形态[5]。
1.2.2 生理生化检查
取纯培养的菌株NG6-3,分别接种于细菌生化特性鉴定用培养基中,按常规进行氧化酶、接触酶、糖(醇及苷)类代谢、H2S、吲哚、MR(V-P)试验、硝酸盐还原、枸橼酸盐利用等,参照《常见细菌系统鉴定手册》[5]进行。并结合API-32E细菌鉴定系统的生化反应结果,对NG6-3的种属进行初步判定[6]。
1.2.3 16S rRNA基因序列测定与系统发育学分析
1.2.3.1 菌株NG6-3基因组DNA的提取
取对数培养期的菌悬液1.5 mL,采用酚-氯仿法提取细菌DNA[7-8]。加100 μL TE溶液溶解。
1.2.3.2 菌株NG6-3部分序列分析
以提取的DNA为模板,采用细菌通用引物(正向27F:5’-GAGAGTTTGATCCTGGCTCAG-3’,反向1495R:5-CTACGGCTACCTTGTTACGA-3’,)进行 16S rRNA 基因扩增。反应条件:96 ℃预变性 5 min;95 ℃变性30 s;52℃退火l min 30 s;72℃延伸l min 30s;30个循环,延伸10 min。PCR产物经检测纯化后,由上海生物工程技术公司进行基因测序。
对供试菌株NG6-3基因序列通过NCBI(NCBI菌株提交号EU081880.1)的Blast检索系统进行序列同源性分析,并用MEGA4.1软件与从Genbank数据库中获得的序列相似性较高的菌株的序列进行多序列匹配排列(Multiple Alignments),采用邻接法(neighbor joining method)获得分支系统树,并通过Bootstrap法(1 000次重复)检验。
1.2.4 菌种分类位置的确定
根据供试菌株形态、培养及理化特性测定的结果,主要依据《Bergey’s Manual of Determinative Bacteriology.9thed》[9]、《Bergey’s Manual of Systematic Bacteriology》[10]及相关资料,进行种属分类位置判定。
1.3 安全性试验
设待测菌株、阳性对照菌和阴性对照实验组,每组设2个平行,每个平行随机选取暂养7 d的健康凡纳滨对虾50尾;每尾注射待测菌株、阳性对照菌和阴性对照50 μL,每天记录其死亡情况。阳性对照为鳗弧菌,阴性对照为不接种处理。每株菌用107cfu/mL、106cfu/mL、105cfu/mL和104cfu/mL 4个浓度进行肌肉注射。
1.4 脱硫效果的初步验证
取50 mL以硫化钠作为惟一硫源的液体培养基于250 mL的锥形瓶中,接种1 mL处于对数生长期的供试菌液,以没有接种菌液的培养基作为空白对照。调节初始pH为7.8,在30℃,静置培养,定期测定菌体生长量及培养基中硫化物质量浓度。硫化物的测定采用碘量法[11]。
2 实验结果
2.1 菌株NG6-3的鉴定结果
2.1.1 供试菌株的分离和形态学观察
从上述泥样分离纯化得到一株具有氨氧化能力和脱硫能力的菌株,命名为NG6-3。菌株NG6-3在2116E培养基上培养48 h后形成直径为1.5 mm、乳白色、边缘整齐的细小菌落,圆形,表面湿润,光滑,呈蜡状(图1)。在1 000倍光学显微镜下观察,菌株NG6-3革兰氏阴性,细胞为椭圆形,无芽孢,细胞大小为 0.5~1.0 μm×1.0~2.0 μm(图 2)。
进一步对菌株NG6-3做磷酸钨负染,透射电镜下观察呈短杆状,无鞭毛(图3)。

图1 NG6-3的菌落形态Fig.1 The colony of strain NG6-3

图2 NG6-3的显微形态Fig.2 The morphology of strain NG6-3
2.1.2 理化实验结果
供试菌株NG6-3在法国梅里埃公司API-32E系统生化反应结果见表,相应的软件进行供试菌株的所属分析表明与弧菌属的相似性较高(98%)。其中鸟氨酸脱羧酶、赖氨酸脱羧酶、L-阿拉伯糖醇、酚红、吲哚产生、葡萄糖、蔗糖、麦芽糖反应呈阳性,主要的生化反应结果见表1。
2.1.3 16S rRNA基因序列和系统发育学分析
利用细菌通用引物,对菌株的16S rDNA序列进行扩增并测序,得到序列长度为957 bp(GenBank登录号为EU081880)。将序列在NCBI数据库中进行BLAST分析,该菌株与弧菌属中部分菌株(CP001805.1)的相似性为99%,其在系统分类中位置如图4所示。有关弧菌属的细菌能够在海水环境中同步去除硫化物和铵态氮的研究在国内外还未见报道。
2.2 菌株NG6-3的安全性试验结果
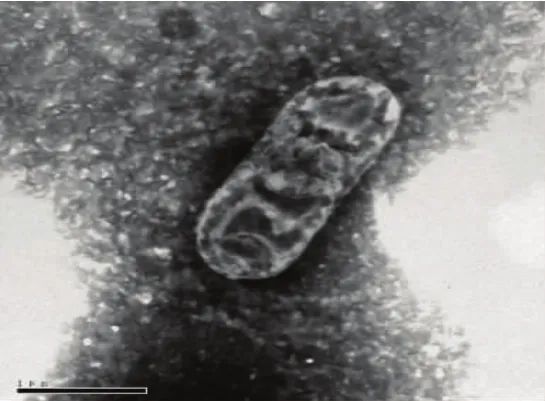
图3 菌株NG6-3的电镜照片Fig.3 Electronic micrograph of the isolated strain NG6-3

图4 根据16S rRNA序列构建的系统发育树Fig.4 Phylogenetic tree based on 16S rRNA sequence

表1 菌株NG6-3的API32E生理生化实验结果Tab.1 Bio-chemical characteristics of strain NG6-3 by API32E test
注射待测菌,生理盐水和阳性对照后,每天记录死亡数,计算其累积死亡率,用SPSS17.0软件对试验数据进行统计分析,结果见表2。

表2 NG6-3安全性试验中各组凡纳滨对虾的累积死亡率(%)Tab.2 The cumulative mortality of Litopenaeus vannamei in safety test(%)
NG6-3 的 107cfu/mL、106cfu/mL、105cfu/mL 和 104cfu/mL注射组与生理盐水注射组在观察的两周时间内均无死亡现象;而阳性对照鳗弧菌的107cfu/mL和106cfu/mL注射组均引起对虾大量死亡,显著高于其他注射组(P<0.05)。由此可知,NG6-3 对凡纳滨对虾无毒害作用。
2.3 菌株NG6-3脱硫效果的初步研究
接种有供试菌NG6-3的培养基中硫化物含量第2天就为对照组的44.3%,第5天开始,在培养基中几乎测不到硫化物的存在,随着硫化物含量的降低菌株生长量逐渐增大(图5)。
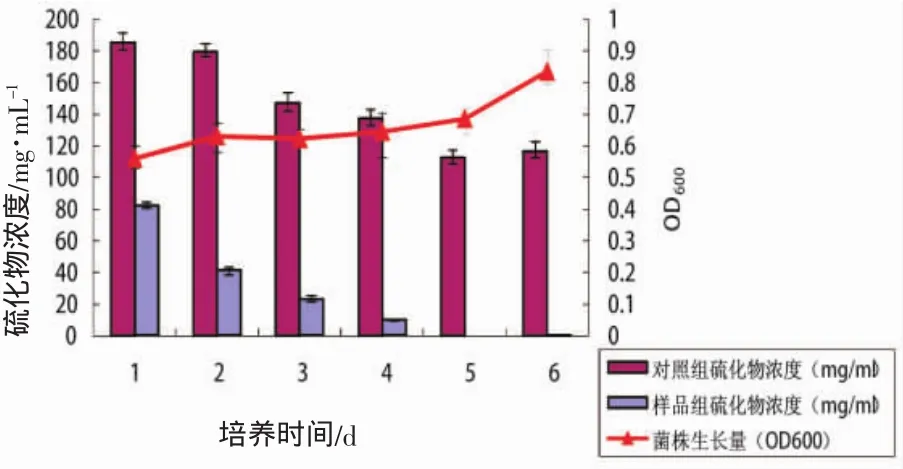
图5 菌株NG6-3的硫化物出去除效果Fig.5 The removal effect of sulfide based on strain NG6-3
3 讨论
目前报道的具有硫化物氧化能力的微生物有蚀阴沟硫杆菌Thiobacillus concretivorus[12]、酒色着色菌Chromatium vinosum[13]、氧化亚铁硫杆菌 Thiobacillus ferrooxidans[13]、氧化硫硫杆菌 Thiobacillus thiooxidans[15]、排硫杆菌 Thiobacillus thioparus[16]、链霉菌 Streptomyces sp.strainSH91[17]和弓形菌 Arcobacter sp.[18]等。弧菌在海水中分布广泛,是海水环境中的常见细菌,部分弧菌在一定条件下可导致海水养殖对象致病[19]。弧菌在海水环境中长期存在,对环境中的各种营养物质产生了依赖作用,可以利用环境中的不同物质作为营养而生存。弧菌属Vibrio的哈氏弧菌Vibrio harveyi、费氏弧菌Vibrio fisher早期曾经均被作为发光细菌用于在水环境污染物的检测,后并被证实多种弧菌均为非致病菌[20]。本研究中分离得到一株既能利用Na2S,又能进行氨氧化作用的细菌,并结合了初步的安全性试验,排除了其潜在的致病性。对扩大海水养殖环境改良菌的筛选范围,提供了一个大胆的思路。
早在上世纪,BISOGNI等[21]利用富集培养的脱氮硫杆菌以硫代硫酸盐和硫化物为电子供体进行了小试的自养反硝化研究,表明脱氮硫杆菌是典型的能够同时利用硫化物和硝酸盐的细菌。同步去除氨氮和硫化物的研究最早集中在制药废水、食品发酵废水、造纸废水等工业废水的处理中,将其方法借用到水产养殖环境修复应用中来,也不失为一种捷径。本研究就是基于此理论基础,先分离出一株具有较强能力的异养型氨氧化细菌,在此基础上在分离出一株能利用Na2S的细菌,以期在同一环境中实现对氨氮和硫化物的同步去除作用。
[1]李晓敏,曲克明,孙 耀,等.海水养殖沉积环境硫化物污染及修复[J].海洋水产研究,2005,26(6):89-93.
[2]KUENENJ G,ROBERTSON I A.The use of natural bacterial populationgs for treatment of sulfur containing wastewater[J].Biodegradation,1992(3):239-254.
[3]王爱杰,杜大仲,任南琪,等.脱氮硫杆菌在废水脱硫、脱氮处理工艺中的应用[J].哈尔滨工业大学学报,2004,36(4):423-429.
[4]彭光浩,尹瑞龄,张桂英.分离鉴定纯化异养硝化微生物的方法:中国,03118598[P].2003-08-06.
[5]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:106-120.
[6]殷永翔.API鉴定系统极其在细菌学检验中的应用[J].现代预防医学,2004,31(5):729-731.
[7]葛芸英,陈 松,胡 兰,等.土壤细菌DNA提取及多样性分析的T-RFLP方法[J].微生物学通报,2008,35(1):131-136.
[8]BAVYKIN S G,LYSOV Y P,ZAKHARIEV V,et al.Use of 16S rRNA,23S rRNA,and gyrB gene sequence analysis to determine phylogenetic relationships of Bacillus cereus group microorganisms[J].J Clin Microbiol,2004,42(8):3 711-3 730.
[9]HOLT J G,KRIEG N R,SNEATH P H A,et al.Bergey′s manual of determinative bacteriology.Ninth edition[M].Baltimore:Williams and Wilkins,1994,192:253;256-257.
[10]KRIEG N R,HOLT J G.Bergey′s manual of systematic bacteriology.Volume 1[M].London:Williams and Wilkins,Baltimore,1984:545-548.
[11]国家海洋环境监测中心.GB 17378.4-2007中华人民共和国国家标准海洋监测规范第4部分:海水分析 [M].北京:中国标准出版社,2008:101-103.
[12]MORIARTY D J W,NICHOLAS D J D.Enzymic sulphide oxidation by Thiobacillus concretivorus[J].Biochem Biophys Acta,l969,l84:1l4-123.
[13]FUKUMORI Y,YAMANAKA T.Flavocytochronle C of Chromatium vinosum[J].J Biochem,1979,85:1 405-1 414.
[14]SUGIO T,MIZUNASHI W,INAGAKI K,et a1.Purification and some properties of sulfur:ferric ion oxidoreductase from Thiobacillus ferrooxidans[J].J Baeterio1,1987,169:4 9l6-4 922.
[15]CHAN C W,SUZUKI I.Quantitative extraction and determination of elemental sulfur and stoichiometric oxidation of sulfide to elemental sulfur by Thiobacillus thiooxidans[J].Can J Microbiol,1993,39:1 166-1 168.
[16]VAN DEN EMDE F P,VEN GEMERDEN H.Sulfide oxidation under oxygen limitation:a Thiobacillus thioparus isolated from a marine mierohial mat[J].FEMS Microbio1 Eco1,1993,13:69-78.
[17]OHTA Y,SUMIDA K,NAKADA Y.Purification and properties of a sulfide-oxidizing enzyme from Streptomyces sp.Strain SH91[J].Can J Microbio1,1997,43:l 097-l 101.
[18]WIRSEN C O,SIEVERT S M,CAVANAUGH C M,et a1.Characterization of an Autotrophic sulfide oxidizing marine Arcobacter sp.That produces filamentous sulfur[J].App1 Environ Microbio1,2002,68:316-325.
[19]吴后波,潘金培.弧菌属及其所致海水养殖动物疾病[J].中国水产科学,2001,8(1):89-93.
[20]周世明,舒为群,赵 清.发光菌在水环境污染物检测中的应用研究进展[J].环境与健康杂志,2007,24(10):837-839.
[21]BISOGNI JR J J,DRISCOLL JR C T.Denitrification using thiosulfate and sulfide[J].Journal of Environmental Engineering,1977,103:593-604.
