药品GMP检查指南规范性研究
2012-10-20北京市药品监督管理局药品认证管理中心100053屈浩鹏俞坚静张凤梅张娟李卫华张如坤宋然然
北京市药品监督管理局药品认证管理中心(100053)屈浩鹏 俞坚静 张凤梅 张娟 李卫华 张如坤 宋然然
北京大学医药管理国际研究中心(100191)江滨 杨松
(接7月上)
(二)我国药品GMP检查规定的回顾
在上一部分中,我们对中国GMP实施的整体情况进行了回顾,在这一部分中,我们重点对GMP检查相关问题进行分析。现有的药品GMP相关规定中,与药品GMP检查相关的内容主要包括四个部分:《药品生产质量管理规范》原则、《药品生产质量管理规范认证管理办法》的规定、药品GMP认证检查评定标准中所规定的检查项目、GMP相关指南。下面分别就这四个部分的发展情况进行介绍。
1 《药品生产质量管理规范》的发展
药品GMP检查认证的实质是为了保障药品生产企业能够达到药品生产质量管理规范的要求,所以药品生产管理质量规范中所包含的原则和条目是对认证检查的最为权威的指导,其他的程序规定、认证指南均是以此为基础形成的。我国的GMP从1982年开始到2010年,总共经历了6个版本(参见图2)。在各个版本的《药品生产质量管理规范》中,尽管对于药品质量管理的理念存在着差异,所设定的标准也不同,但都对其中各个项目需要达到的要求设定了目标。以2010版GMP为例,在结构上,2010年版的GMP共有14章313条,包括总则、质量管理、机构与人员、厂房与设施、设备、物料与产品、确认与验证、文件管理、生产管理、质量控制与质量保证、委托生产与委托检验、产品发运与召回、自检、附则。在这些章节中,有原则性的要求,也有具体的细节条目。这些原则和条目是GMP检查过程中的权威指导。
2 《药品生产质量管理规范认证管理办法》的规定的发展
从1996年中国药品认证委员会发布的《药品GMP认证检查程序》到2011年国家食品药品监督管理局发布的最新版《药品生产质量管理规范认证管理办法》,我国共发布五版认证管理办法(参见图3)。这些认证管理办法对GMP现场检查做出了规定,以指导GMP检查员开展现场检查。以2011版的认证管理办法为例,在办法中设有现场检查一节,其主要内容包括方案制定和检查的时限、检查人员的构成、检查过程的流程和协调、检查记录的要求、检查结果的汇总和缺陷风险的评定以及其他一些流程上的建议。但是整体而言,认证管理办法更多强调的是开展检查流程、人员回避等方面的要求,并未涉及到详细的检查过程。
3 药品GMP认证检查评定标准的发展
从1996年1月中国药品认证委员会发布的《药品GMP认证检查项目》到2007年10月24日出台的《药品GMP认证检查评定标准》,GMP检查项目总共出台3次标准(见附表1)。在这四份文件中,针对各自版本的《药品生产质量管理规范》的理念和内容要求,制定了相应的检查项目。从整体发展趋势来看,检查项目的总数、关键项目的数量均逐年增加,对于评定标准也更加严格。如在1999年的评定标准中规定,如果认证检查发现严重缺陷少于3条,可以限期整改后通过认证,但2007年出台的新标准则规定,如有严重缺陷将不予通过认证。同时,为有效制止药品生产企业在GMP认证中存在的弄虚作假行为,2007年出台的新标准规定:在检查过程中,发现企业隐瞒有关情况或提供虚假材料的,按严重缺陷处理,检查组应调查取证,详细记录。
4 GMP相关指南的历史与现状
前面三个部分的内容都从各自不同的角度对药品GMP检查做出了规定,但是共同的缺陷是不够具体、操作性上存在着不足。GMP指南则是全方位、立体化地将药品GMP检查进行细化、标准化,从而保障药品GMP检查有效完成。我国药品GMP指南(参见图4),最早开始于1985年中国医药工业公司编写的《药品生产管理规范实施指南》(1985年版)。1990年,卫生部曾经组织起草过《GMP实施细则》,但后期被合并到《药品生产质量管理规范》中。2003年随着GMP认证工作的进一步推进,为了保证药品GMP认证工作的公正、公开、公平,规范和指导实施GMP认证工作,国家食品药品监督管理局药品安全监管司和国家食品药品监督管理局药品认证管理中心组织编写了《药品GMP检查指南》。2011年,针对新出版的《药品生产质量管理规范(2010年修订)》,国家食品药品监督管理局药品认证管理中心会同北京大学药物信息与工程研究中心组织编写了《药品GMP指南》,但这份指南偏重于指导企业如何实施GMP,具有行业业务指导的色彩,而不是从检查认证的角度指导GMP检查员的检查认证工作。
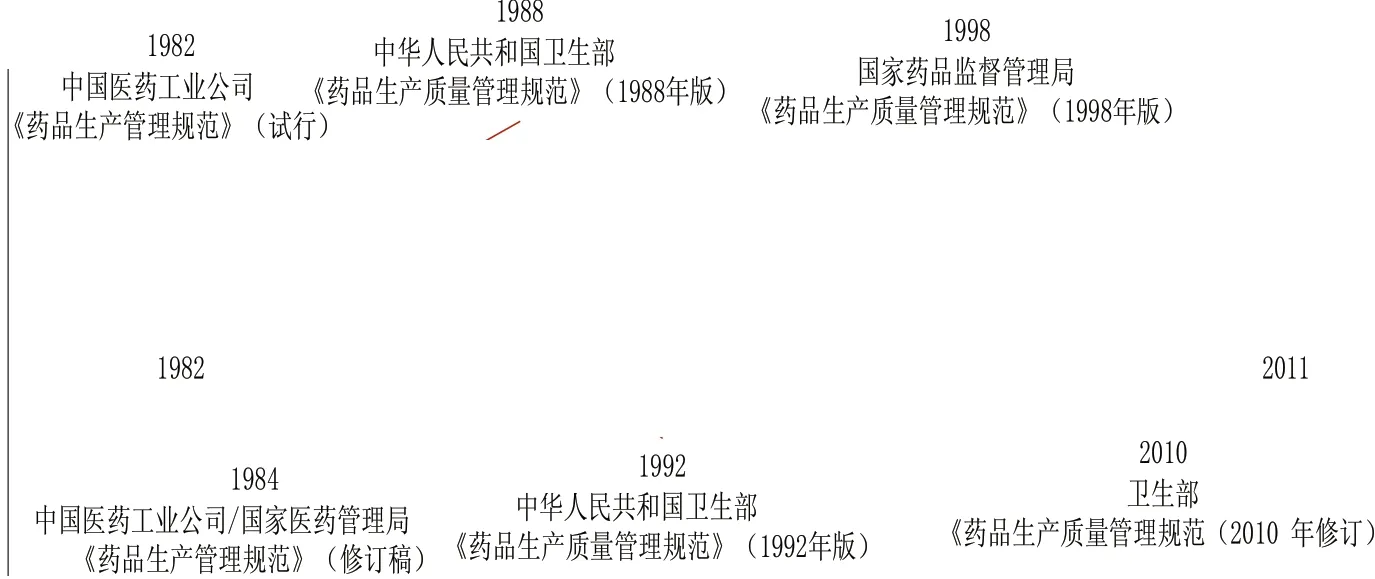
图2 我国药品GMP版本变化
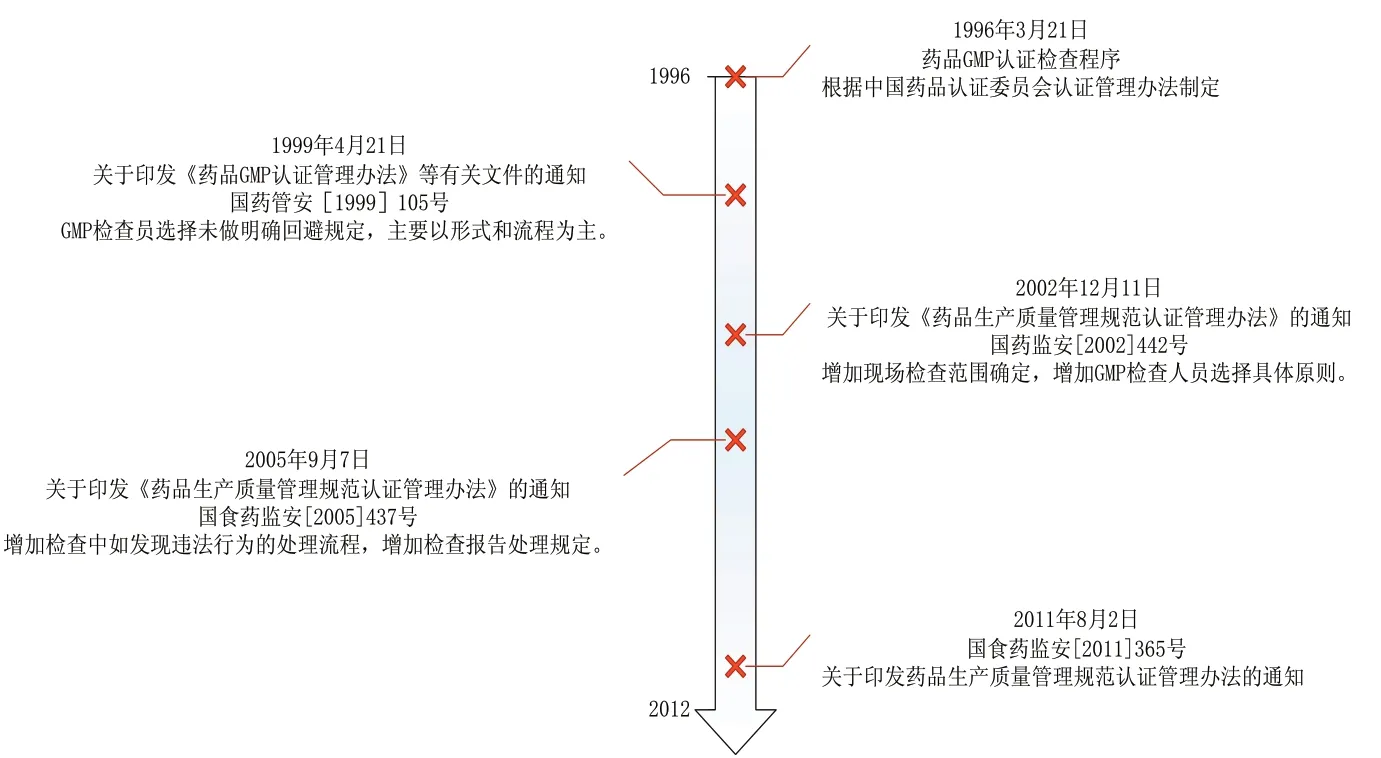
图3 药品GMP认证管理办法变化[6][7][8][9]

图4 GMP指南的变化历程
图4所列举的各类GMP指南,从发布主体看,2001年之前主要是行业编写、发布指南。但2003年后主要由国家食品药品监督管理局药品认证中心牵头编写,即指南的发布主体变成了监管部门。需要注意的是,尽管发布的主体变成了监管部门,但是指南的主要内容或者说框架体系还是从企业的角度出发的,并且这些指南都不属于正式的规范性文件,只具有参考的作用。以2011年发布的《药品GMP指南》为例,其总共包括《质量管理体系》、《质量控制实验室和物料系统》、《厂房、设施、设备》、《口服固体制剂》、《无菌药品》、《原料药》六个分册,内容的构造主要还是从方便企业实施GMP的角度编写的。
所以目前的情况是,我国尚未发布官方性的、针对GMP检查员的检查指南,只有针对企业实施GMP制度的实施指南。
二、我国药品GMP指南的问题
(一)检查指南的未施行动态管理
1998年国家药品监督管理局成立之后,我国一直缺乏系统的药品GMP检查指南,直到2003年,国家食品药品监督管理局药品安全监管司和国家食品药品监督管理局药品认证管理中心组织编写了《药品GMP检查指南》。到2007年,国家食品药品监督管理局又出台了新的认证检查评定标准,但指南的修订并没有及时跟上,出现严重滞后性。2011年,2010版GMP发布,针对新版GMP,认证检查标准发生很大变化,迫切需要一份GMP认证检查指南的用以指导和规范GMP检查员的检查工作。但目前为止,尚未有与新版GMP相配套的检查指南出台。可以认为,我国药品GMP检查指南缺乏时效性。
