宿主蛋白残留检测及数据分析中存在的问题
2012-10-20北京市药品审评中心100053徐春娥田晓娟刘鹤佟利家
北京市药品审评中心(100053)徐春娥 田晓娟 刘鹤 佟利家
宿主残留蛋白(Host Cell Protein,以下简称为HCP),是指在生物制品中残留的宿主蛋白。这类蛋白成分复杂,种类繁多,且会因生产过程及纯化工艺的不同而发生变化。基因工程产品中残留的宿主细胞蛋白是影响制品纯度的重要因素,反复使用含宿主细胞蛋白的基因工程制品,有可能会引起机体的过敏反应,而且其具有潜在的“佐剂效应”,也可能引起机体对药物产生抗体,进而影响药物的疗效。HCP在生物制品中的残留量反映的不仅是制品批间的一致性,而且还是衡量生物制品质量的一个重要指标。
目前,HCP检测使用的方法包括酶联免疫法(ELISA)、聚丙烯酰胺凝胶电泳(SDS-PAGE)、毛细管电泳(CE)、等电聚焦(IEF)和高效液相层析(HPLC)等。Capito F等报告[1],采用傅立叶转换红外光谱学(Fourier transform mid infrared spectroscopy,FT-MIR)可以对重组蛋白纯化过程中的大量(20μg/mL~200μg/mL)宿主残留蛋白进行监控。目前,《中国药典》[2]三部(2010版)中对于大肠杆菌、酵母、假单胞菌表达的蛋白质的HCP检测,采用的是双抗夹心ELISA法,《美国药典》[3]中规定使用SDS-PAGE或免疫测定法。而另有一些生物制品公司,如美国Cygnus technologies(赛纳斯科技)公司研究开发了一系列HCP检测试剂盒,国内采用的一般表达宿主蛋白残留检测多数使用商品化的检测试剂盒;对于尚没有标准品的表达宿主,厂家则需要建立这类表达宿主的内部参考品。
商品化检测试剂盒一般都是经过严格的生产工艺方法学验证的,并进行了严格的产品性能评估,每个试剂盒都有与此产品匹配的最适合的计算方法,试剂盒中对结果的分析方法进行了严格的限制,要求在试剂盒规定的稀释度范围内进行测量,并且采用所要求的方法进行数据分析才能得到准确的数值,如point-to-point(点对点)、cubic spline(三次样条曲线)和四参数对数法等。因此,在使用商品化试剂盒时,应严格按照说明书进行操作。笔者在进行原始记录核查时发现,有些研究单位在进行宿主蛋白残留检测结果分析时,未严格按照试剂盒说明书要求进行数据分析。而申请人一般会将说明书中要求的point-to-point 简单的理解为直线回归分析方法,习惯采用直线回归分析方法和两点间直线分析方法,这样就会导致计算的结果不够准确。此外,也不能准确的反映测定方法中自变量和因变量之间的关系。现以两例核查中发现的未按照规定方法进行分析的实际案例为例进行分析,以提请相关检测人员的注意。
例1:注射用生物制品A表达宿主为293T细胞,制造检定规程要求成品宿主蛋白残留量低于50ng/剂量。申请人使用的是Cygnus生产的293细胞蛋白残留检测试剂盒,要求在规定的稀释度范围内进行测量,并且采用如point-to-point(点对点)、cubic spline(三次样条曲线)或四参数对数法进行分析,而申请人却采用了直线回归分析方法进行测定。宿主蛋白残留检测原始数据见附表1。

附图1 采用Cubic Spline方法进行数据分析的标准曲线

附图2 第一次测量和第三次测量的标准曲线(Cubic Spline法)
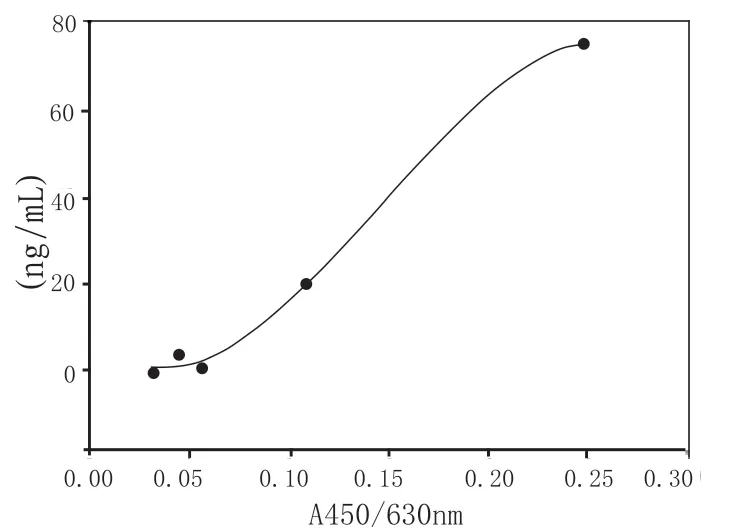
附图3 第二次测量的标准曲线(Cubic Spline法)

附表1 注射用生物制品A中三批成品的宿主蛋白残留检测原始数据
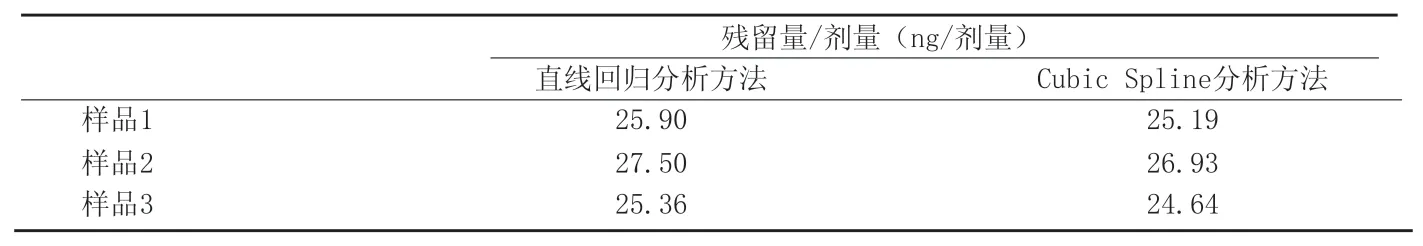
附表2 注射用生物制品A采用不同分析方法检测残留蛋白的结果对比
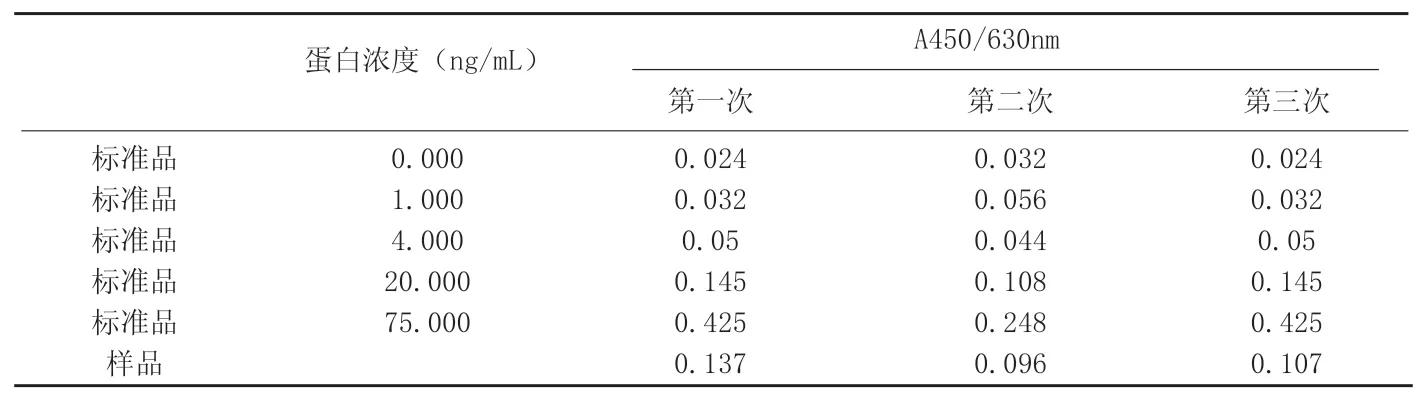
附表3 某注射用生物制品B原液3次宿主蛋白残留检测的原始数据

附表4 某注射用生物制品B原液3次宿主蛋白残留检测采用不同分析方法的结果对比
采用试剂盒中要求的分析方法之一—Cubic Spline进行分析,标准曲线见附图1,曲线方程为:y=-24.093+345.5817x-341.7936x2+407.1602x3。注射用生物制品A采用直线回归分析方法与Cubic Spline分析方法进行分析,两种分析方法结果对比见附表2。
从附表2中的结果可以看出,采用Cubic Spline方法进行分析时,三批成品的293细胞宿主蛋白残留量分别为25.19ng/剂量、26.93ng/剂量和24.64ng/剂量,原分析方法采用线性回归分析法,数据分别为25.91ng/剂量、27.50ng/剂量和25.36ng/剂量,所得结果差异不大,均低于该品50ng/剂量的质量控制标准,符合该品制造检定规程要求。
例2:某注射用生物制品B原液要求检测宿主残留蛋白,表达宿主为巴斯德毕赤酵母,制造检定规程规定宿主残留蛋白应不高于蛋白质总量的0.050%。申请人使用的是Cygnus生产的酵母蛋白残留检测试剂盒(原始数据见附表3)。采用试剂盒中要求的分析方法之一—Cubic Spline进行分析,第一次测量和第三次测量所得的标准曲线相同(见附图2),曲线方程为:y=-3.6553+145.4702x+136.8839x2-1 0 2.8 3 6 4 x3;第二次测量的标准曲线见附图3,曲线方程为:y=7.6 4 5 4-388.3606x+6171.5782x2-14154.8888x3,而申请人却采用了直线回归分析方法进行分析,两种分析方法结果对比详见附表4。
根据计算结果我们可以看出,采用Cubic Spline方法对同一批原液进行三次测量,与直线回归分析方法相比,虽然得出的结果均在其质控标准范围内,即宿主残留蛋白均不高于蛋白质总量的0.050%,第一次和第三次测量两种方法的分析结果差异不大,而第二次测量结果却出现较大偏离。
通过分析标准曲线可知,在数值较高部分和较低部分通常不是线性的,抗原或抗体浓度过高时,对应的ELISA读数不会再显著升高,这时会达到一个平台期,同样在低浓度时也有一个平台期,只有在适当的浓度时才会出现类似直线的曲线。
在上述两个例子中,由于数据落在近似直线的区域,采用直线回归的方法与试剂盒要求的方法分析结果没有明显的差异,而当所测量数值落在标准曲线数值较高部分或较低部分时,如果使用线性回归分析就会导致结果偏高或偏低,出现较大的误差。因此,在实际分析中应该严格按照试剂盒说明书要求对所得数据要进行多参数拟和,这样才能得到准确反映实验结果的曲线,从而回归出准确的结果。(注:本文所引用原始数据已经与申请人沟通,同意使用)
