TACE治疗对兔VX2肾移植瘤细胞增殖影响的实验研究
2012-10-20蹇兆成孙业全
刘 峰 ,柳 港 ,王 帅 ,王 滨 ,蹇兆成 ,孙业全
(1.潍坊医学院,山东 潍坊 261053;2.潍坊医学院附属医院,山东 潍坊 261053)
肾癌是最常见的肾实质恶性肿瘤,约占成人恶性肿瘤的2%~3%,各国或各地区的发病率不同,发达国家发病率高于发展中国家[1]。尽管根治性手术切除为其主要治疗方法,但仍有40%的肾癌确诊时已有远处转移,手术机会率低。目前,随着介入技术的广泛开展,经导管肾动脉化疗栓塞术作为肾癌根治术前及中晚期肾癌治疗的辅助措施,已广泛应用于临床,疗效显著,可减少术中出血及术中可能引起的肿瘤扩散,使肿瘤缩小,缓解症状,延缓病情发展[2],提高手术切除率。本研究对兔VX2肾移植瘤模型进行TACE治疗,栓塞后7 d处死动物取出瘤块,免疫组化染色检测肿瘤细胞增生核抗原(Proliferating cell nuclear antigen,PCNA)的表达。为临床TACE治疗肾癌的疗效评价提供了分子水平的切实有效的理论依据。
1 材料与方法
1.1 实验动物
新西兰大白兔22只,雄性,体质量2.5~3.0 kg,由山东省农业技术科学院动物实验中心提供(许可证号:sxk-鲁-2009-0013)。
1.2 VX2瘤细胞株
瘤细胞传代兔由协和医科大学基础医学院提供(许可证号:scxk-京-2009-0014)。
1.3 实验药品及器材
3%戊巴比妥钠,阿霉素,70%复方泛影葡胺,碘化油;1.5T磁共振,介入导管机。
1.4 动物模型建立
采用开腹直视下瘤块埋植法建立兔肾肿瘤动物模型。建模2周后经超声检查,将适合介入治疗的动物随机分为实验组和对照组。
1.5 介入操作
将实验动物随机分为两组,对照组10只,实验组12只。DSA监视下,经股动脉穿刺插管至肾动脉,造影明确导管在靶血管后,实验组:2 mg/kg阿霉素、0.2 mL/kg超液态碘油充分混匀后经微导管缓慢注入,栓塞肿瘤;对照组:经导管注入10 mL生理盐水(图1)。
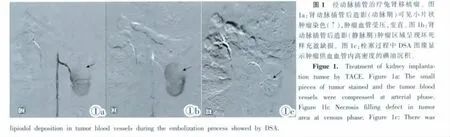
1.6 取材及免疫组织化学染色
肿瘤治疗后7 d耳缘静脉空气栓塞处死动物,留取肿瘤标本(周边包含少许正常的肝组织),沿轴位最大径将瘤块一分为二用10%福尔马林固定,包埋蜡块时即以此最大径为切面,若瘤块过大则在此最大径切面上分别取瘤块中心和周边的组织(或中心坏死灶周围和瘤块周边的组织)进行包埋,5 μm连续切片,进行免疫组化染色(PCNA,北京中杉,PV9002法,抗体浓度1∶80)。阳性标准为阳性细胞染色为黄色或棕黄色,定位于细胞核内;在高倍镜下(×400)随机抽取肿瘤非坏死区域计数5个高倍视野各200个细胞,分别记数阳性细胞,按公式:PCNA阳性细胞增殖指数(Proliferation index,PI)=PCNA阳性细胞数/肿瘤细胞数,计算PI[3]。
1.7 统计学处理
数据采用统计学软件SPSS 11.5进行统计学处理,P<0.05时差异具有统计学意义。
2 结果
2.1 PCNA的表达情况
PCNA阳性染色表现为细胞核有棕黄色颗粒。对照组PCNA染色阳性细胞弥漫分布或片状分布,且周边比肿瘤中心表达略强,癌旁组织散在表达,但表达较弱(图2);TACE组肿瘤中心部分坏死,部分标本肿瘤坏死部分内散在的表达,但肿瘤周边部分细胞增殖核抗原表达增强,细胞核增大深染(图3)。

2.2 PCNA的量化数据及统计分析
将通过计数得出的PI值较后得出:对照组(61.2±11.21)%与 TACE 组(71.6±11.01)%之间具有显著差异性(P=0.041)(表1),即对照组中 PCNA 的表达强度低于TACE组。
3 讨论
PCNA亦称周期素,是聚积在S期细胞核内复制的细胞周期依赖性蛋白,是DNA多聚酶δ的辅助蛋白,与细胞周期紧密相关,PCNA在G1期开始增加,S期达到高峰,G2期下降,M期降至最低,且与患者预后有关[4]。作为一个内源性增殖细胞的标记物,PCNA与癌组织的增殖活性、转移及预后关系密切。
表1 PI在各组中的分布情况()

表1 PI在各组中的分布情况()
注:1:与对照组比较,P<0.05。
组别 例数 PI(%) t值 P值对照组 10 61.2±11.21 TACE 组 12 71.6±11.011 2.184 0.0411
3.1 肿瘤细胞增殖活性的检测
PCNA对DNA复制的调节起重要作用,PCNA的合成与表达与细胞增殖密切相关,是反映细胞增殖的主要生物学指标,并调控细胞周期。免疫组化染色的显色系统是将二抗和酶通过一个多聚糖骨架联接成一个多聚体,直接放大信号一倍,是目前公认的一种有效、敏感地进行细胞增殖的定量检测方法。
免疫组化研究表明,PCNA在细胞核中有两种形式:一种是可溶性,可溶于乙醇等有机溶剂而被洗脱,经过处理的组织和细胞中可以消失,在细胞周期中,它的量不发生变化;另一种是不溶性,不溶于有机溶剂,是复制所必需的,它的出现明显与细胞增殖有关。因为参与细胞周期循环、复制和修复,所以凡进入增殖周期的细胞在凋亡检测中均为阳性反应。故可有效地根据阳性细胞的多少反映肿瘤细胞的PI[5-6],进而反映细胞增殖状况。细胞PI越高,反映细胞的周期越短,并且其在各种肿瘤中均能稳定地表达,在大部分正常组织中不表达或仅有十分微弱的表达。理论上,肿瘤的分化程度与肿瘤的预后是密切相关的,而这种周期性变化恰好与细胞增殖过程相似[7-8]。因此,细胞PI被认为是反映细胞分裂程度、衡量细胞增殖进程的相同步的客观评估指标,不仅能反映肿瘤细胞的增殖活性,同时也与肿瘤细胞的分化程度及患者预后有关。在肿瘤理论的研究中,一般认为肿瘤分化越低,增殖力越强,恶性程度越高,其过度表达越强[9]。本研究参考文献应用免疫组化染色(PV9002法)检测PCNA的表达取得了理想的实验结果。
3.2 TACE治疗后兔VX2肝移植瘤组织中PCNA的表达
在我们的实验免疫组化结果显示2组共22只实验动物中PCNA均有表达,阳性率为100%,TACE组(71.6±11.01)%PI明显高于对照组(61.2±11.21)%(表1),与Huang等[10]报道肝癌经 TACE治疗后残留癌的PCNA标记指数增高的观点一致。经TACE治疗后残留癌的PCNA标记指数增高,其原因可能与以下几方面有关:①肾移植瘤经TACE治疗后可发生程度不等的肿瘤坏死,在肿瘤边缘或多或少地存在残留癌,残留癌中新生肿瘤细胞所占比例增大;这个部位的肿瘤生长最活跃,使G0期的细胞进入细胞分裂周期中,处于S期的癌细胞增加,即相应地PCNA表达量也增加[4]。②栓塞后新生血管的形成,侧支循坏的建立,这主要是由于TACE治疗后肿瘤缺氧、坏死,缺氧与坏死组织又可刺激血管内皮生长因子(VEGF)等的分泌[11],VEGF与其特异性受体结合后,受体首先自磷酸化,继而激活磷脂酞胆碱特异性磷脂酶 C(PLCy)、水解磷脂酞肌醇二磷酸(PIP2),产生二脂酞甘油(DAG)和肌醇三磷酸(IP3),其中DAG可激活胞浆中蛋白激酶C(PKC)并固定于膜上,然后诱导内皮细胞生长,参与细胞外蛋白水解和基底膜的降解,利于血管内皮细胞的迁移和增生,促进了血管形成。③VEGF又叫血管渗透因子,它不但可以促进肿瘤新生血管的形成还可增加血管的通透性。VEGF通过一种小泡囊状细胞器(VVO)引起内皮细胞窗开放并维持这种状态,从而导致微血管特别是毛细血管后静脉和小静脉的渗透性增加。其增加微血管通透性的能力是组织胺的5万倍,VVO由许多小囊和空泡相互连接成葡萄样结构,从管腔膜一直延伸到基底膜,并与窗隔相连,当窗开放时,生物大分子即可通过基底膜漏出,引起肿瘤血管中的血浆蛋白、纤维蛋白和其他循环大分子的外渗,形成富含纤维的细胞外基质,这种临时基质支持成纤维细胞和内皮细胞的内生,成纤维细胞和内皮细胞又可将临时基质转化为成熟的肿瘤基质,从而为肿瘤细胞生长创造了物质条件。Mei等[12]也报道VEGF的表达与肿瘤瘤细胞的增殖和凋亡有关。
兔VX2肾移植瘤成功率比较高,选择合适的治疗时机和治疗方案进行介入治疗,能够取得理想的疗效,是一个研究肾癌介入治疗的理想的动物模型,实验组术后肿瘤大部分发生坏死。本实验采用免疫组化法检测肿瘤PCNA的表达,发现TACE术后残余的肾癌组织细胞PI升高。
[1]吴阶平.吴阶平泌尿外科学 [M].济南:山东科学技术出版社,2009:889-917.
[2]朱朝辉,张学能,曾甫清,等.肾动脉栓塞术在肾癌治疗中的应用(附 67 例报告)[J]. 临床泌尿外科杂志,2002,17(10):521-522.
[3]吴文娟,邹英华,南月敏,等.As2O3碘油栓塞对兔VX2肝癌凋亡、增殖及肝功能的影响[J]. 实用放射学杂志,2006,22(1):1-4.
[4]孙海燕.增殖细胞核抗原的特性及其应用 [J].实用癌症杂志,2002,17(1):105-106.
[5]Xiao EH,Li JQ,Huang JF.Effect of p53 on apoptosis and apoptosis and proliferation of hepatocellular carcinoma cells treated with transcatheter arterial chemoembolization[J].World Gastroenterol,2004,10(2):190-194.
[6]Osada S,Saji S,Kuno T.Clinical significance of combination study of apoptotic factors and proliferating cell nuclear antigen in estimating the prognosis of hepatocellular carcinoma[J].Surg Oncol,2004,85(1):48-54.
[7]Saftoiu A,Ciurea T,Georgescu C,et al.Immunohistochemical assessment of proliferating cell nuclear antigen in primary hepatocellular carcinoma and dysplastic nodules[J].Cell Mol Med,2003,7(4):436-446.
[8]Nan KJ,Guo H,Ruan ZP,et al.Expression of p57(kip2)and its relationship with clinicopathology,PCNA and p53 in primary hepatocellular carcinoma[J].World J Gastroenterol,2005,11(8):1237-1240.
[9]Yu H,Zhou HZ,Wang CM,et al.Effect of hepatoma H22 on lymphatic endothelium in vitro[J].World J Gastroenterol,2004,10(23):3428-3432.
[10]Huang J,He X,Lin X,et al.Effect of preoperative transcatheter arterial chemoembolization on tumor cell activity in hepatocellular carcinomas[J].Chin Med J(Engl),2000,113(5):446-448.
[11]王滨,徐辉,曹贵文,等.肝动脉化疗栓塞对肝癌肿瘤新生血管生成及血管内皮生长因子表达的影响 [J].中华放射学杂志,2005,39(2):204-206.
[12]Mei J,Gao Y,Zhang L,et al.VEGF-siRNA silencing induces apoptosis, inhibits proliferation and suppresses vaseulogenic mimicry in osteosareoma in vitro[J].Exp Oncol,2008,30(1):29-34.
