药品GMP检查指南规范性研究
2012-10-19北京市药品监督管理局药品认证管理中心
北京市药品监督管理局药品认证管理中心
北京大学医药管理国际研究中心
屈浩鹏 俞坚静 张凤梅 张娟 李卫华
张如坤 宋然然 江滨 杨松
(接7月下)
导致GMP指南时效性不足的主要原因是我国GMP相关指南还没有实现动态管理,没有从长效机制的角度来保障指南的时效性。这种情况的存在导致GMP检查指南无法完全适应企业生产条件的变化,也无法与国家整体的政策变化保持一致,即不能够根据外界环境和内部环境的变化而实现动态调整,从而出现指南和实际情况严重脱节的现象。近十年来,我国的药品生产企业的数量、产业规模和药品生产的类型均发生了巨大的变化,药品GMP检查指南必须要适应这种变化、做出有效的调整,而这种有效的调整的核心就是实现对检查指南的动态管理,从这一点来看,目前,国内还属于空白。
(二)已有GMP检查指南缺乏可操作性
从已有的GMP检查指南来看,在可操作性上存在欠缺。以2003版的检查指南为例,指南中针对部分检查条款的解读过于概括,缺乏现实的指导意义,检查员在实际的检查过程中无法把握检查核心,导致指南的参考指导意义不足。而对于有的条款的解读又太过于僵化、教条化,比如指南对于某个检查条款制定了非常详细的标准,从而导致GMP检查员只能简单地按照条目进行一一核对,表面上是使得指南具有了可操作性,但实际上是忽视了GMP检查中检查员的独立评估的重要性,所以从这个角度来说,我国的GMP检查指南存在着可操作性上的缺陷。
(三)其他GMP指南缺乏检查指导意义
除了2003版的GMP检查指南,我国还存在其他版本的GMP指南,如针对2010年版GMP,国家食品药品监督管理局药品认证管理中心会同北京大学药物信息与工程研究中心组织编写的《药品GMP指南》。该GMP指南结合2010版GMP,参考了许多国外的药品监管部门、国际组织、行业协会、药品生产企业的指导原则,内容非常全面,但其主要针对群体还是药品生产企业。这类指南从本质上来讲是属于“实施指南”,用于指导企业如何合理的构建自己的GMP体系,而不是“检查指南”。对于药品监管部门的GMP检查员,他们并不参与企业的具体GMP体系建设,而是对企业是否符合GMP要求进行检查评估,所以这类指南对GMP检查员来说缺乏检查指导意义。而对于药品生产企业来说,这类指南也只具有参考意义,因为不结合具体的GMP检查指南,企业对于GMP检查的认证缺乏系统科学的认识。而现实的情况来看,企业需要重新认证,时间很紧迫,特别是血液制品、疫苗等高风险产品,需要专业指导;而从调研的情况来看,企业不能消化、理解新GMP,需要GMP检查员引导和指导,以提高认识,这个过程中GMP检查员和药品生产企业都需要GMP检查指南的帮助。
三、国外药品GMP检查指南的概况
对于本部分主要考察美国、欧盟和WHO的GMP检查指南的情况。这些国家或组织的GMP指南体系比较完善,尤其是美国的GMP制度被很多专家学者认为是GMP发展的趋势,所以对其GMP检查指南进行分析,对我们建立GMP检查指南有重要的指导意义。
(一)美国药品GMP指南
作为药品GMP的鼻祖,美国1963年就诞生了世界上第一部药品GMP,随后其思想被WHO采纳推广。到现在,美国的GMP制度已经实施快50年,其GMP体系已相当成熟。
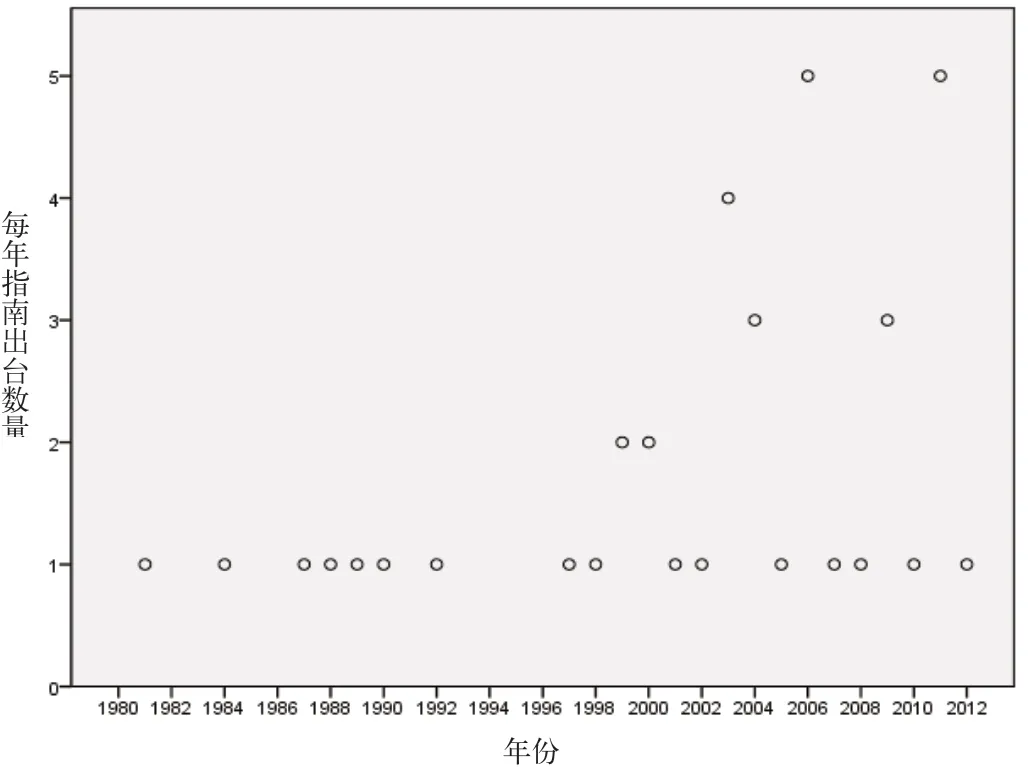
图5 FDA CGMP相关指南出台数量
美国的GMP全称是动态GMP,即CGMP(Current Good Manufacturing Practice),美国的GMP特意在前面加了一个“C”,即“Current”,意指FDA的标准在不断地提高[12]。美国GMP的法律渊源归属于《美国联邦法典》(CFR)第21项下(简称为21CFR)的210和211部分,是药品生产所要遵循的最低现行标准(The Minimum Current)。美国的GMP属联邦法规,其修订需经过较复杂的法律程序。为了更好地体现法规的要求,使其条款相对稳定而不必随着工艺技术的进步而频繁修改,GMP的主条款中不列入过细的操作要求和技术性内容,也不列入GMP法规配套文件和具体执行标准[13]。我们看到,美国的GMP修订却非常及时,这取决于其良好的调整修订体系。美国的GMP的修订包括三个方面,首先是GMP原则条款的修订,其次是不断补充GMP中有关分类产品的附录,最多的是不断对有关GMP实施的指南性文件进行修改和增补,使得整个的GMP体系变得丰富和充满活力。截止到2012年4月9日,有关GMP的指南数目有40项之多(包括草稿)(参见图5)。我们从图5可以看到美国CGMP从1981年开始出台到2012年中,有30年都出台了指南,其中2008年和2012年更是出台了5份CGMP相关指南[14]。指南的不断更新和推出是保证美国FDA的CGMP能够在世界GMP领域保持领先的关键。并且这种大量指南的推出,能够帮助被监管人和公众以及其他部门理解FDA的政策和观念,在被人了解认识的过程中,FDA就能够更为有效地提高自己的项目推动能力[15]。
(二)欧盟的GMP指南
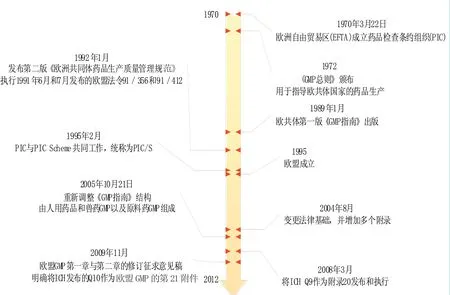
图6 欧盟GMP发展历程[ 16-17 ]
欧盟与美国不同,集中与分权是欧盟实施药品GMP的基本特征。所谓“集中”是指令、方针。包括注册要求及药品GMP由欧洲委员会确定;“分权”,即现场检查工作由各国的药品管理部门负责实施。欧盟的药事法规分三个层次文件。第一层次文件是由欧盟委员会发布的指令(Directive)和法规(Regulation)。成员国必须以它为标准,转化为本国的法规后执行。2003/94/EC《人用药品和临床试验用药GMP的指导方针和原则》就是欧盟委员会发布的GMP法规文件。第二层次文件是由欧盟委员会根据GMP指导方针和原则(94/EC)发布的GMP指南,以指导成员国对GMP指导方针和原则的理解和执行。第三层次文件是由欧洲药品管理局发布的技术性指南,对有些法规文件的条款作技术性解释。
欧盟作为一个独立的主体存在的时间不到20年,但是其GMP问题上的合作却是从1970年10月,欧洲自由贸易区(EFTA)在“关于药品生产的现场检查的互认协定”主题下成立了药品检查条约组织(PIC)开始的(参见图6)。需要特别说明的是这里所说的指南,和我们在前文提到的指南不同,因为在欧洲GMP的基本原则是属于法律性质的,其GMP指南实际指的是中国说的GMP本身,而其附录等同于中国所说的指南。
目前的欧盟根据94/EC指令制订了欧盟GMP主体文件以及19个GMP附件,均属强制执行。19个附件中有11个附件是不同类型药品的规范文件和8个通用性的规范性操作,分别是无菌药品制造、人用生物药品制造、放射性药品制造、除免疫外兽药制造、兽用免疫药制造、医用气体制造、草本植物药品制造、起始物料与包装材料取样、液体乳膏及软膏制造、压力定量与气雾吸收剂制造、计算机化系统、电离辐照在药品制造中的应用、研究用药品制造、源于人血或血浆药品制造、确认与验证、质量授权人认证与放行、参数放行、对照样品与留样、质量风险管理。
从欧盟的GMP指南和附录我们可以看到,基本思路和美国很相似,即在大框架下进行适当的调整,同时,欧盟的实际情况和中国非常相似,都是采取集中分权的方式。除此之外,在具体的指南上,中国的GMP和欧盟的也非常相似,所以欧盟的GMP体系具有很高的借鉴意义。
(三)WHO的GMP
WHO于1969年第22届世界卫生大会(WHA)上提议将《世界卫生组织国际贸易药品质量认证办法》列入大会决议,并建议各成员国实施药品GMP。1975年,药品GMP经修订后录入大会决议。WHO的GMP及其他相关文件对各国只是建议和帮助,只有当某国政府通过法律程序采纳后,才能成为所在国的规范并获得法定的地位。WHO的GMP是药品GMP标准国际化的体现。许多发展中国家注意到了这一国际化趋势,也注意到国际化带来的直接结果是文件和体系的相似性、通用性,因此,常常直接接受和采用WHO的GMP而无需再花费时间和精力另行制订本国的药品GMP。
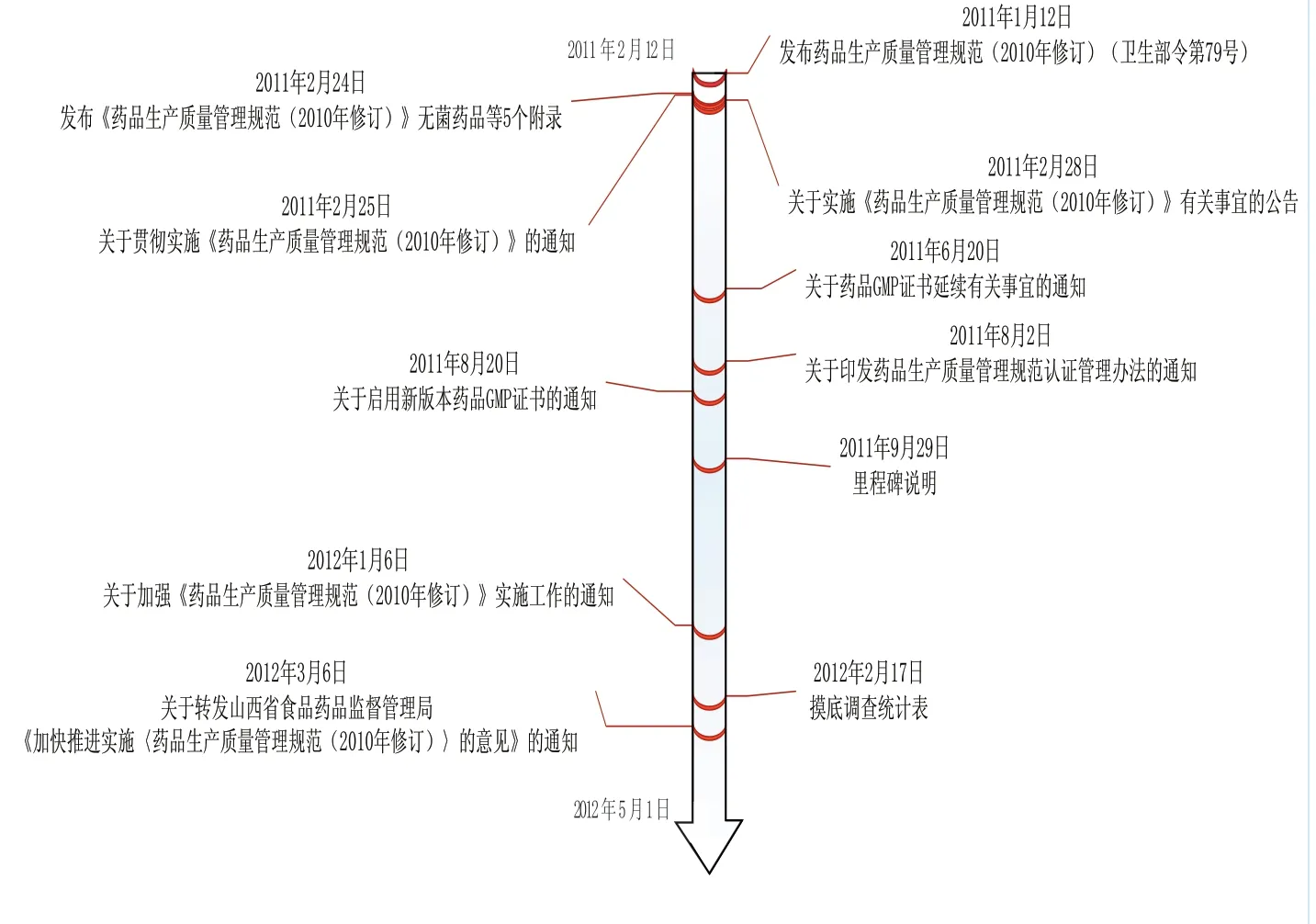
图7 国家局新版GMP实施工作部署
WHO的GMP的现行文本为2003年修订,由基本要求、特殊药品的GMP、GMP检查和补充指南等四大部分组成。WHO以欧美药品市场许可证批准前检查的指南为蓝本,制订了批准前检查指南(Guidelines on Pre-approval Inspections)推荐给成员国,供确立本国的药品注册、监管系统采用。为了适应第三世界国家的企业和检查员的需要,WHO出版了许多系统性的基础培训材料[18]。
第三部 建立药品GMP检查指南的需求分析
本部分主要对建立GMP检查指南的现实需求进行分析。主要从国家整体工作部署、各省市推进GMP的规划两个宏观层面,以及GMP检查指南适用的两个核心主体——药品生产企业和GMP检查员对GMP检查指南的需求等两个微观层面进行分析。
一、国家局的工作部署
2011年1月17日发布2010版GMP后,国家局就推动GMP检查认证工作,开展大量的部署(参见图7)。
从国家局的整体工作部署来看,药品GMP实施工作非常紧急,作为地方药品监管部门,需要进一步制定有效实施方案,加强实施工作。在“关于加强《药品生产质量管理规范(2010年修订)》实施工作的通知”中,国家局要求各地按照《药品生产质量管理规范检查员聘任及考评暂行规定》遴选、培训、聘任和管理检查员,使检查员能够掌握检查标准、把握风险管理要求、统一风险评估尺度,保证药品GMP认证科学公正、始终如一、各地实施水平一致。现场检查是认证检查工作中最为重要的环节,要做到统一风险尺度,检查指南的建立是一个重要方法。从国家局整体工作部署的情况来看,建立药品GMP指南,符合加快推行GMP认证工作的要求。
二、各省的GMP推进方案中的规划要求
针对2010版GMP,许多省市都出台了新版GMP的实施规划方案,但是目前为止还没有省局专门针对GMP检查工作出台相应的指南。有的省就GMP现场检查制定了实施方案,比如山西,根据新修订GMP的要求,结合实际,为细化认证操作规程,制定了《山西省实施新修订GMP认证操作规范》,主要内容包括技术审查、方案审核、现场检查、风险评估、监督监察等12个方面19个规程,力求做到标准化操作、全过程制约、规范化运行[19]。其他省则主要是做了原则性强调,比如上海,在其《关于进一步加强新修订〈药品生产质量管理规范〉实施工作的意见》中规定:“对省级认证检查的企业,药品GMP认证检查部门应当按照国家的检查标准,依照工作程序,统一尺度,严格审查,公正公平,避免前紧后松,保持认证工作质量始终如一。”综合来看,由于各省对具体的检查过程并没有提供工具性的检查指南,要实现统一尺度目标存在很大困难。
此外,在各省出台的GMP实施规划方案中,对于如何提高检查员的水平,提高检查效率等问题也做出了原则性要求。如湖南省的文件指出:“加强检查员队伍建设,强化检查员动态管理;建立药品GMP认证质量体系考评机制,开展认证检查能力评估,提高认证能力。”[20]但是,对于检查员检查认证能力的提高,除了要加强培训以外,提供具体的、可操作的认证检查指南更根本、更可行。所以,从各省的实施GMP规划方案来看,对于GMP检查指南的需求是非常强烈的。
三、企业对于GMP检查指南的期许
从企业的角度,能否通过新版GMP的认证检查是企业生死存亡的关键。尽管2010版GMP是 对1998版GMP的继承和发展,但是对于企业的要求却更为严格。企业需要重新认证,时间很紧迫,特别是血液制品、疫苗等高风险产品,在GMP体系建设方面,需要专业指导。但从目前的情况来看,情况不容乐观,课题组在调研过程中发现,一些制药企业虽已开始贯彻新版GMP的要求,但对其中的先进理念和相关知识如风险管理、变更控制、超标检验数据调查处理、纠正与预防措施等缺乏充分的理解,无法有效运用到实际工作中。所以企业急需一本具有指导意义的GMP检查指南用以指导GMP体系的建设。
