乙醇洗豆粕的干热处理对大豆分离蛋白凝胶性能的影响
2012-10-18黄友如陈义勇朱东兴王叹玉
黄友如,陈义勇,朱东兴,赵 阳,王叹玉
(常熟理工学院生物与食品工程学院,江苏 常熟 215500)
乙醇洗豆粕的干热处理对大豆分离蛋白凝胶性能的影响
黄友如,陈义勇,朱东兴,赵 阳,王叹玉
(常熟理工学院生物与食品工程学院,江苏 常熟 215500)
以不同温度处理过的乙醇洗豆粕为原料,制备大豆分离蛋白,并对不同温度干热处理的大豆分离蛋白的凝胶性能及其相关性能进行研究和表征。结果表明:大豆分离蛋白的凝胶强度随着干热处理温度的升高而增强,而凝胶弹性则成微弱的减弱趋势;荧光和紫外吸收光谱分析表明,乙醇洗豆粕经不同温度处理后制备的大豆分离蛋白,其生色基团所处微环境发生了变化,可溶性蛋白的表面疏水性增加,分子聚集程度增强;溶解度与浊度分析说明,适当的干热处理有利于增强大豆蛋白的溶解性能,但蛋白质分子聚集程度的增强导致其凝胶弹性减弱。
大豆分离蛋白;凝胶性能;干热处理
大豆分离蛋白是以低变性脱脂大豆粉或浓缩大豆蛋白为原料,经碱、酸等一系列处理后得到组分较均一、功能较强的蛋白质,主要成分是β-伴球蛋白(7S)和11S球蛋白。蛋白质改性是通过物理、化学、酶法或基因工程等方法对蛋白质结构进行修饰,从而改善产品的相容性和功能性质。在大豆分离蛋白制备和/或加工过程中,应用不同的处理方法,会引起蛋白质的结构与功能性质发生变化。适当的改性可产生合适的功能性质,拓宽大豆分离蛋白在食品工业中作为添加剂应用的范围[1-6]。
有关大豆分离蛋白凝胶性能方面的工作已有很多的文献报道[3,7-10]。实验在大豆分离蛋白制备及应用的过程中发现,脱脂豆粕中残留的不饱和脂质及加工工艺条件可直接影响大豆分离蛋白分子结构,进而影响产品的营养价值和功能性质[11-14]。为此,在前期研究的基础上,本实验以低温脱脂豆粕为原料,采用乙醇浸出的方法进一步去除豆粕中残留的脂质,得到低脂质含量的大豆粕,进一步对浸出豆粕进行干热处理,以干热处理的豆粕为原料,制备大豆分离蛋白,探讨干热处理乙醇洗豆粕对大豆分离蛋白凝胶性能的影响。
1 材料与方法
1.1 材料与试剂
低温脱脂豆粕由东海粮油工业(张家港)有限公司提供,其蛋白质含量为53.60%,水分含量为9.86%,脂质含量为3.51%。
乙醇、盐酸、氢氧化钠、磷酸氢二钠、磷酸二氢钠均为分析纯 中国医药(集团)上海化学试剂公司。
1.2 仪器与设备
UV2100型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;RF-5301PC型荧光分光光度计 日本Shimadzu公司;TA-XT2i型物性测试仪 英国Stable Micro Systems公司。
1.3 方法
1.3.1 低温脱脂豆粕的进一步处理
低温脱脂豆粕→粉碎→过60目标准筛(通过率100%)→65%乙醇浸出(浸提温度为30℃,浸提时间为60min,固液比1∶6,低速搅拌)→固液分离→滤饼→自然干燥→粉碎→过60目标准筛(通过率100%)→浸出豆粕
1.3.2 浸出豆粕的干热处理
将浸出豆粕置于烘箱中,分别在50、70、90℃条件下处理3h取出,室温冷却,处理厚度2mm。
1.3.3 大豆分离蛋白的制备
分别以未经热处理的浸出豆粕和经50、70、90℃干热处理的浸出豆粕为原料,制备大豆分离蛋白,样品分别标记为SPI0、SPI1、SPI2、SPI3,工艺条件如下:将豆粕按料液比1∶15混合,用2mol/L NaOH调pH值至7.0。搅拌1h后,将其悬浮液在3000×g离心30min,取上清液用2mol/L HCl调pH值至4.5。静置后在3000×g离心30min,水洗沉淀后,取蛋白沉淀分散于水中并用2mol/L NaOH调pH值至7.0。再在3000×g离心30min,除去少量的不溶物,将其蛋白溶液冷冻干燥后粉碎即得粉末状大豆分离蛋白。上述步骤均在室温下进行。
1.3.4 大豆分离蛋白的溶解度测定
取大豆分离蛋白10mg,溶于5mL 0.2mol/L pH7.0的磷酸缓冲液中,4000r/min离心30min,取上清液采用凯式定氮法测定其溶解度。
1.3.5 大豆分离蛋白的浊度测定
将大豆分离蛋白溶于去离子水中配制成所需的质量浓度,在室温下磁力搅拌60min,2000r/min离心15min弃沉淀。使用紫外-可见分光光度计在600nm波长处测定其吸光度。
1.3.6 大豆分离蛋白的凝胶性能测定[2]
凝胶的制备:将蛋白质溶于0.2mol/L pH7.0的混合磷酸盐缓冲液中,质量浓度为12g/100mL,搅拌均匀,将此蛋白质溶液装于25mL的烧杯中,盖以铝箔,将此烧杯置于90℃的水浴中加热保温30min,然后冰浴冷却至室温,在4℃的冰箱中保存24h,从冰箱中取出陈化30min,测定其凝胶强度。
凝胶强度的测定:用物性测试仪测定凝胶的强度,选用直径为12mm的圆柱状平头冲头。冲压速度:2mm/s;冲压深度:20mm;试样做成30mm×30mm的圆柱体,压至20mm,则形变为33.3%。记录凝胶破裂时所需的力定义为凝胶强度。
凝胶弹性的测定:凝胶的制备及测试方法同上。记录冲压深度为5mm(此时凝胶尚未破裂)时所需的力,即为凝胶弹性。
1.3.7 大豆分离蛋白的荧光光谱分析
参照Kalapathy等[3]的方法,将大豆分离蛋白溶于0.2mol/L pH7.0的磷酸盐缓冲液中,配制成2.0mg/mL的蛋白质溶液,以0.2mol/L pH7.0的磷酸盐缓冲液作参比,采用荧光分光光度计进行荧光测定,激发波长280nm,发射光谱扫描范围300~500nm之间。
1.3.8 大豆分离蛋白的紫外吸收光谱
将大豆分离蛋白溶于0.2mol/L pH7.0的磷酸盐缓冲液中,配制成2.0mg/mL的蛋白质溶液,以0.2mol/L pH7.0的磷酸盐缓冲液作参比,采用紫外-可见分光光度计做紫外-可见扫描,速度10nm/min,范围200~800nm之间。
2 结果与分析
2.1 大豆分离蛋白的回收率与纯度
以低温脱脂豆粕为原料,采用乙醇浸出方法可进一步去除豆粕中的残留脂质,得到低脂质含量豆粕,低脂质含量豆粕再经干热处理后,以其为原料制备大豆分离蛋白,分离蛋白的回收率与产品的纯度见表1。
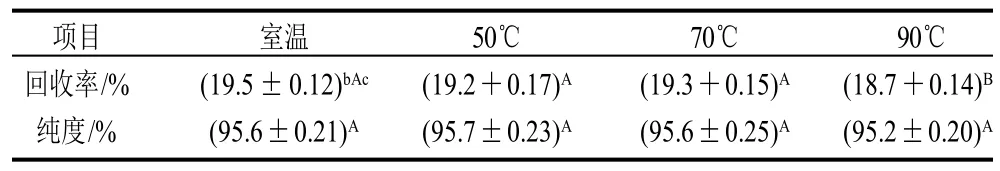
表1 不同温度处理所得分离蛋白的回收率与产品纯度Table 1 Recovery rates and purity of SPI from alcohol-washed soybean flakes subjected to dry heat treatment at different temperatures
由表1可知,除90℃处理大豆分离蛋白的回收率略有降低外,其他样本的分离蛋白回收率与产品纯度变化很小。
2.2 大豆分离蛋白的溶解性能
由图1可知,随着干热处理温度的增加,蛋白质的溶解性能增强,但当温度超过70℃时,蛋白质的溶解度略有回落。结合荧光及紫外吸收光谱分析可知,随着热处理温度的增加,位于蛋白质分子内部的疏水性氨基酸如芳香族氨基酸残基等的暴露(或部分氨基酸氧化引起蛋白质的亲水性增强),蛋白质的变性程度增加,而适当程度的变性增加了大豆分离蛋白的溶解度;但当干热处理温度超过70℃时,可溶性蛋白的溶解度降低,出现这种情况可能是蛋白质分子通过暴露在分子表面的疏水性氨基酸的疏水相互作用进一步聚集引起的。图2大豆分离蛋白的浊度分析也验证了这一点。

图1 不同温度处理大豆分离蛋白的溶解度Fig.1 Solubility of SPIs from alcohol-washed soybean flakes subjected to dry heat treatment at different temperatures
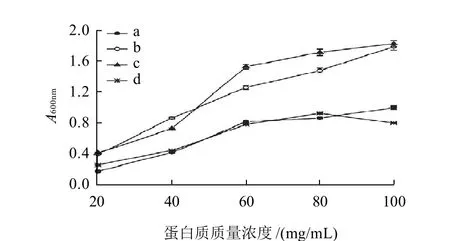
图2 不同温度处理大豆分离蛋白的浊度变化Fig.2 Turbidity of SPIs from alcohol-washed soybean flakes subjected to dry heat treatment at different temperatures
由图2可知,采用干热处理的方法制备的大豆分离蛋白的混浊度有明显的差别。随着干热处理温度的升高,蛋白质溶液的混浊度增加;当干热处理温度升至90℃时,蛋白质溶液的混浊度下降,其水平趋势接近室温大豆分离蛋白。干热处理对大豆分离蛋白浊度的影响与对溶解度的影响趋势相一致,说明热处理后的大豆分离蛋白聚集现象明显,正是这种高分子的蛋白质分子聚集导致其溶液的混浊度增加。当干热处理温度至90℃时,可溶性蛋白的表面疏水性增加,分子聚集程度加大,形成较大的颗粒沉淀,结果造成蛋白质溶液的混浊度下降,可溶性蛋白的溶解度降低。实验过程中发现经90℃处理的大豆分离蛋白,其浊度测定大豆分离蛋白的制备中离心有沉淀析出,其原因可能源于此。
2.3 大豆分离蛋白的凝胶性能
大豆蛋白在加热时有形成凝胶的能力,凝胶性能是大豆蛋白的重要功能特性之一[4]。图3~6分别为4种不同温度(室温,50、70℃和90℃) 处理大豆分离蛋白的凝胶性能比较。

图3 室温处理大豆分离蛋白的凝胶性能测定曲线Fig.3 Force-deformation curve of SPI gel from alcohol-washed soybean flakes subjected to dry heat treatment at room temperature
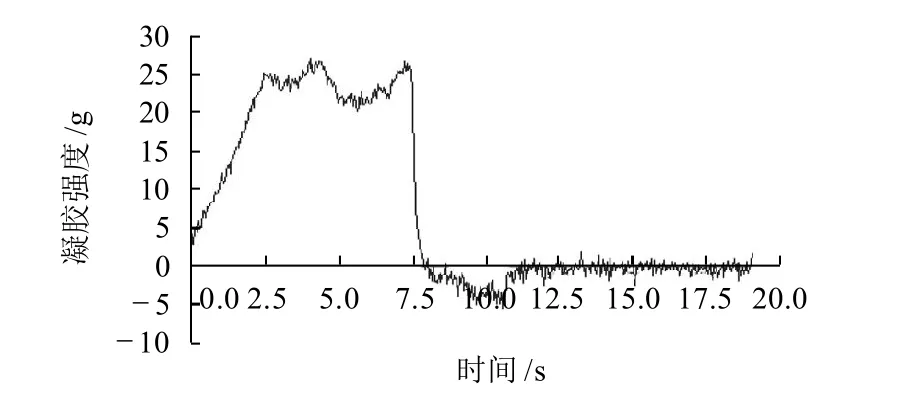
图4 50℃处理大豆分离蛋白的凝胶性能测定曲线Fig.4 Force-deformation curve of SPI gel from alcohol-washed soybean flakes subjected to dry heat treatment at 50℃
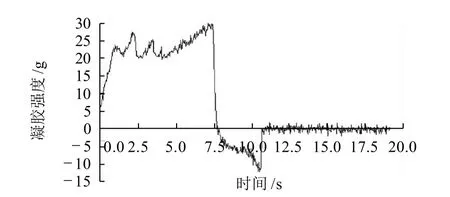
图5 70℃处理大豆分离蛋白的凝胶性能测定曲线Fig.5 Force-deformation curve of SPI gel from alcohol-washed soybean flakes subjected to dry heat treatment at 70 ℃
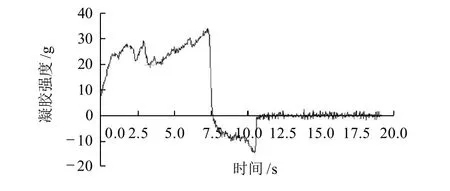
图6 90℃处理大豆分离蛋白的凝胶性能测定曲线Fig.6 Force-deformation curve of SPI gel from alcohol-washed soybean flakes subjected to dry heat treatment at 90 ℃
由图3~6可知,经室温,50、70℃和90℃处理大豆分离蛋白的凝胶强度依次为(24.9±0.12)、(26.7±0.10)、(29.3±0.09)g和(34.2±0.15)g;凝胶弹性依次为(21.6±0.09)、(20.6±0.13)、(20.0±0.11)g和(19.2±0.12)g。可见,随着干热处理温度的增加,蛋白质的凝胶强度增强,而凝胶弹性则成微弱的减弱趋势。
蛋白质的凝胶作用是变性的蛋白质分子聚集以形成一个有规则的蛋白质网络结构过程。蛋白质网络的形成是蛋白质-蛋白质和蛋白质-溶剂(水)相互作用之间以及相邻多肽链吸引力和推斥力之间一个平衡的结果[5]。其中大豆蛋白内的疏水键、氢键以及二硫键对蛋白质网络的形成起着重要的作用。后面的荧光及紫外吸收光谱分析表明,随着干热处理温度的增加(如室温,50℃和70℃),蛋白质分子内部疏水性氨基酸的暴露,蛋白质的变性程度增加,适当程度的变性增加了大豆分离蛋白的溶解度(图1),有利于胶凝过程中变性大豆蛋白氢键的形成与疏水相互作用,提高其凝胶强度;但随着干热处理温度的进一步升高(如90℃),蛋白质分子的聚集程度增强,溶液的浊度减弱(图2),可溶性蛋白的溶解度降低(图1),凝胶弹性下降。
2.4 大豆分离蛋白的荧光光谱
在280nm激发的大豆分离蛋白荧光发射光谱主要是由色氨酸和酪氨酸残基所发射的[6],又名内源性荧光光谱。和其他含色氨酸和酪氨酸残基的球蛋白一样,由于其分子中从酪氨酸残基到色氨酸残基之间发生了能量转移,从而导致了酪氨酸残基的荧光熄灭和色氨酸残基的荧光增加。因此大豆球蛋白的荧光峰实际上是色氨酸残基的荧光峰,其峰位在325~350nm波长之间[3]。

图7 大豆分离蛋白的内源性荧光发射光谱(280nm激发)Fig.7 Intrinsic fluorescence spectra of SPIs from alcohol-washed soybean flakes subjected to dry heat treatment at different temperatures
图7为大豆分离蛋白的内源性荧光光谱,激发波长为280nm。与室温大豆分离蛋白相比,经50、70℃和90℃处理的大豆分离蛋白内源性荧光光谱,其峰型基本没有变化,且λmax均位于340nm。但干热处理大豆分离蛋白的荧光强度均明显增加,且干热处理温度超过50℃时,荧光强度下降,而后随干热处理温度的增加又上升。
Liang等[15]在研究高温(60℃)贮藏期间的大豆蛋白与大豆油相互作用时发现,发生氧化的大豆蛋白,可溶性蛋白的表面疏水性降低。Zheng Hengguang等[7]和Boatright等[10]也观察到在大豆分离蛋白加工过程中,由于蛋白质氧化而引起的蛋白质表面疏水性的降低。热处理后大豆分离蛋白荧光强度的改变反映了色氨酸残基所处微环境发生了变化[15]。与室温大豆分离蛋白相比,经50℃处理的大豆分离蛋白荧光强度增加,说明此时色氨酸残基较多地暴露在蛋白质分子的表面;当干热处理温度超过50℃至70℃时,荧光强度略微下降,说明此时暴露在蛋白质分子表面的色氨酸残基部分被氧化;当干热处理温度至90℃时,荧光强度又上升,说明位于蛋白质分子内部的色氨酸残基又进一步暴露,蛋白质的变性程度增强,可溶性蛋白的表面疏水性增加,分子聚集程度加大,大豆分离蛋白溶解度与浊度下降(图1、2)。2.5 大豆分离蛋白的紫外吸收光谱
溶液中的蛋白质分子之所以产生紫外吸收光谱,主要是因为色氨酸、苯丙氨酸、酪氨酸残基的侧链基团对光的吸收,这3种氨基酸由于其发色团不同而有不同的紫外吸收光谱,其中色氨酸在280nm波长处附近有一个吸收峰;酪氨酸在275nm波长附近有一个最大吸收峰;苯丙氨酸在257nm波长附近有一个吸收峰。大多数蛋白质在280nm波长处都有吸收峰,这是由于色氨酸和酪氨酸残基对光的吸收。生色基团微环境的性质是由蛋白质分子的构象所决定的。构象改变,则微环境随之改变;微环境的改变,则生色基团的紫外吸收光谱也随之改变。因此,只要测出生色基团紫外吸收光谱的变化,就可以了解微环境的变化,从而推断蛋白质分子在溶液中的构象变化[6]。
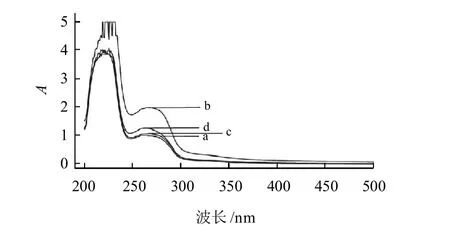
图8 大豆分离蛋白大豆分离蛋白的紫外吸收光谱Fig.8 UV spectra of SPIs from alcohol-washed soybean flakes subjected to dry heat treatment at different temperatures
图8为改性大豆分离蛋白的紫外可见光谱。与室温大豆分离蛋白相比,经过50℃和90℃处理后的大豆分离蛋白在280nm波长附近的吸收峰强度增加,峰型变窄,说明发色基团所处的环境由非极性向极性变化;而用70℃处理后的分离蛋白在280nm波长附近的吸收峰反而减弱,峰型也随之变宽。随着干热处理温度的升高(如室温和50℃),280nm波长附近的吸收峰强度增加,芳香族氨基酸残基开始较多地暴露在蛋白质分子的表面;当干热处理温度升至70℃时,280nm波长附近的吸收峰强度下降,说明此时暴露在蛋白质分子表面的芳香族氨基酸残基部分被氧化;与70℃处理大豆分离蛋白相比较,当干热处理温度升至90℃时,280nm波长附近的吸收峰强度上升,说明位于蛋白质分子内部的芳香族氨基酸残基进一步暴露,蛋白质的变性程度增强,可溶性蛋白的表面疏水性增加,分子聚集程度加大,大豆分离蛋白溶解度与浊度下降(图1、2)。
3 结 论
以不同温度处理过的乙醇洗豆粕为原料,制备大豆分离蛋白,并对不同温度干热处理的大豆分离蛋白的凝胶性能及其相关性能进行了研究和表征,结果发现,大豆分离蛋白的凝胶强度随干热处理温度的升高而增强,而凝胶弹性则有微弱的下降趋势。荧光和紫外吸收光谱的分析表明,乙醇洗豆粕经不同温度处理后制备的大豆分离蛋白,其生色基团所处微环境发生了变化,可溶性蛋白的表面疏水性增加。溶解度与浊度分析说明,适当的干热处理有利于增强大豆蛋白的溶解性能,但高分子的蛋白质聚集体的形成又导致其凝胶弹性渐弱,混浊度增加。
[1] UTSUMI S, MATSUMURA Y, MORI T. Structure-function relationships of soy proteins[M]//DAMODARAN S, PARAF A. Food proteins and their application. New York∶ Marcel Dekker, 1997∶ 257-291.
[2] UTSUMI S, KINSELLA J E. Structure-function relationships in food proteins∶ subunit interactions in heat-induced gelation of 7S, 11S, and soy isolate proteins[J]. Journal of Agricultural and Food Chemistry,1985, 33(2)∶ 297-303.
[3] KALAPATHY U, HETTIARACHCHY N S, RHEE K C. Effect of drying methods on molecular properties and functionalities of disulfide bond-cleaved soy proteins[J]. Journal of the American Oil Chemists’Society, 1997, 74(3)∶ 195-199.
[4] 石彦国, 任莉. 大豆制品工艺学[M]. 北京∶ 中国轻工业出版社, 1993∶371-386.
[5] FENNEMA O R. 食品化学[M]. 2 版. 王璋, 译. 北京∶ 中国轻工出版社, 1991∶ 230-233.
[6] 陶慰孙, 李惟, 姜涌明. 蛋白质分子基础[M]. 2版. 北京∶ 高等教育出版社, 1995∶ 260-263.
[7] ZHENG Hengguang, YANG Xiaoquan, TANG Chuanhe, et al. Preparation of soluble soybean protein aggregates (SSPA) from insoluble soybean protein concentrates(SPC) and its functional properties[J]. Food Research International, 2008, 41(2)∶ 154-164.
[8] HUA Yufei, HUANG Youru, QIU Aiyong, et al. Properties of soy protein isolate prepared from aqueous alcohol washed soy flakes[J]. Food Research International, 2005, 38(3)∶ 273-279.
[9] KONG Xiangzhen, LI Xianghong, WANG Hongjing, et al. Effect of lipoxygenase activity in defatted soybean flour on the gelling properties of soybean protein isolate[J]. Food Chemistry, 2008, 106(3)∶ 1093-1099.
[10] BOATRIGHT W L, HETTIARACHCHY N S. Soy protein isolate solubility and surface hydrophobicity as affected by antioxidants[J]. Journal of Food Science, 1995, 60∶ 798-800.
[11] HUANG Youru, HUA Yufei, QIU Aiyong. Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation[J]. Food Research International, 2006, 39(2)∶ 240-249.
[12] HUANG Youru, YU Da, HUA Yufei, et al. Detection of free radical transfer in lipoxygenase I-B-catalyzed linoleic acid-soybean proteins interaction by electron spin resonance spectroscopy(ESR)[J]. Journal of Agricultural and Food Chemistry, 2006, 54(24)∶ 9216-9220.
[13] 黄友如, 华欲飞, 卢祥云, 等. 脂肪氧合酶催化亚油酸氧化与大豆蛋白相互作用的荧光光谱分析[J]. 食品科学, 2008, 29(5)∶ 134-139.
[14] 黄友如, 华欲飞, 张根华, 等. 重水环境下的氧化大豆蛋白傅立叶变换红外(FT-IR)分析[J]. 中国粮油学报, 2010, 25(5)∶ 19-23; 29.
[15] LIANG J H. Fluorescence due to interactions of oxidizing soybean oil and soy proteins[J]. Food Chemistry, 1999, 66∶ 103-108.
Gel Properties of Soybean Protein Isolate Prepared from Alcohol-Washed Soybean Flakes Subjected to Dry Heat Treatment
HUANG You-ru,CHEN Yi-yong,ZHU Dong-xing,ZHAO Yang,WANG Tan-yu
(School of Biological Science and Food Engineering, Changshu Institute of Technology, Changshu 215500, China)
Alcohol-washed soybean flakes were treated at different temperatures and used to prepare soybean protein isolates(SPIs). The gel properties and other related properties of SPIs from alcohol-washed soybean flakes were characterized. The gel strength of SPI increased with increasing dry heat treatment temperature, while the gel elasticity exhibited a somewhat downward trend. The fluorescence and UV-visible spectra showed that the microenvironment around the chromospheres changed after dry heat treatment. Meanwhile, the surface hydrophobicity of soluble proteins and the extent of molecular aggregation obviously increased. Proper dry heat treatment could increase the solubility of SPI but gradually reduce the gel elasticity as a result of enhanced molecular aggregation.
soybean protein isolate;gel property;dry heat treatment
TS201.21
A
1002-6630(2012)03-0014-05
2011-01-24
江苏省高校自然科学研究计划项目(10KJB550001);苏州市科技计划项目(SYND201003)
黄友如(1966—),男,副教授,博士,研究方向为生物高分子及植物蛋白。
E-mail:huangyouru@yahoo.com.cn
