有氧运动加谷氨酰胺补充对2型糖尿病大鼠骨骼肌炎症因子NF-κB、MPO及
2012-10-18付德荣孙小华刘承宜廖八根李鹏博田祯祥
付德荣,孙小华,刘承宜,廖八根,李鹏博,田祯祥
糖尿病是继心脑血管疾病、肿瘤之后严重危害人类健康的第三大类疾病。胰岛素(Insulin,INS)抵抗和/或分泌缺陷是2型糖尿病(Type 2diabetes mellitus,T2DM)的基本病因。骨骼肌是INS作用的主要靶组织,其占人体重量的40%~50%,正常情况下,75%以上的INS介导的糖代谢由骨骼肌完成[30]。近年研究发现,骨骼肌的慢性炎症与INS抵抗和T2DM 的发生密切相关[30,33]。肥胖或糖尿病患者,骨骼肌通过旁分泌、自分泌及内分泌的效应产生肿瘤坏死因子-ɑ(tumor necrosis factorɑ,TNF-ɑ)、C 反应蛋白(C-reactive protein,CRP)、核转录因子-κB(nuclear factorκB,NF-κB)、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)、髓过氧化物酶(myeloperoxidase,MPO)等多种炎症介质,引发骨骼肌慢性炎症反应。TNF-ɑ、NF-κB及MCP-1等介质通过直接或间接效应抑制INS信号通路,导致糖的转运和利用障碍[25,30],后者又促进INS抵抗和T2DM病情发展,进一步加重骨骼肌的炎症程度,形成恶性循环。
谷氨酰胺(glutamine,Gln)是人体免疫细胞的主要能源底物,也是体内大多数细胞的能源物质,主要在骨骼肌合成 并95%以上储存在骨骼肌[12,15,29]。作为谷胱甘肽(glutathione,GSH)的前体,Gln补充可提高体内GSH含量,增加机体抗氧化能力,抑制NF-κB的活性,降低活性氧的产生,降低中性粒细胞(polymorphonuclear neutrophils,PMN)对组织的浸润[15]。同时,补充Gln还可增加正常人、肥胖及T2DM患者循环中血清胰高血糖素样肽-1(glucagon-like peptide 1,GLP-1)的水平[6]。GLP-1是一种快速强力刺激餐后INS释放的肠道激素,GLP-1刺激INS分泌的形式呈血糖依赖性[5],并抑制胰高血糖素的分泌和胃的排空[3,6],发挥降血糖效应。肥胖及T2DM患者体内Gln减少[13,31]。
有氧运动是预防和治疗糖尿病的基础。运动在降低体脂的同时可改善骨骼肌质量,增加骨骼肌糖脂代谢的关键调节物葡萄糖转运体蛋白-4(Glucose transporter isoform 4,GLUT4)及过氧化物酶激活体γ共激活物-1(peroxisome proliferator-activated receptorγcoactivator-1,PGC-1)的表达,加速糖脂代谢;提高抗氧化酶黄嘌呤氧化酶(xanthine oxidase,XO)、GSH、超氧化物歧化酶(superoxide dismutase,SOD)等的含量,增强抗氧化能力[26];促进骨骼肌抗炎因子白介素 6(einterleukin-6,IL-6)[7,32]和 NF-κB 抑制蛋白(protein inhibitorκB,IκB)的表达[24],IL-6强烈抑制 TNF-ɑ表达[7,32],IκB抑制 NF-κB活性[24],减轻骨骼肌炎症反应 程度;增加GLP-1的分泌量[11],降低血糖。运动量即运动强度乘运动时间对T2DM患者的治疗至关重要。大运动量可显著增加INS的敏感性,降低糖基化血红蛋白浓度,而低运动量无效[20]。
鉴于以上情况,本研究设想给予T2DM大鼠长期有氧运动联合Gln补充,对改善骨骼肌慢性炎症状态、降低血糖、提高GLP-1及INS水平将起协同效应,而目前有关这方面的研究尚未见报道。因此,本研究拟定T2DM大鼠进行6周的无负重游泳运动,同时饲料中添加2%Gln,探讨有氧运动及Gln补充联合作用时对T2DM大鼠空腹血糖(fasting blood-glucose FBG)、INS、GLP-1及骨骼肌炎症因子NF-κB、MPO及MCP-1基因表达的影响。
1 材料与方法
1.1 实验动物
SPF级雄性SD(Sprague-Dawley)大鼠60只(广州中医药大学实验中心提供),179.8±19.2g,3~4只/笼,在温度23℃±2℃、湿度50%±5%、明暗周期各12h(8:30~20:30光照)的动物房内饲养。
1.2 实验方案
所有大鼠1周适应性饲养后随机分为健康对照组(C组,26只,212.8±10.9g)和糖尿病造模组(D组,34只,220.4±25.6g),两组大鼠体重差异无显著性。C组给予普通饲料(标准啮齿类动物饲料)饲养,D组给予高脂膳食(猪油10%,蛋黄粉8%,蔗糖20%,胆酸纳0.1%,基础饲料61.9%)。饲养4周后D组大鼠一次性腹腔注射35 mg/kg链脲佐菌素(streptozotocin STZ,sigma),72h后尾静脉取血测大鼠FBG值,血糖≥16.7mmol/L为T2DM成模标准,血糖≤16.7mmol/L再补充15mg/kg腹腔注射,3日后4只未成模大鼠剔除。
造模成功后两组大鼠再进一步随机分为:安静组(CQ,DQ)、运动组(CE,DE)、Gln组(CG,DG)、运动加 Gln组(CEG,DEG)(表1)。运动组大鼠进行游泳运动(水温30℃±2℃),第1周前3日15min/次,后3日30min/次,第2周前3日45min/次,后3日60min/次,第3~6周60 min/次,6次/周。运动过程中如有疲劳现象(数秒内未迅速浮上水面),即刻拿出休息5~10min,恢复后再继续完成训练时间。Gln组大鼠饲料添加2%(w/w)的L-Gln。

表1 本研究大鼠分组一览表Table 1 Groups of Animals
1.3 取材
第6周训练结束48h后对所有大鼠进行取材。训练过程中大鼠溺水死亡3只,疾病死亡2只(DE组1只,肠腔多发肿瘤;DEG组1只,颈部脓肿。考虑为糖尿病免疫低下所致),自然死亡1只(CEG组,未见任何异常)。取材前大鼠禁食12h,禁水4h。10%水合氯醛腹腔注射麻醉后腹主动脉取血,分离血清后-80℃保存。迅速剥离双侧腓肠肌内侧头,取中1/3段,剔除表层筋膜及与之相连的浅层肌肉,然后入液氮备用。
1.4 检测指标
1.4.1 血液指标
FBG采用Super GLUCOTM血糖仪测定;INS及GLP-1采用酶联免疫法测定(试剂盒购自上海蓝基生物科技有限公司ShangHai BlueGene Biotech CO.,LTD)。
1.4.2 基因表达
采用实时定量PCR(real-time PCR)检测骨骼肌NF-κB、MPO及MCP-1mMRA的表达。引物由上海英骏生物技术有限公司合成。目的基因NF-κB:Forward primer CTC AAG AAC AGC AAG GCA AGC AC,Reverse primer AGA GGT GTC GTC CCA TCG TTA GG G。目的基因 MPO:Forward primer CCC ATC CAC CAT GCT TTA TTA G,Reverse primer ACA ACA CTG GCA TCA CTA CCG T。目的基 因 MCP-1:Forward primer ATG CAG TTA ATG CCC CAC TC,Reverse primer TTC CTT ATT GGG GTC AG CAC。内参基因18SrRNA:Forward primer CAT TCG AAC GTC TGC CCT ATC A,Reverse primer GGG TCG GGA GTG GGT AAT TTG。
RNA抽提:1)50mg骨骼肌中加入预冷的1ml Trizol reagent,充分匀浆。2)冰上静置5min,加入0.2ml氯仿,剧烈震荡15sec,冰上放置10min。3)4℃12000g离心15min。4)上清液转移1.5mlEP管中,加入0.5ml异丙醇,混匀,室温静置10min。5)4℃12000g离心10min。6)弃上清,加入1ml 75%乙醇溶液(DEPC水配制)洗涤沉淀。7)4℃7500g离心5min。8)弃去乙醇,室温干燥15 min,加入30μL DEPC处理水溶解。
cDNA第一链合成:1)取总RNA 1μg,按反转录试剂盒(Takara PrimeScriptTM RT reagent Kit)操作指南依次加入5xPrimeScriptTM Buffer 2 μL,PrimeScriptTM RT Enzyme MixI 0.5μL,Oligo dT Primer(50μM)0.5μL,Random 6 mers(100μM)0.5μL,RNase Free dH2O 补足10μL。2)反应条件:37℃15min,85℃5min。cDNA产物-80℃保存。
PCR扩增:按荧光定量PCR试剂盒(TaKaRa SYBR○RPremix Ex TaqTMII)操作指南配制PCR反应液,总体系为25μL:SYBR○RPremix Ex TaqTMII(2x)12.5μL,PCR Forward Primer(10μM)1μL,PCR Reverse Primer(10μM)1 μL,cDNA 1μL,补ddH2O至25μL。
PCR循环条件:95℃预变性10min;95℃变性10 sec;60℃ 退火20sec;72℃延伸 15sec;共35~38个循环,最后72℃延伸5min。
1.5 统计学分析
所有实验数据用SPSS 17.0软件进行处理。数据用均数±标准差(D)表示。资料先用固定模型多因素方差分析检查高脂饮食、Gln补充与运动之间的主效应及三者间的交互影响。如有交互影响则分别在固定单因素或双因素水平后用独立样本t检验检查另一因素的效应;如有主效应但无交互影响则进一步用单因素方差分析组间差异。差异具显著性水平P<0.05,差异具非常显著性水平P<0.01。
2 结果
2.1 大鼠FBG、GLP-1及INS的变化
2.1.1 大鼠FBG的变化
高脂膳食、运动及谷氨酰胺补充对大鼠FBG均有明显影响作用,且高脂膳食与Gln补充、高脂与运动间存在交互影响。长期高脂喂养的DQ组大鼠FBG值显著高于普通饲料喂养CQ组大鼠。长期游泳运动可明显降低CE组和DE组大鼠的FBG。长期Gln补充显著降低DG组大鼠FBG值,但对CG组大鼠FBG影响不明显。运动联合Gln补充时,可显著降低DEG组大鼠FBG值,并较单纯运动(DE组)或 Gln补充(DG组)时明显,但对CEG组大鼠FBG影响不明显(表2)。
2.1.2 大鼠血GLP-1的变化
高脂膳食、运动及谷氨酰胺对大鼠血清GLP-1均有明显影响作用,且相互间有明显交互影响。高脂喂养的DQ组大鼠血清GLP-1水平显著低于普通饲料喂养的CQ组大鼠。长期游泳运动明显增加DE组大鼠GLP-1浓度,对CE组大鼠GLP-1影响不明显。长期Gln补充明显增加DG组大鼠GLP-1水平,对CG组大鼠GLP-1无明显影响作用。当运动联合Gln补充时,可显著增加CEG组和DEG组大鼠的GLP-1水平,对DEG组大鼠的影响较单纯运动(DE组)或Gln补充(DG)时显著,对CEG组大鼠的影响较单纯Gln补充(CG组)时显著,与单纯运动(CE组)时比较差异不明显(表2)。
2.1.3 大鼠血INS水平的变化
有氧运动、Gln补充及高脂膳食对大鼠空腹INS均有明显影响作用,但三者间无明显交互影响。DQ组大鼠空腹INS水平显著低于CQ、CE、CG及CEG组大鼠。长期游泳运动明显升高DE组和CE组大鼠的INS水平。长期Gln补充显著升高DG组大鼠INS水平,对CG组大鼠影响不明显。运动联合Gln补充时,显著增加DEG组大鼠的INS水平(显著高于DQ组),与单纯运动(DE组)或Gln补充(DG组)比较有进一步增加的趋势,但差异不显著。二者联合对正常组CEG组大鼠INS水平的影响不明显(表2)。
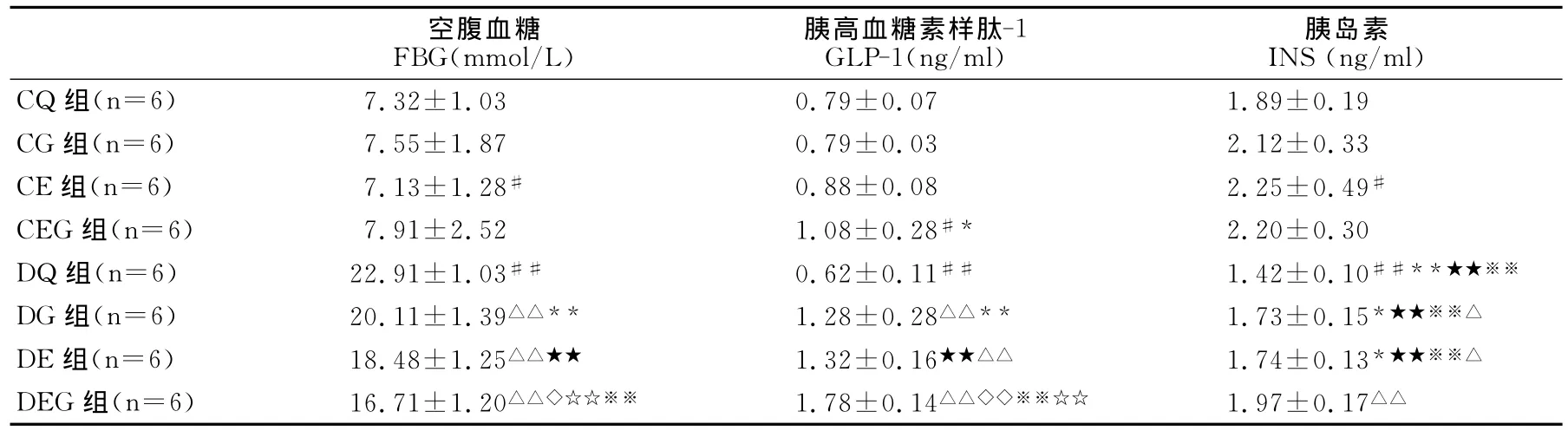
表2 本研究6周游泳运动及Gln补充对大鼠血INS、GLP-1及FBG的影响一览表Table 2 Effects of 6Weeks Swimming and Glutamine Supplement on Blood INS、GLP-1and FBG of Rats
2.2 大鼠骨骼肌NF-κB、MPO及 MCP-1mRNA的表达
2.2.1 大鼠骨骼肌 NF-κB mRNA的表达
长期高脂喂养的T2DM组大鼠骨骼肌NF-κB mRNA的表达显著高于正常组大鼠。长期游泳运动对DE组大鼠和CE组大鼠骨骼肌NF-κB mRNA表达均呈明显抑制效应。长期Gln补充显著抑制DG组大鼠NF-κB mRNA的表达,对CG组无明显影响。运动联合Gln补充降低DEG组大鼠骨骼肌NF-κB mRNA表达的效应显著高于单纯Gln补充(DG组)的作用,但与单纯运动(DE组)比较差异不显著。二者联合对CEG组大鼠骨骼肌NF-κB mRNA表达的影响与单纯运动(CE组)或单纯Gln补充(CG组)比较无差异。单纯运动(CE组和DE组)与单纯Gln补充(CG组和DG组)比较,对大鼠骨骼肌NF-κB mRNA的表达影响无明显差异(表3)。
2.2.2 大鼠骨骼肌 MPO mRNA的表达
运动、Gln补充及高脂膳食对大鼠骨骼肌MPO mRNA的表达均有显著影响作用,且三者间存在交互影响。高脂喂养的DQ组大鼠骨骼肌MPO mRNA的表达显著高于正常喂养的CQ组大鼠。长期有氧运动或Gln补充均可明显降低T2DM大鼠(DE组与DG组)及正常大鼠(CE组和CG组)骨骼肌MPO mRNA的表达量,运动联合Gln补充对CEG组和DEG组大鼠MPO mRNA表达的影响与单纯运动(CE组和DE组)或单纯Gln补充(CG组和DE组)时相似(表3)。
2.2.3 大鼠骨骼肌 MCP-1mRNA的表达
运动、Gln补充及高脂膳食对大鼠骨骼肌MCP-1mRNA的表达均有显著影响作用,且运动与Gln补充、Gln补充与高脂膳食间存在交互影响。长期高脂喂养的DQ组大鼠骨骼肌MCP-1mRNA的表达显著高于正常喂养的EQ组大鼠。有氧运动或Gln补充均可明显降低T2DM(DE组和DG组)及正常大鼠(CE组和DE组)骨骼肌MCP-1mRNA的表达量,运动联合Gln补充对DEG组大鼠MCP-1mRNA表达的影响与单纯Gln补充(DG组)相似,但明显高于单纯运动(DE组)的影响,对CEG组的影响与单纯运动(CE组)或Gln补充(CG组)的效果相似(表3)。

表3 本研究6周游泳运动及Gln补充对大鼠骨骼肌NF-κB、MCP-1及MPO基本表达的影响一览表Table 3 Effects of 6Weeks Swimming and Glutamine Supplement on NF-κB,MCP-1and MPO mRNA Expression of Rats Muscle
3 分析与讨论
高脂喂养诱导大鼠肥胖后再给予小剂量STZ注射是T2DM造模的常用方法[2,23]。本实验成膜后的大鼠血糖显著升高,多饮多食多尿现象明显,符合T2DM特点。6周的实验干预后,T2DM安静组大鼠骨骼肌NF-κB、MCP-1及MPO的mRNA表达量显著高于安静对照组,说明本实验T2DM大鼠存在明显的骨骼肌炎症情况,与 Wei等[30]和Zeyda等[33]的研究显示。慢性炎症是胰岛素抵抗及T2DM 发病的 关 键 因 素[30,33]。NF-κB是 炎 症 通 路 的 主 要调节因子,NF-κB的激活在骨骼肌INS抵抗中起重要作用[24,25]。正 常情 况 下 ,NF-κB 与IκB 结 合 位 于 胞 浆 。 细 胞因子、活性氧、高血糖以及脂肪酸等可激活IκB激酶(IκB kinase,IKK),IKK 磷 酸 化IκB,磷 酸 化 的IκB 继 续 被 泛 素化,最后通过蛋白水解酶降解,NF-κB被释放转位进入胞核。在胞核中NF-κB控制炎症因子 TNF-ɑ、MCP-1、IL-1等的转录水平,并磷酸化INS受体底物-1(insulin receptor substrate-1,IRS-1)而抑制INS信号通路和介导炎症蛋白表达[25]。趋化因子 MCP-1广泛存在于不同类型的细胞中,多种刺激可促进 MCP-1的表达增加[16]。T2DM患者骨骼肌 MCP-1显著增加[16,30],本实验显示了相似的结果。MCP-1趋化大量巨细胞进入骨骼肌和脂肪细胞中,诱导骨骼肌和脂肪组织的慢性炎症[27,30]。骨骼肌对 MCP-1高度敏感,少量的MCP-1即可抑制INS信号通路和减少骨骼肌对糖的摄取。因此,MCP-1被认为是引起INS抵抗的骨骼肌和脂肪组织交叉对话联系的关键分子[21,30]。释放入血的MCP-1浓度则与糖基化血红蛋白密切正相关[17]。MPO由多核性粒细胞(polymorphonuclear neutrophils,PMN)分泌并促进PMN迁移进入靶部位[9]。MPO可利用氯化物和过氧化氢产生有抗菌作用的次氯酸(hypochlorous acid,HOCl),即 MPO-H2O2-Cl-系统,这在正常机体的免疫防御中起重要作用。病理情况下,持续激活的MPOH2O2系统将引起组织损伤,HOCl引起靶组织的硝化、卤化和氧化反应,引发和加重炎症病变[10]。阻断 MPO的活化位点、抑制氯化物的形成、使用氧化抑制剂和裂解次氯酸阻止炎症复合物的形成和播撒已被作为新的方法用于相关疾病的治疗[10]。本实验中T2DM大鼠FBG明显增加,而ISN显著降低,说明升高的NF-κB mRNA和 MCP-1 mRNA对大鼠ISN的分泌产生了明显的抑制,而MPO的增加可能进一步加重骨骼肌的炎症损伤,造成恶性循环。
规律运动是预防和治疗T2DM的关键[1,7,24]。本实验显示,6周的游泳运动明显降低了T2DM大鼠骨骼肌NF-κB、MCP-1及MPO的基因表达,增加了ISN水平,降低了FBG值。Golbidi等[7]及 Sriwijitkamol等[24]报道,运动可明显增加抗炎因子IL-6的表达,IL-6抑制炎症因子TNF-ɑ和IL-1β的产生,并刺激抗炎因子IL-10和IL-1ra的分泌;增加IκB表达,抑制 NF-κB的活化[24];并可通过升高的肾上腺素直接抑制TNF-ɑ的反应[7]。有氧运动还可显著降低 MCP-1的 表 达[14,22,28],减少机体感染后MCP-1的 上 升幅度[22],降低癌症大鼠体内 MCP-1的含量,且降低的程度与肿瘤减少程度呈正相关[14]。骨骼肌炎症状态的改善提高了T2DM大鼠骨骼肌对ISN的敏感性,同时增加了ISN分泌,加强了骨骼肌糖脂代谢的能力[7],降低了FBG值,有利于T2DM病情的改善。6周游泳运动对正常大鼠骨骼肌NF-κB、MCP-1及MPO的表达亦有明显的抑制效应,并降低了其FBG,提高了ISN水平,这正是长期有氧运动不仅是T2DM治疗的必要手段,也是预防代谢类疾病及其他疾病发生的最佳行为方式[1,23]。6周游泳运动增加了T2DM大鼠的GLP-1水平,但对正常大鼠无影响,说明运动调节GLP-1与GLP-1刺激INS分泌的糖依赖形式相一致,对失稳态水平的GLP-1有明显调节作用,而对正常稳态的GLP-1无明显影响,这提高了运动降血糖的安全性。
Gln是人体最丰富的游离a-氨基酸,占血浆游离氨基酸的20%,其每天以80g的速度快速更新[29]。创伤、感染、手术等应激情况及高分解代谢疾病状态下,体内Gln被快速动用,血液和组织中Gln迅速下降甚至耗竭,机体抗氧化能力及细胞免疫能力下降,肠粘膜受损,骨骼肌蛋白分解增加,临床愈后情况与细胞外Gln浓度直接相关。外援性补充Gln后可明显逆转上述情况,改善病情,降低死亡率,因此 Gln被广泛用于临床多种疾病的 治疗[4,12,15]。T2DM患者Gln明显减少[13]。给予T2DM患者Gln补充不仅可提高机体的抗氧化能力,而且显著增加GLP-1的水平,增加INS浓度,降低餐后早期高血糖的发生率[6,19]。目前,使用GLP-1类似物或激动剂提高GLP-1的分泌量已成为T2DM患者最安全有效的治疗方法[5,8]。本实验显示,6周Gln补充可降低T2DM大鼠 MPO、NF-κB及 MCP-1的mRNA表达,抑制正常大鼠MPO、MCP-1的mRNA表达,但对正常大鼠NF-κB mRNA的表达无明显影响,说明Gln补充可明显抑制中性粒细胞和巨噬细胞对骨骼肌的浸润,减少T2DM大鼠骨骼肌的炎症性损伤,提高正常大鼠骨骼肌的抗炎能力,这个过程在没有影响NF-κB的情况下同样有效。Gln补充显著增加T2DM组大鼠GLP-1及INS水平,降低其FBG值,但对正常大鼠的影响均不明显,说明长期饮食中添加Gln可明显改善T2DM大鼠血糖调节的内稳态失衡情况,而不影响正常状态下的血糖调节,因此Gln的补充既有效又安全。
有氧运动联合Gln补充对T2DM大鼠骨骼肌炎症因子及其FBG、ISN及GLP-1的影响是否有协同效应,目前,据我们所查尚未见报道。本实验显示,6周的游泳联合Gln补充(DEG组)抑制T2DM大鼠NF-κB mRNA表达的效应显著高于单纯Gln补充(DG组),但与单纯运动(DE组)相似,对 MCP-1mRNA的抑制与单纯Gln补充(DG组)相似,但明显高于单纯运动(DE组)的效应,对 MPO mRNA表达的影响与单纯运动(DE组)或单纯Gln补充(DG组)时相似,降低大鼠FBG、增加GLP-1作用较单纯运动(DE组)或Gln补充(DG组)时明显,增加ISN的效应与单纯运动(DE组)或Gln补充(DG组)相似。因此,二者的联合效应优于运动或Gln补充单因素作用时的效应。这可能与T2DM机体降低的Gln水平[13]得到了补充,并随运动时骨骼肌血流量的增加,骨骼肌获取了更多的能源底物,增加了抗氧化物质的合成,且Gln补充促进更多的GLP-1的合成有关。
4 小结
骨骼肌的慢性炎症与INS抵抗和T2DM发病密切相关。抑制骨骼肌炎症、提高机体对INS的敏感性是近年来治疗T2DM的新途径。运动和饮食干预是治疗T2DM的最基本方式。本实验显示长期有氧运动或Gln补充可显著降低T2DM大鼠骨骼肌炎症因子 MPO、NF-κB及 MCP-1的mRNA表达,提高GLP-1及INS的水平,降低FBG,当二者联合作用时,对T2DM大鼠的效应较单纯运动或Gln补充时明显。因此,建议T2DM患者要长期坚持规律的有氧运动,并注意饮食中Gln的补充。
[1]常翠青.2型糖尿病患者的个体化运动处方[J].中国医学科学学报,2011,33(3):248-252.
[2]梁海霞,原海燕,李焕德,等.高脂喂养联合低剂量链脲佐菌素诱导的2型糖尿病大鼠模型稳定性观察[J].中国药理学通报,2008,24(4):551-555.
[3]BERLIE H,HURREN K M,PINELLI N R.Glucagon-like peptide-1receptor agonists as add-on therapy to basal insulin in patients with type 2diabetes:a systematic review[J].Diabetes Metab Syndr Obes,2012,5:165-174.
[4]BOELENS P G,NIJVELDT R J,HOUDIJK A P,et al.Glutamine alimentation in catabolic state[J].J Nutr,2001,131(9Suppl):2569S-2577S.
[5]DEFRONZO R A,ABDUL-GHANI M.Type 2diabetes can be prevented with early pharmacological intervention[J].Diabetes Care,2011,34Suppl2:S202-209.
[6]GREENFIELD J R,FAROOQI I S,KEOGH J M,et al.Oral glutamine increases circulating glucagon-like peptide 1,glucagon,and insulin concentrations in lean,obese,and type 2diabetic subjects[J].Am J Clin Nutr,2009,89(1):106-113.
[7]GOLBIDI S,MESDAGHINIA A,LAHER I.Exercise in the metabolic syndrome[J].Oxid Med Cell Longev,2012,Article ID349710:1-13.
[8]HANSEN K B,VILSBØLL T,KNOP F K.Incretin mimetics:a novel therapeutic option for patients with type 2diabetes-a review[J].Diabetes Metab Syndr Obes,2010,3:155-163.
[9]KLINKE A,NUSSBAUM C,KUBALA L,et al.Myeloperoxidase attracts neutrophils by physical forces[J].Blood,2011,117(4):1350-1358.
[10]MALLE E,FURTMÜLLER P G,SATTLER W,et al.Myeloperoxidase:a target for new drug development[J].Br J Pharmacol,2007,152(6):838-854.
[11]MARTINS C,MORGAN L M,BLOOM S R,et al.Effects of exercise on gut peptides,energy intake and appetite[J].J Endocrinol,2007,193(2):251-258.
[12]MATÉS J M,PÉREZ-GÓMEZ C,NÙÑEZ DE CASTRO I,et al.Glutamine and its relationship with intracellular redox status,oxidative stress and cell proliferation/death[J].Int J Biochem Cell Biol,2002,34(5):439-458.
[13]MENGE B A,SCHRADER H,RITTER P R,et al.Selective amino acid deficiency in patients with impaired glucose tolerance and type 2diabetes[J].Regul Pept,2010,160(1-3):75-80.
[14]MURPHY E A,DAVIS J M,BARRILLEAUX T L,et al.Benefits of exercise training on breast cancer progression and inflammation in C3(1)SV40Tag mice[J].Cytokine,2011,55(2):274-279.
[15]OLIVEIRA G P,DIAS C M,PELOSI P,et al.Understanding the mechanisms of glutamine action in critically ill patients[J].An Acad Bras Cienc,2010,82(2):417-430.
[16]PANEE J.Monocyte Chemoattractant Protein 1(MCP-1)in obesity and diabetes[J].Cytokine,2012,http://www.ncbi.nlm.nih.gov/pubmed/22766373.
[17]PAPATHEODOROU K,PAPANAS N,PAPAZOGLOU D,et al.Monocyte chemoattractant protein 1is correlated with glycemic control and peripheral arterial disease in type 2diabetic patients with metabolic syndrome[J].Angiology,2012,http://www.ncbi.nlm.nih.gov/pubmed/22492254.
[18]QIU S H,SUN Z L,CAI X,et al.Improving patients'adherence to physical activity in diabetes mellitus:a review[J].Diabetes Metab J,2012,36(1):1-5.
[19]SAMOCHA-BONET D,WONG O,SYNNOTT E L,et al.Glutamine reduces postprandial glycemia and augments the glucagon-like peptide-1response in type 2diabetes patients[J].J Nutr,2011,141(7):1233-1238.
[20]SEGERSTRÜM A B,GLANS F,ERIKSSON K F,et al.Impact of exercise intensity and duration on insulin sensitivity in women with T2D[J].Eur J Intern Med,2010,21(5):404-408.
[21]SELL H,DIETZE-SCHROEDER D,KAISER U,et al.Monocyte chemotactic protein-1is a potential player in the negative cross-talk between adipose tissue and skeletal muscle[J].Endocrinology,2006,147(5):2458-2467.
[22]SIM Y J,YU S,YOON K J,et al.Chronic exercise reduces illness severity,decreases viral load,and results in greater anti-inflammatory effects than acute exercise during influenza infection[J].J Infect Dis,2009,200(9):1434-1442.
[23]SRINIVASAN K,VISWANAD B,ASRAT L,et al.Combination of high-fat diet-fed and low-dose streptozotocin-treated rat:amodel for type 2diabetes and pharmacological screening[J].Pharmacol Res,2005,52(4):313-320.
[24]SRIWIJITKAMOL A,CHRIST-ROBERTS C,BERRIA R,et al.Reduced skeletal muscle inhibitor of kappaB beta content is associated with insulin resistance in subjects with type 2diabetes:reversal by exercise training[J].Diabetes,2006;55(3):760-767.
[25]TANTIWONG P,SHANMUGASUNDARAM K,MONROY A,et al.NF-κB activity in muscle from obese and type 2diabetic subjects under basal and exercise-stimulated conditions[J].Am J Physiol Endocrinol Metab,2010,299(5):E794-801.
[26]TONG T K,LIN H,LIPPI G,et al.Serum oxidant and antioxidant status in adolescents undergoing professional endurance sports training[J].Oxid Med Cell Longev,2012,Article ID 741239:1-7.
[27]VARMA V,YAO-BORENGASSER A,RASOULI N,et al.Muscle inflammatory response and insulin resistance:synergistic interaction between macrophages and fatty acids leads to impaired insulin action[J].Am J Physiol Endocrinol Metab,2009,296(6):E1300-1310.
[28]VIEIRA V J,VALENTINE R J,WILUND K R,et al.Effects of diet and exercise on metabolic disturbances in high-fat dietfed mice[J].Cytokine,2009,46(3):339-345.
[29]WATFORD M.Glutamine metabolism and function in relation to proline synthesis and the safety of glutamine and proline supplementation[J].J Nutr,2008,138(10):2003S-2007S.
[30]WEI Y,CHEN K,WHALEY-CONNELL A T,et al.Skeletal muscle insulin resistance:role of inflammatory cytokines and reactive oxygen species[J].Am J Physiol Regul Integr Comp Physiol,2008,294(3):R673-680.
[31]WIJEKOON E P,SKINNER C,BROSNAN M E,et al.Amino acid metabolism in the Zucker diabetic fatty rat:effects of insulin resistance and of type 2diabetes[J].Can J Physiol Pharmacol,2004,82(7):506-514.
[32]ZANCHI N E,ALMEIDA F N,LIRA F S,et al.Renewed avenues through exercise muscle contractility and inflammatory status[J].Sci World J,2012,Article ID 584205:1-7.
[33]ZEYDA M,STULNIG T M.Obesity,inflammation,and insulin resistance-a mini-review[J].Gerontol,2009,55(4):379-386.
