飞秒激光操控细胞的研究
2012-10-17冉玲苓石宏新尹志刚
冉玲苓,石宏新,尹志刚
(1.黑龙江大学 电子工程学院,哈尔滨 150080;2.黑龙江科技学院 理学院,哈尔滨 150027)
0 引 言
光镊是一种以激光的力学效应为基础的物理工具,是强会聚光场与微粒相互作用时形成的光学势阱。贝尔实验室的A.Ashkin在这一领域做出了开创性的工作。1970年,A.Ashkin首次在实验室中观察到激光的辐射力,成功地完成了激光悬浮微粒的实验[1],他提出了利用光压操纵微粒的思想,并建立了一套利用光压来操纵微粒的工具[2-3]。
光镊技术出现之后,A.Ashkin和J.Dziedzic分别对病毒和细菌进行了捕获和操控的实验[4-5],实验结果证明适当的激光功率对生物组织不会造成明显的损伤。随后,研究者们陆续利用光镊技术开展了细胞融合、硅球排列、细胞分离、测定马达蛋白作用力及运动步幅、克服分子马达引起的细胞旋转动力等多方面的工作[6]。这充分表明光镊技术是一项极具活力的新兴技术,它的出现为生命科学等多方面的发展提供了新的研究手段。
天津大学首先提出了飞秒激光光镊的概念,他们提出飞秒激光光镊与连续光光镊不同的是在飞秒光镊中作用在粒子上的光学梯度力是脉冲式[7];王清月领导的课题组以高重复率飞秒激光为光源对血红细胞、白细胞、聚苯乙烯微球、病毒等均实现了稳定捕获,并比较了飞秒激光与连续激光的捕获能力。他们对单细胞的操作和光动力学对癌细胞的诊断和治疗方面进行了研究,提出了光动力治疗法[8];圣德安鲁斯大学的研究小组采用单光束梯度力光阱对1.28μm的硅球进行了研究[9];M.Gu等人利用飞秒激光单光束梯度力光阱,测量了黄绿荧光10μm微球的双光子激发效应与形貌的依赖关系[10];韩国延世大学的研究小组分别使用飞秒激光光阱和连续激光单光束梯度力光阱对生物细胞进行了捕获和操纵,他们把随着粒子的减小捕获效率的差异不断增大这一现象归因于飞秒激光自聚焦效应[11-12]。
自A.Ashkin等人发明光镊后,光镊由于其非接触、无损伤操纵微纳米尺度粒子的特性而被广泛地应用于生命科学、医学、物理、材料等学科领域,被认为是最理想的单分子、单细胞、微粒等微纳器件的操控工具。飞秒激光是一种发展迅速的超短脉冲激光,相对于纳秒或皮秒激光脉冲,飞秒激光脉冲具有极短的脉冲宽度和极高的峰值功率,因此飞秒激光作为光镊的光源与生物组织相互作用时几乎不伤及周围区域,因而具有极高的空间分辨率。目前作者利用飞秒激光显微操作系统实现了对人体血红细胞、酵母细胞的稳定捕获。
1 实验部分
1.1 实验装置
飞秒激光光镊系统主要由飞秒激光光源、功率调节器、光束耦合器、显微镜主体、载物台与CCD图像显示系统几部分组成,基本的光路见图1。
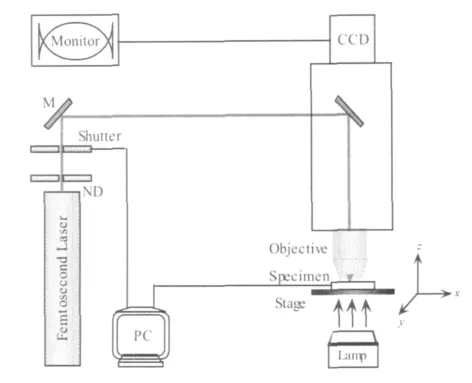
图1 飞秒光镊系统的基本光路图Fig.1 Basic beam path of femtosecond optical tweezers system
本文采用Ti:sapphire激光器作为飞秒激光光镊系统的光源,泵浦光中心波长为532nm,激光器输出的飞秒脉冲序列的中心波长为800nm,脉冲宽度为120fs,重复频率为76MHz。将光束严格调整引入显微镜后,经镜物聚焦后形成光学势阱。借助于显微镜配备的照明系统,可以对飞秒激光光镊的捕获过程进行实时地观察。高倍率大数值孔径的物镜可以实现强梯度光场,并且具有较高的放大倍率,便于清楚地观察光镊对物体的操纵过程。但大数值孔径同时也意味着工作距离短,尤其在笔者的实验中采用的是正置式显微镜,由于受此限制,待捕获样品必须置于特制的培养皿中,其厚度不得大于显微镜物镜的工作距离。本文通过衰减片可以对激光强度进行连续调节。飞秒激光脉冲通过显微镜的物镜聚焦到样品之前经过耦合光路使光与显微镜内置光路同轴并齐焦。显微镜的载物台放置在由3个线性激励源控制的XYZ三维移动平台上。激励源由计算机进行控制,同时通过CCD图像显示系统实时监控操作过程,并进行图像的采集。
1.2 实验方法与结果
开启照明灯,打开CCD摄像记录程序,调整照明光源的亮度,使CCD图像亮度适中,视场清晰。选用100×数值孔径为0.9的物镜聚焦激光束捕获酵母细胞,配合粗调和精调手轮缓慢调焦,在显示器视频窗口观察,使样品池中的样品图像清晰。调节样品台手柄控制样品台的移动,选择要捕获操作的区域。将光阱位置靠近待捕获的酵母细胞。
图2为横向捕获一个酵母细胞的记录过程。实线圆圈指示的是被捕获的酵母细胞,虚线圆圈指示为参考细胞。图2中箭头方向指示三维移动平台的移动方向,笔者观察到背景中的酵母细胞跟随平台移动,而被捕获的酵母细胞被光阱束缚而不动,即实现了飞秒光镊操控酵母细胞水平平移。同样笔者也进行了飞秒光镊操控酵母细胞竖直方向的平移运动以及斜线方向的运动。在图3中给出了竖直平移操控的记录图像。在捕获图像中可以看到,被捕获的酵母细胞的图像逐渐变虚,说明酵母细胞已离开成像的物平面,此时需要纵向调整焦距才可以重新看清样品。这是由于当激光功率过大时,产生的散射力推动样品向前运动而离开物平面。这也说明此数值孔径物镜聚焦激光束会聚角小,光强梯度小以至捕获的稳定性较差。
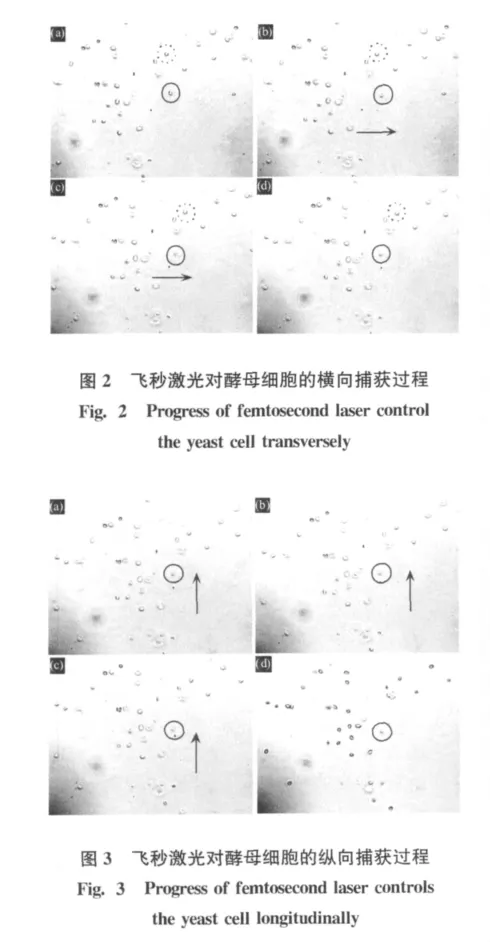
在飞秒光镊操控酵母细胞运动的过程中发现在酵母细胞相对背景移动的路径上如果遇到其它的酵母细胞有时会同时捕获多个酵母细胞,并同时随光阱移动;有时则会出现失去对原本捕获的酵母细胞而捕获移动路径上遇到的新的酵母细胞。发现轴向可以捕获多个细胞的现象是由于轴向会聚度不够高所致,其光阱在轴向上尺寸大于径向,垂直方向上可以容纳多个细胞。而对于交换捕获细胞的现象笔者分析是因为在移动过程中,移动路径上遇到的酵母细胞所处的轴向深度比原始被捕获的细胞对于光阱来说位置更佳,所以占据了被捕获的位置。
血红细胞呈双凹圆盘状 (碟状),直径约为7 μm,未经激光照射时,细胞自由悬浮于浓度为0.9%的生理盐水中,并作随机的布朗运动。操控记录见图4,图中用黑色圆圈指示待捕获细胞,箭头方向指示平台的移动方向。
飞秒激光光阱位置固定不变,通过计算机控制平台的移动,将待捕获细胞移向光阱位置,当细胞接近激光光斑约数μm时,细胞就快速的被吸引至光斑中心。受激光照射后细胞在光学力的作用下发生空间翻转,其碟面垂直于载物台,观察到被捕获的细胞变为长条哑铃形,见图4。继续以一定速度移动载物台,其它自由细胞随之移动,而被捕获的细胞在光学势阱的作用下静止不动,充分证明了血红细胞已经被飞秒激光脉冲稳定捕获。若停止飞秒激光的照射,被捕获细胞则快速恢复到初始的自由运动状态。
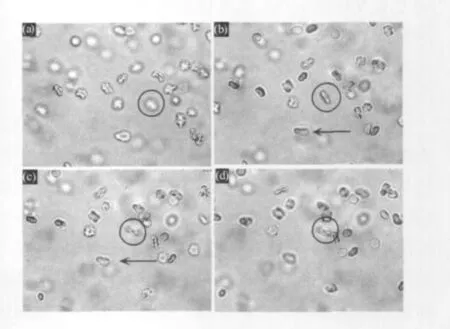
图4 飞秒激光对血红细胞的捕获过程Fig.4 Progress of femtosecond laser control the red blood cells
2 光镊捕获酵母细胞的能力
实验结果清楚的展现了飞秒光镊捕获酵母细胞的全过程。这里本文讨论飞秒光镊的捕获能力,一般通过比较Q值来衡量光镊的捕获能力,同时笔者也可以对其捕获对象所受的光阱力进行测量,以酵母细胞为捕获对象来进行光阱力的测量和Q值的计算。
2.1 酵母细胞所受光阱力的测量
在相对静止的液体环境中,用光来捕获一个酵母细胞,通过手动或计算机控制样品台,令被捕获细胞相对周围环境在平面上产生定向运动。光镊的一个较重要的功能就是微小力的测量。知道光阱力与位移的关系就可以测定外力的大小。因为光阱中的粒子偏离光阱中心时,粒子将受到一个指向光阱中心的光阱力,起到回复力的作用。当光阱中心的微粒受到其它外力时,微粒将偏离光阱中心,发生位移到一个新的位置,在新的位置处粒子受到的光阱力与外力平衡。光镊系统的阱力标定通常可以采用流体力学法、热运动分析法、功率谱法和外加周期驱动力法。在笔者的工作中使用最常用的实验方法流体力学法来测量飞秒光镊捕获酵母细胞的光阱力。流体力学的方法是以一定流速的稳恒流体中,粒子受到的流体对它的黏滞力为标准力,可以由流体力学中的Stokes公式给出:

其中η为黏滞系数;r为被捕获细胞的半径;¯v为流体相对微粒的速度。
根据此公式可以算出光镊的光阱力,细胞在光阱中受到的力与细胞偏离光阱中心的距离有关。
实验中,光镊系统中的光路调整后,液体相对微粒的运动是平台带动的。当微粒进入光阱后,开始手动令平台以较小的速度运动,若细胞仍在光镊的控制中即处于被捕获的状态,则可以通过计算机控制逐步加大平台的移动速度,这样不停地调整平台移动速度,直到平台的速度达到某种临界值,被捕获的细胞不再受光阱束缚,能够从光阱中逃逸出去,此时的平台移动速度即为细胞的逃逸速度。将这个速度值代入Stokes公式,即可求出光阱力的大小。
由于实验室设备的局限,只能测得细胞逃逸时的平均速度。考虑到平台启动时对细胞的加速影响较大,因此通过直接设定平台移动速度来测量逃逸速度的误差将比较大,所以采取手动的方法来测量逃逸速度。手动测量逃逸速度的方法使用CCD摄像机来跟踪采集一系列捕获过程,对采集到的影像文件进行分割处理,截取出细胞逃逸前后两帧连续的图像,测出逃逸前后细胞的位移再除以两帧图像的时间间隔,可以计算出逃逸速度。在具体的实验过程中,分别选用了不同的激光入射功率:30、40、50、60、80mW。为了尽量减小实验以及处理数据时带来的误差,分别对多组位置进行重复测量。表1中给出功率为30mW时的实验数据。
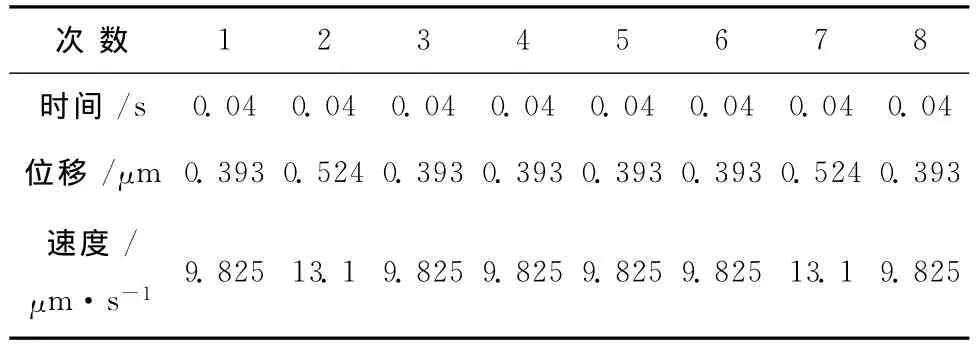
表1 酵母细胞0.04s时间内位移变化Table 1 Displacement of yeast cells in 0.04s
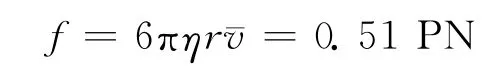
用统计方法求出速度平均值的标准偏差:
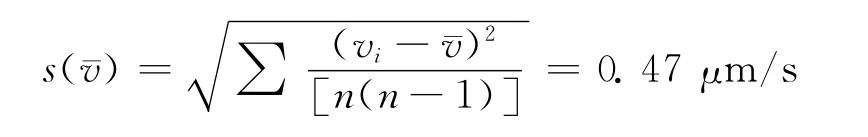
速度为:
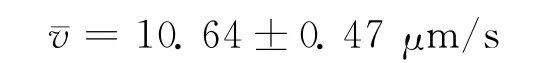
这里测量的随机误差较大,是实验误差的主要来源。在光阱力的测量中,最大速度应该是逃逸速度,即细胞挣脱光阱力的束缚一刹那的速度,这个速度为瞬时速度,在实验中是手动移动细胞,不可避免会出现非匀速的情况。使用CCD拍摄的影像记录通过软件进行截图后通过计算处理得到,其处理过程中多处步骤会导致误差的出现,因此计算结果只是一个粗略的近似值。
2.2 飞秒激光光镊捕获酵母细胞的Q值
Q值一般可由下式表示[9]:
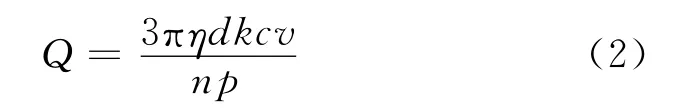
其中η为流体的黏滞系数;d为样品微粒的直径;k为深度影响因子[13],在本实验中,样品位于溶液的中部,k取值1;c为光速;v为逃逸速度;n为样品周围液体的折射率;p为照射到样品上激光的平均功率。
由式 (2)可见,在实验条件相同时,光镊的捕获能力取决于逃逸速度与平均功率的比值。在光阱力的研究中笔者已经测得不同飞秒激光平均功率下被捕获细胞的逃逸速度。这里给出实验获得的v~p关系见图5。由图5可见,随着入射激光功率的增加,细胞的逃逸速度随之不断增加。入射激光功率增大,激光作用于细胞的梯度力也随之增大,能够束缚细胞使之运动的速度也增大。但逃逸速度并不随入射激光功率的增大而线性增大,且斜率是逐渐减小的。根据式 (2)中各个量之间的关系可以得出Q值随着入射激光功率的增加将越来越小。由表1中的实验数据计算出了飞秒光镊的Q值,平均值为0.007。
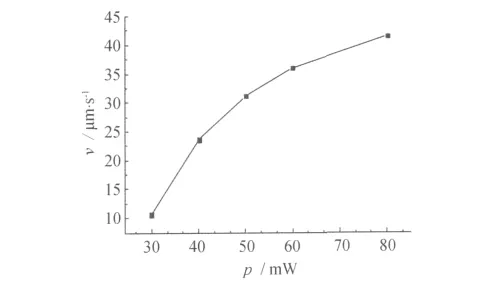
图5 逃逸速度和照射到酵母细胞上激光平均功率的关系图Fig.5 Escape speed versus the average power on the yeast cells
3 结 论
本文介绍了自行搭建的飞秒光镊系统的基本结构及各组成部件的功能。利用该系统分别对人体血红细胞和酵母细胞进行了捕获和操纵的实验,对实验结果进行了对比和定性分析。通过流体力学方法对酵母细胞所受到的光阱力进行了定量的测量并给出计算结果,所得到的光阱力大小在皮牛顿量级。
[1]ASHKIN A.Acceleration and trapping of particels by radiation pressure[J].Phys.Rev.Lett.1970,24(24):156-159.
[2]ASHKIN A,DZIEDZIC J M,BJORKHOLM J E,et al.Observation of a single beam gradient force optical trap for dielectric particle [J].Opt.Lett.1986,5(11):288-290.
[3]ASHKIN A.History of optical trapping and manipulation of small-neutral particle,atoms,and molecules[J].IEEE J.Sel.Top.Quant.2000,6:841-856.
[4]ASHKIN A,DZIEDZIC J M.Optical trapping and manipulation of viruses and bacteria[J].Science.1987,235:1 517-1 520.
[5]ASHKIN A,DZIEDZIC J M,YAMANE T.Optical trapping and manipulation of single cells using infrared laser beams[J].Nature.1987,330 (24):769-771.
[6]EROGLUu A E,VOLKAN M,ALTAMAN O Y.Fiber optic sensors using novel substrates for hydrogen sulfide determination by solid surface fluorescence[J].Talanta.2007,53 (1):89-101.
[7]毛方林.飞秒激光显微操作系统的研究 [D].天津:天津大学,2004.
[8]MAO F,XING Q,WANG K.Optical trapping of red blood cells and two-photon exciation-based photodynamic study using a femtosecond laser[J].Opt.Commun.2005,256:358-363.
[9]AGATE B,BROWN C,SIBBETT W,et al.Femtosecond optical tweezers for in-situ control of two-photon fluorencence [J].Opt.Express.2004,12 (13):3 011-3 017.
[10]MORRISH D,GAN X,GU M.Morphology-dependent resonance induced by two-photon excitation in a micro-sphere trapped by a femtosecond pulsed laser[J].Opt.Express.2004,12 (18):4 198-4 202.
[11]IM K,HAN S,PARK H,et al.Cell damage during femtosecond optical trapping[J].Proc.SPIE.2005,5 699:274-280.
[12]IM K B,JU S B,HAN S,et al.Trapping efficiency of femtosecond laser and damage thresholds for biological cells[J].J.Korean Phys.Soc.2006,48 (5):968-973.
[13]FELGNER H,MULLER O,SCHLIWA M.Calibration of light forces in optical tweezers[J].Appl.Opt.1995,34 (6):977-982.
