瑞香狼毒水提取物对人膀胱癌T24细胞Survivin表达的影响
2012-10-17李建文张雁钢
申 彦 李建文 张雁钢
1.山西医科大学,山西太原 030001;2.山西医学科学院山西大医院泌尿外科,山西太原 030001
膀胱肿瘤是泌尿系肿瘤中最常见的肿瘤,多数为移行上皮细胞癌,国外膀胱肿瘤的发病率在男性泌尿生殖器肿瘤中仅次于前列腺癌,居第2位,在国内则占首位。随着对生存素(Survivin)基因的研究深入,发现Survivin基因作为一种凋亡抑制基因在膀胱癌发生、发展过程中起着重要的作用,且与肿瘤的分级、分期密切相关。本研究应用中药瑞香狼毒水提取物作用于人膀胱癌T24细胞,探讨瑞香狼毒对膀胱癌T24细胞生物学行为的影响,以期为临床开辟新治疗途径提供理论依据。现将结果报道如下:
1 材料与方法
1.1 材料
1.1.1 来源 人膀胱癌T24细胞株由山西医科大学寄生虫实验中心提供。瑞香狼毒购自山西省医药公司,山西医科大学药物学院进行药物提取。
1.1.2 主要试剂 RPMI-1640为赛默飞世尔生物化学制品(北京)有限公司产品;胎牛血清为杭州四季青生物工程材料有限公司产;二甲基亚砜(DMSO)为天津市科密欧化学试剂开发中心产品;丝裂霉素为日本协和发酵工业株式会社富士工厂产品;兔抗人Survivin单克隆抗体(工作液)为中杉金桥公司产品。
1.1.3 主要设备 超净工作台,相差倒置显微镜,二氧化碳恒温培养箱,水浴箱,水平离心机,全自动ELX800酶联免疫分析仪,流式细胞仪。
1.2 方法
1.2.1 细胞培养 将膀胱癌T24细胞复苏后接种至培养瓶,加含有10%胎牛血清和双抗的RPMI-1640培养基5 mL瓶盖微松,放置37℃,5%CO2及饱和湿度的细胞培养箱中,每2~3天更换培养液,待细胞生长至贴满培养瓶壁时,用0.25%胰酶消化传代。
1.2.2 MTT法检测膀胱癌T24细胞抑制率 将细胞消化、计数,将其接种至96孔培养板中,每孔5×104个细胞,容积100 μL,置CO2培养箱中继续培养12 h细胞贴壁后,于96孔板中依次加入不同浓度的瑞香狼毒水提取物(0.04、0.2、1、5 g/mL)每一浓度设6个复孔,同时设一个空白组(仅加入100 μL RPMI-1640培养基)和对照组(未加药物的100 μL细胞悬液)。继续培养 12、24、48、72 h 后, 每孔加入 MTT 试剂 20 μL,置CO2培养箱中继续培养4 h后弃上清,每孔加二甲基亚砜100 μL置摇床上混匀,10 min后用酶标仪在490 nm发射波长下读OD数值,计算细胞抑制率。抑制率的计算:抑制率=(1-OD处理组/OD对照组)×100%。
1.2.3 细胞凋亡率的检测 将对数生长期的膀胱癌T24细胞消化、计数,种植于6孔板内,每孔1×106个细胞,容积3 mL。待12 h细胞附壁后加入不同浓度药物。实验分为对照组(未加药物的 100 μL 细胞悬液),药物组(0.04、0.2、1、5 g/mL)每组设5个复孔,作用48 h后收集细胞,Annexin V-FITC细胞凋亡检测试剂进行染色,流式细胞仪检测细胞凋亡率。
1.2.4 免疫细胞化学 取对数生长期膀胱癌T24细胞,消化、计数,种植于6孔板内,每孔1×105个细胞,容积3 mL。12 h细胞附壁后加药干预,实验分为对照组(未加药物的100 μL细胞悬液),药物组(0.04、0.2、1、5 g/mL)每组设 5 个复孔,作用48 h后进行免疫细胞化学染色,加入兔抗人Survivin单克隆抗体工作液,4℃温箱孵育过夜,次日滴加二抗(羊抗兔)、显色剂,封片后观察细胞Survivin蛋白的表达。实验以细胞胞浆或细胞核中出现棕黄色颗粒为阳性结果,在显微镜下拍照并行灰度值测定。
1.3 统计学方法
应用SPSS 17.0软件对数据进行单因素方差分析,多个样本均数间两两比较采用Bonferroni法检验,计量资料采用均数±标准差(±s)表示,以P<0.05为差异有统计学意义。
2 结果
2.1 MTT法检测结果
瑞香狼毒水提取物对膀胱癌T24细胞的生长抑制作用通过MTT法检测不同浓度药物分别处理12、24、48、72 h后,测各组细胞吸光度(表1)及抑制率(表2),结果显示瑞香狼毒水提取物对该细胞株有明显的生长抑制作用,浓度越高作用,时间越长,抑制作用越明显。
表1 不同浓度瑞香狼毒水提取物对膀胱癌T24细胞作用的OD值(±s)

表1 不同浓度瑞香狼毒水提取物对膀胱癌T24细胞作用的OD值(±s)
注:与对照组比较,★P<0.05;每个药物浓度组与前一药物浓度组比较,△P<0.05;每个时间段与前一时间段比较,○P<0.05
药物浓度(g/mL)OD值12 h 24 h 48 h 72 h对照组0.04 0.2 15 0.69±0.03 0.61±0.03★0.56±0.07★0.40±0.02★△0.32±0.05★△0.73±0.04 0.57±0.03★0.43±0.02★△○0.37±0.06★0.28±0.03★△0.76±0.04 0.53±0.05★0.38±0.03★△○0.30±0.05★△○0.22±0.05★△○0.82±0.04 0.46±0.05★○0.28±0.05★△○0.23±0.05★○0.15±0.02★△○
2.2 凋亡率检测结果
药物组(0.04、0.2、1、5 g/mL)分别作用于膀胱癌 T24 细胞 48 h 后,细胞凋亡率分别为(11.67±2.61)%、(22.40±3.18)%、(38.29±2.30)%、(57.57±3.77)%,各组与对照组凋亡率[(1.05±0.34)%]比较差异有统计学意义(P<0.05),高浓度组与低浓度组比较差异亦有统计学意义(P<0.05)。结果显示,随着药物浓度的增高,膀胱癌T24细胞的凋亡率增加。
表2 不同浓度瑞香狼毒水提取物对膀胱癌T24细胞增殖抑制率(±s,%)
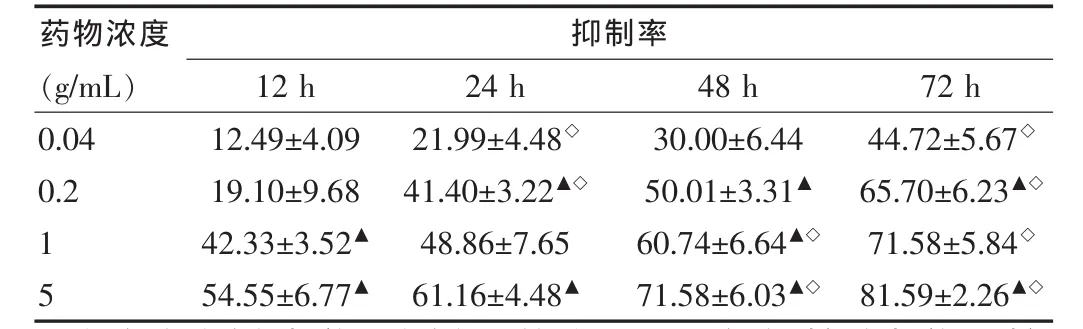
表2 不同浓度瑞香狼毒水提取物对膀胱癌T24细胞增殖抑制率(±s,%)
注:每个浓度组与前一浓度组比较,▲P<0.05;每个时间段与前一时间段比较,◇P<0.05
药物浓度(g/mL)抑制率12 h 24 h 48 h 72 h 0.04 0.2 15 12.49±4.09 19.10±9.68 42.33±3.52▲54.55±6.77▲21.99±4.48◇41.40±3.22▲◇48.86±7.65 61.16±4.48▲30.00±6.44 50.01±3.31▲60.74±6.64▲◇71.58±6.03▲◇44.72±5.67◇65.70±6.23▲◇71.58±5.84◇81.59±2.26▲◇
2.3 免疫细胞化学结果
药物组(0.04、0.2、1、5 g/mL)分别作用于膀胱癌 T24 细胞48 h后,经过免疫细胞化学染色、封片、显微镜下拍照后,测各组灰度值分别为(142.49±1.67)、(152.14±2.66)、(161.63±4.44)、(171.72±1.17),各组与对照组灰度值(130.84±4.99)比较,差异有统计学意义(P<0.05),高浓度组与低浓度组比较差异亦有统计学意义(P<0.05)。结果显示,瑞香狼毒水提取物作用于膀胱癌T24细胞后,下调细胞中Survivn蛋白表达,浓度越高,下调作用愈明显。
3 讨论
瑞香狼毒为瑞香科狼毒属植物,又名红狼毒、棉大戟、断肠草等,为中药狼毒之正品,有毒,用药部位为根,性味苦平,有逐水祛痰、破积杀虫之功效。现代药理学研究发现具有抗肿瘤、抗病毒、调节免疫等活性[1]。国外膀胱癌的发病率在男性泌尿生殖肿瘤中仅次于前列腺癌,在我国则占首位。目前,国内外采用综合治疗措施,药物治疗在其中发挥重要作用。国内外学者在瑞香狼毒对肺癌、肝癌、宫颈癌等恶性肿瘤的研究中取得一定成果[2-4],但对泌尿系统如膀胱癌细胞的抗肿瘤研究少有报道。Survivin是近年发现的细胞凋亡抑制因子,具有高度保守性和明显抵抗细胞凋亡的作用,参与调控细胞分裂、增殖等过程[5]。Survivin在除胸腺外正常组织中不表达,而在大部分肿瘤细胞中高表达[6]。Survivin基因作为一种凋亡抑制基因在膀胱癌发生、发展过程中起着重要的作用[7-8],其表达情况与肿瘤的分级、分期密切相关[9-10],可以作为膀胱癌早期诊断及判断预后的检查指标[11]。本实验研究选择人膀胱癌T24细胞株,给予膀胱癌T24细胞不同浓度瑞香狼毒处理后,观察细胞的抑制率、凋亡率以及Survivin蛋白表达的情况。结果显示:瑞香狼毒水提取物对膀胱癌T24细胞具有明显的抑制作用,具有浓度和时间依赖性。研究结果还发现瑞香狼毒水提取物促进膀胱癌T24细胞凋亡并下调Survivin蛋白的表达。
综上所述,瑞香狼毒水提取物可诱导膀胱癌细胞发生凋亡,抑制肿瘤细胞增殖,其作用机制可能与Survivin蛋白表达的下调有关。由于药物促使肿瘤细胞凋亡是通过多条途径共同作用的结果,因此需要进一步深入研究,为开辟膀胱癌临床治疗新途径提供理论依据。
[1]罗慧英,王爱勤.不同极性溶媒瑞香狼毒提取物的抗肿瘤活性比较[J].中国临床药理学与治疗学,2005,10(10):1140-1141.
[2]Yoshida M,Yokokura H,Hidaka H,et al.Mechanism of antitum or action of PKC activator,gnidimacrin[J].Int J Cancer,1998,77(2):243-252.
[3]冯威健,池川哲郎,吉田光二.瑞香狼毒提取物尼地吗啉的抗癌活性[J].中华肿瘤杂志,1995,17(1):24-29.
[4]Yoshida M,Feng WJ,Saijo N,et al.Antitum or activity of daphnanetype diterpene gnidimacrin isolated from Stellera chamaejasme L [J].Int J Cancer,1996,66(2):268-278.
[5]Ambrosini G,Adida C,Altieri DC.Anovel antiapoptosis gene,survivin,expressed in cancer and lymphoma[J].Nat Med,1997,3(8):917-921.
[6]Hoffman WH,Biade S,Zilfou JT,et al.Transcriptional repression of the anti-apoptotic survivin gene by wild type p53 [J].J Biol Chem,2002,277(5):3247-3257.
[7]Kitsukawa S,Aoyagi T,Noda K,et al.Quantitative analysis of survivin mRNA expression in bladder transitional cell carcinomas[J].Hinyokika Kiyo,2008,54(2):101-106.
[8]Kitamura H,Torigoe T,Honma I,et al.Expression and antigenicity of survivin,an inhibitor of apoptosis family member,in bladder cancer:implications for specific immunotherapy[J].Urology,2006,67(5):955-959.
[9]Karam JA,Lotan Y,Ashfaq R,et al.Survivin expression in patients with non-muscle invasive urothelial cell carcinoma of the bladder[J].Urology,2007,70(3):482-486.
[10]Swana HS,Grossman D,Anthony JN,et al.Tumor content of the anti apoptosis molecule survivin and recurrence of bladder cancer [J].N Engl J Med,1999,341(6):452-453.
[11]Schultz IJ,Kiemeney LA,Karthaus HF,et al.Survivin mRNA copy number in bladder washings predicts tumor recurrence in patients with superficial urothelial cell carcinomas [J].Clin Chem,2004,50(8):1425-1428.
