CA724、CEA、CA242、CA199肿瘤标志物联合检验在胃癌中的诊断价值
2012-10-17陈海燕
陈海燕
首都医科大学附属北京朝阳医院京西院区检验科,北京 100043
胃癌早期发现和早期诊断是早期治疗的基础,在诊断技术手段不断提高的今天,胃癌的早期诊断得到了有效的利用与推广,但是在诊断效果上还值得商榷[1]。我们知道,胃癌细胞产生的多种物质,能在胃液及其他组织中被检测到,形成胃癌的标志物[2]。20世纪80年代,专家利用杂交瘤技术获得了能识别肿瘤特异性大分子糖蛋白抗原(CA),并研制了单克隆抗体识别系统。基于此原因,本研究具体探讨CA724、CEA、CA242、CA199等多项血清肿瘤标志物在胃癌早期诊断中的应用价值,并与病理结果进行对照分析,现报道如下:
1 资料与方法
1.1 一般资料
随机收集2009年12月~2012年1月在我院接受手术治疗的60例胃癌患者(观察组)。所有患者都经过手术后石蜡病理切片诊断。其中,男33例,女27例;年龄最小18岁,最大77 岁,平均(42.5±5.8)岁;Ⅰ期 20 例,Ⅱ期 20 例,Ⅲ期 15例,Ⅳ期5例。随机选择在同期入院治疗的胃部良性病变患者60例(对照Ⅱ组),男35例,女25例;年龄最小17岁,最大74岁,平均(44.2±6.8)岁。同时选取同期体检的60例健康人员(对照Ⅰ组)。三组患者一般资料比较差异无统计学意义(P > 0.05),具有可比性。
1.2 标本采集与检测
收集三组人员清晨空腹静脉血3mL置于EP试管中,3000 r/min离心10 min后,收集血清。检测仪器为Roche公司生产的ELECSY 2010全自动电化学发光仪。CA724、CEA、CA199、CA242为Roche公司配套试剂。
1.3 结果判定
CA724、CEA、CA242、CA199 正常参考范围依次为 0~6 U/mL、0~5 g/L、0~12 U/mL、0~39 U/mL。
1.4 统计学方法
实验数据用SPSS 19.0程序进行统计学处理。计量资料采用均数±标准差(±s)表示,多组间的比较采用方差分析,两两间的比较采用LSD-t检验;计数资料采用百分率表示,计数资料采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 肿瘤标志物检测结果
经过观察,胃良性病变患者与健康体检者的CA724、CEA、CA242、CA199四项指标相比差异无统计学意义(P>0.05)。胃癌Ⅰ、Ⅱ期患者中 CA724、CEA、CA242、CA199 水平与明显高于对照Ⅰ、Ⅱ组(P<0.05),Ⅲ、Ⅳ期的CA724、CEA、CA242、CA199水平极其明显高于对照Ⅰ、Ⅱ组(P<0.01)。上述结果表明,CA724、CEA、CA242、CA199 的表达与肿瘤的临床分期状况有关。见表1。
表1 三组患者CA724、CEA、CA242、CA199的检测结果对比(±s)

表1 三组患者CA724、CEA、CA242、CA199的检测结果对比(±s)
注:与对照Ⅰ、Ⅱ组相比,*P<0.05,**P<0.01
组别 例数 CEA(g/L)CA199(U/mL)CA242(U/mL)CA724(U/mL)对照Ⅰ组对照Ⅱ组观察组Ⅰ期Ⅱ期Ⅲ期Ⅳ期60 60 60 20 20 15 5 1.81±0.14 1.90±0.52 32.16±1.36 30.46±1.85 4.22±0.19 4.26±0.31 3.68±0.52 3.56±1.21 3.82±0.52*6.89±1.71*12.52±1.08**16.62±10.11**47.21±0.58*52.15±1.36*110.56±5.24**180.36±16.22**20.26±1.00*28.36±1.36*46.39±2.36**66.59±14.25**12.03±0.57*15.69±0.05*36.59±0.85**100.26±21.25**
2.2 胃癌患者四项指标联合检测与单项检测阳性率比较
CA724、CEA、CA242、CA199 联合检测与单项检测阳性率比较见表2。结果表明联合检测胃癌Ⅰ、Ⅱ、Ⅲ患者的阳性率明显好于单项检测(P<0.05),不过对于胃癌Ⅳ期检测两组的阳性率相差不大(P>0.05)。见表2。
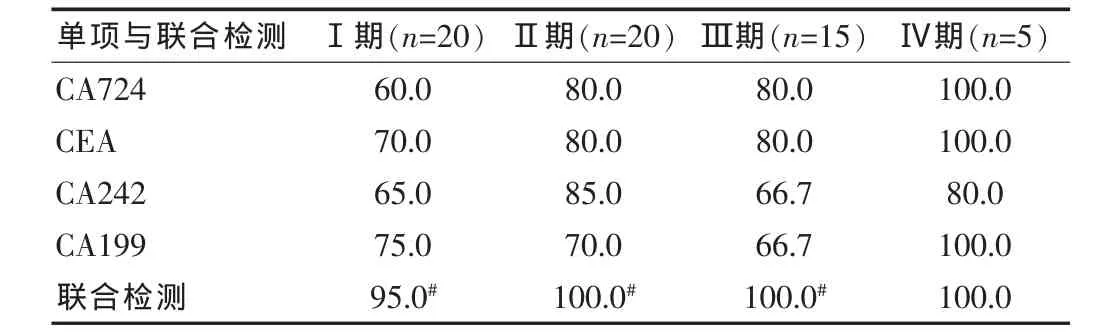
表2 胃癌患者单项检测与联合检测阳性率比较(%)
3 讨论
胃癌在我国的癌症发病率中处于所有癌症中的第四位,而在癌症的病死率中排列第二位。它是位于上皮细胞的恶性腺癌,胃癌的所有恶性肿瘤中,胃癌约占95%以上。而且当胃癌症状明显时,胃癌已属晚期,胃癌发病率男女比例为2∶1,男性发病高于女性。高发年龄为55~70岁。我国发病率在不同的地区发病率也有非常大的差异[3-4]。
除了判断风险和早期诊断外,做体外诊断,通过生物标志物还可针对个体基因不同实施区别对待个体化治疗、检测,并减少癌症治疗带来的副作用[5]。
CEA存在于胚胎胃肠黏膜上皮细胞与一些恶性肿瘤细胞外表,当前约有40%、70%的胃癌患者血清CEA水平高于正常值。CA199是一种高分子量糖蛋白[6],在多种腺癌中血清CA199水平升高[7]。其检测胃癌的阳性率约42.7%、50%,与CEA联合检测时阳性率达70%,能够增进胃癌判断的敏感性和特异性,可作为恶性肿瘤预后判定和疗效评估的指标[8]。CA242为一种黏蛋白,在正常胰腺、结肠黏膜中存在,但表达水平低[9]。CA724是高分子量的类黏蛋白分子,可用于判断及监测胃癌[10]。
本文结果显示,经过观察,胃癌Ⅰ、Ⅱ期患者中CA724、CEA、CA242、CA199水平与明显高于对照Ⅰ、Ⅱ组(P<0.05),Ⅲ、Ⅳ期的 CA724、CEA、CA242、CA199 水平极其明显高于对照Ⅰ、Ⅱ组(P<0.05)。许多研究报道,联合多个肿瘤标志物检测肿瘤能够提高肿瘤的检出率[11-12]。本次结果显示,联合检测 CA724、CEA、CA242、CA199 胃癌Ⅰ、Ⅱ、Ⅲ患者的阳性率明显好于各个单项检测(P<0.05),不过对于胃癌Ⅳ期检测两组的阳性率相差不大(P>0.05)。同时就一项研究表明,高分化型胃癌在术前易于不典型增生相混淆,胃癌特异分子标志物的免疫组化研究提供了良好病理学鉴别方法。研究人员选取16例良好分化型胃癌标本,以22例幽门螺杆菌阳性的慢性胃炎标本为对照,采用p53和Ki-67抗体进行免疫组化检测。结果发现,胃癌标本的p53标记指数和Ki-67阳性细胞定位与周围正常组织有明显区别,而对照的胃炎标本中无此发现,有助于高分化型胃癌的术前病理学诊断[12]。
总之,肿瘤标志物 CA724、CEA、CA242、CA199 的表达与肿瘤的临床分期状况有关,胃癌越晚期,肿瘤标志物阳性率越高,联合检测能提高诊断阳性率。
[1]Wang DR,Chen GY,Liu XL,et al.CD44v6 in p eripheral blood and bone narrow of patients with gastric cancer as micro metastasis[J].World J Gastroenterol,2006,12(1):36-42.
[2]赵洪川.早期胃癌的诊断和治疗进展[J].国外医学:消化系疾病分册,2000,25(3):131-133.
[3]司艺玲,韩为乐,赵亚力,等.反义hTERT对胃癌细胞SGC7901、VEGF极其受体表达的影响[J].解放军医学杂志,2011,30(12):1061.
[4]李继广,蔡庆岭,任更扑.胃癌患者血清CEA、CA19-9及CA72-4联检的临床价值探讨[J].放射免疫学杂志,2008,21(4):380-382.
[5]王轶.胃癌病程分期与血清CA724,CA242及CEA水平关系探讨[J].放射免疫学杂志,2006,19(3):225-226.
[6]李岩.血清胃癌肿瘤标志物的临床价值[J].胃肠病学杂志,2006,11(6):323.
[7]周光华,肖创清,何云南,等.胃癌患者CEA、CA19-9与CA7204联检的临床意义[J].放射免疫学杂志,2007,20(2):192-193.
[8]杨维良.进展期胃癌的治疗[J].中国普通外科杂志,2009,10(3):193-194.
[9]王靖,王成锋,赵平,等.早期胃癌的诊断与外科治疗[J].中国临床医生,2009,31(6):22-23.
[10]詹文华.进展期胃癌手术生活质量的评价[J].中华胃肠外科杂志,2010,4(2):74-76.
[11]Pectasides D,Myloanlakis A,Kostopouiou M,et al.CEA,CA199 and CA50 in monitoring gastric carcinoma [J].Am J Clin Oncol,1997,20(4):348.
[12]Duraker N,Celik AN.The prognostic significance of preoperarive serum CA 199 in patients with respectable gastric carcinoma comparison with CEA[J].J Surg Oncol,2011,76(4):266.
