类脂生物标志物重建近150年来东海陆架区DH5-1站位浮游植物生态结构及陆源输入的变化*
2012-10-16张海龙陈蔚芳扈治安赵美训
王 妃,邢 磊**,张海龙,张 婷,丁 玲,陈蔚芳,扈治安,赵美训
(1.中国海洋大学海洋化学理论与工程技术教育部重点实验室,山东 青岛266100;2.中国海洋大学海洋有机地球化学研究所,山东 青岛266100;3.台湾中央研究院地球科学研究所,台湾 台北)
陆架海被认为是生物生产力较高的区域,是陆地与海洋之间物质传送与转化的交界区[1]。东海作为西太平洋的边缘海,具有宽广的陆架,是世界上最大的陆架区之一,而且受到长江、钱塘江、闽江等河流的影响,人类活动会通过河流影响到海洋环境。对东海浮游植物生产力、群落结构及陆源输入演变的研究有助于揭示海洋生态环境对气候变化和人类活动的响应,了解生态环境演变的机制。
目前重建海洋生产力的方法主要有TOC[2]、蛋白石[3]等,但这些方法都存在一定的局限性。如:TOC不能区分陆源生产力和海源生产力[2];不饱和度、pH、温度、比表面积和Al/Si比值都能影响蛋白石的溶解[4-5]。估算群落结构的方法主要有细胞计数法和色素法[6-8],但是这2种方法主要是针对水体中的颗粒物,而不是沉积物,不适合长时间尺度的群落结构重建。大肠杆菌被广泛应用于指示生活污水污染[9],但是这种微生物方法在应用中有许多限制,如:细菌在样品分析前可能死亡或增殖;温度和盐度的变化会影响指示细菌的数量[10],此外,Mudge等人认为大肠杆菌不适合指示长期(长于1个月)的生活污水污染[11]。类脂生物标志物(生标)由于来源明确,在地质年代中保存较好,能用于古环境和古生态重建,特别是应用于长时间尺度的环境重建[3]。类脂生标是包括脂肪烃、多环芳烃、直链醇、甾醇、烯酮以及脂肪酸等在内的一系列特定的有机物,主要用于重建浮游植物生产力和群落结构以及指示陆源高等植物输入、人类污染以及工业排放等。已有不少研究者将类脂生标方法应用于东海,如:Sicre[12]等用水体颗粒物中的甾醇生标估算了长江口以及邻近区域水体中浮游植物群落结构;Xing[13]等分析了东海表层沉积物中C27+C29+C31长链烷烃、菜子甾醇、甲藻甾醇、C37∶2+ C37∶3烯酮的含量分布,从而获得了东海陆架区陆源高等植物输入和浮游植物生产力的空间变化趋势;Jeng[14]等分析了东海水体颗粒物、表层沉积物中脂肪烃、直链醇、甾醇的含量分布,了解了东海不同区域有机质的来源。鉴于前人主要是分析东海水体颗粒物以及表层沉积物中的类脂生标用于重建海洋环境,而长时间尺度的浮游植物生产力、群落结构、陆源输入的报道还很少,本文选择东海陆架区一个沉积物柱状样重建过去近150a来的浮游植物生产力和群落结构以及陆源物质输入变化,初步揭示气候变化和人类活动对海洋生态和环境的影响。文中选用生物标志物为:菜子甾醇指示硅藻,甲藻甾醇指示甲藻,长链烯酮(C37∶2+ C37∶3)指示颗石藻[15,3],胆甾醇指示浮游动物[16],粪醇指示人类生活污水污染[17],C27+ C29+ C31长链烷烃指示陆地高等植物输入[18]。
1 样品与方法
1.1 实验样品
东海柱状样 DH5-1(123.11°E,29.47°N,水深63.5m)于2010年6月通过国家基金委开放航次,科学三号调查船采用箱式采样器采集,插管获得,并于现场进行分样。此岩芯长36cm,间隔2cm取样,样品于-20℃保存。采样站位如图1所示。
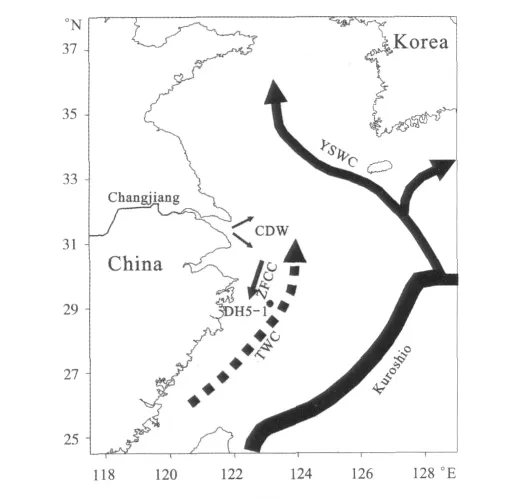
图1 东海采样站位图Fig.1 Sampling site of DH5-1from the East China Sea
1.2 210Pb定年、干密度测定及沉积通量计算
柱状 样 DH5-1 采 用210Pb 定 年,沉 积 速 率 约 为0.26cm·a-1,时间跨度141a。210Pb定年数据在台湾中央研究院地球科学研究所分析得到。用γ分析方法直接测量其中核素。分析仪器为美国ORTEC生产的高纯锗探测器(Ortec HPGe GEM/Lo-Ax/GMX)(陈蔚芳等,未发表数据)。210Pb的数据显示近150年来此站位的沉积速率稳定,为连续沉积的沉积环境。
本文对DH5-1的全部样品(共18个)进行了干密度(DBD)测定,范围为2.23~3.06g.cm-3。
各生标的沉积通量采用以下公式计算得到:MAR=LSR×DBD×C,其中,MAR表示沉积通量(ng·cm-2·a-1),LSR代表线性沉积速率(cm·a-1),DBD表示干密度(g·cm-3),C表示沉积物中某种生标的含量(ng·g-1)。
1.3 生物标志物分析
样品处理包括预处理和上机分析。样品预处理:将样品进行冷冻干燥、研磨,加入萃取剂二氯甲烷和甲醇(3∶1)以及内标(19醇和24氘烷),震荡、超声15min,萃取4次,萃取液经氮吹富集后加入6%KOH的甲醇溶液进行过夜水解,水解液用正己烷萃取4次后氮吹富集,然后过硅胶柱,用正己烷淋洗出含烷烃的非极性组分,二氯甲烷和甲醇(95∶5)淋洗出含甾醇和长链烯酮的中性组分,将淋洗出的2种组分进行氮吹富集,非极性组分加异辛烷定容待上机分析,中性组分加BSTFA和CH2Cl2衍生化(70℃,1h)后用于上机分析。仪器分析:所有样品进GC(Agilent 6890N)定量分析,由生标的峰面积与内标峰面积对比计算得到。GC条件:色谱柱为毛细管柱 HP-1(型号:Agilent 19091Z-433,30m×0.25mm×0.25μm),进样口温度:300℃,FID检测器温度:300℃,采用不分流进样,所用载气为氢气,流速1.3mL/min。对于粪醇、胆甾醇、二氢胆固醇、菜子甾醇、甲藻甾醇、烯酮以及C17~C36长链烷烃均有标准品,通过相同条件下样品与标准品的气相色谱保留时间对比来进行定性分析,对于24-亚甲基胆甾醇,做了气-质分析,通过碎片离子峰获得定性分析。图2为其中1个样品2种组分的气相色谱图。
2 结果与讨论
2.1 生物标志物通量及浮游植物生产力重建
图3为DH5-1站位生标含量(ng·g-1)以及其对应的 MAR值(ng·cm-2·a-1)在东海陆架区近150a来的记录。甲藻甾醇、菜子甾醇、C37∶2+ C37∶3长链烯酮、甲藻甾醇+菜子甾醇+C37∶2+C37∶3长链烯酮、24-亚甲基胆甾醇、胆甾醇(见图3A~F)含量变化趋势和相应的MAR变化趋势基本一致,说明此区域各种生标的含量受沉积速率的影响小。尽管此区域受陆源颗粒物冲淡作用有限,但为了更准确地重建古环境,本文采用各种生标的MAR值来重建过去近150a来东海陆架区的浮游植物生产力和群落结构以及陆源物质输入的变化。
图2 样品的气相色谱图Fig.2 GC spectrum of a sediment sample from DH5-1
在海源生标中,甲藻甾醇的MAR变化范围为93.6~766.5ng·cm-2·a-1,菜子甾醇的 MAR变化范围为67.1~435.5ng·cm-2·a-1,C37长链烯酮的 MAR变化范围为6.4~51.8ng·cm-2·a-1,24-亚甲基胆甾醇的 MAR变化范围为34~207.6ng·cm-2·a-1,胆甾醇的 MAR变化范围为84.4~1073.4ng·cm-2·a-1。甲藻甾醇由甲藻产生,可以指示甲藻[15,3]。菜子甾醇作为硅藻的生物标志物被广泛使用[3]。虽然在硅藻中24-亚甲基胆甾醇含量比菜子甾醇高很多且分布更广泛,更适合指示硅藻[19-20],但有研究指出24-亚甲基胆甾醇相对菜子甾醇更容易降解[21],因此选用菜子甾醇作为硅藻的指示物。C37长链烯酮由颗石藻产生,可以用于重建颗石藻生产力[3]。文中用菜子甾醇、甲藻甾醇、C37长链烯酮的总MAR来指示海源浮游植物生产力。胆甾醇用于指示浮游动物[16]。
图3中甲藻甾醇、菜子甾醇以及浮游植物生标(菜子甾醇+甲藻甾醇+C37长链烯酮)总MAR的变化趋势基本一致:1930年前是低值,1930年后开始递增,说明此站位浮游植物生产力从1930年开始增加。此外,氧化降解也会影响生标的MAR值。研究表明:甾醇以及长链烷烃等有机物在水体中发生沉降后在表层(0~2.5cm)降解比较快,而表层之下基本上已经完成快速降解过程,处于相
对稳定状态[22]。因此,表层样品中甾醇和长链烷烃MAR值比较高可能与表层有机质氧化降解程度低有关,受到了降解和输入的双重影响,而表层以下主要受输入的影响。全球有机碳的降解速率随时间变化也表明了有机质在表层发生指数型氧化降解,表层以下有机质处于相对稳定状态[23]。胆甾醇含量在过去80a来呈现上升趋势,一定程度上反映浮游动物的含量是增加的,与浮游植物生产力变化趋势一致,也间接反映了近80a来浮游植物生产力的提高。过去80a来浮游植物生产力的提高与营养盐的输入密切相关。该区域营养盐浓度的变化主要受河流输入和季风2个因素的影响。长江口外、杭州湾附近盐度低于31的区域被认为是受到长江冲淡水的影响,而DH5-1在丰水期位于长江冲淡水的影响范围内[24-25]。1950年后由于农业的发展,化肥的大量使用使长江冲淡水的DIN含量增加,导致了浮游植物生产力的迅速提高[26]。除了河流输送外,季风对颗粒物的输运也起着重要作用。近百年来增强的东亚冬季风加强了陆源物质向水体的输送[27],同时加强了水体的垂直混合,导致水体营养盐含量增加,生产力呈现上升趋势。
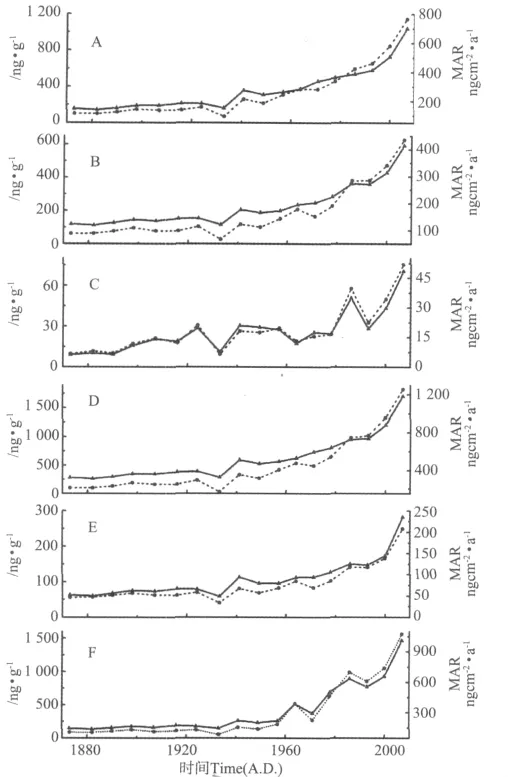
图3 生标的含量(实线,ng·g-1)和对应的沉积通量(虚线,ng·cm-2·a-1)Fig.3 Biomarker contents(solid lines,ng·g-1)and Mass Accumulation Rate(dashed lines,ng·cm-2·a-1)
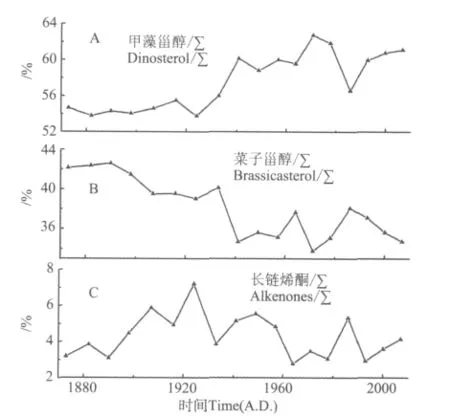
图4 岩芯DH5-1三种海源生标的相对比例变化Fig.4 The changes of the relative ratio of marine biomarkers in sediment core DH5-1
2.2 生物标志物比例变化及浮游植物群落结构变化的重建
图4是近150a来东海陆架区3种浮游植物生标相对比例的变化,可以看出,东海陆架区在过去近百年里浮游植物群落结构发生了很大的变化。由于菜子甾醇、甲藻甾醇、长链烯酮的细胞产生量还不清楚,因此这3种生标的相对比例并不能定量指示浮游植物群落结构,但是比例的变化可以反映群落结构的变化趋势。从图中可以看出过去近百年来尤其是1940年以来甲藻比例升高,硅藻比例降低,颗石藻处于低值范围波动。
许多研究表明,营养盐比值是决定浮游植物群落结构的最重要因素,N、P、Si间比值的变化会改变浮游植物群落结构[28-29]。在此研究区域,水体营养盐比值主要受长江冲淡水的影响。我国从二十世纪五六十年代大力发展农业、建坝和大量使用化肥以及城市污水的排放使长江冲淡水的Si/N减少[26],特别是三峡大坝的投入使用使大量颗粒物被大坝截留,Si入海通量减少。调查结果表明,仅1998—2004年期间,由于大坝作用使Si/N 从1.5降到0.4[24-25]。硅藻在高营养盐尤其是高硅环境下有竞争优势[30]。上述人类活动的影响,使Si/N减小,不利于硅藻生长,从而使硅藻比例降低,甲藻比例升高。1958年来的历次调查结果也显示长江口及邻近海域硅藻/甲藻比例降低[31]。颗石藻相对硅藻和甲藻比例低,且呈现波动变化,与硅藻和甲藻的变化趋势不同。温度和盐度是颗石藻分布的主要影响因素,研究表明高温高盐环境有利于颗石藻生长[32]。研究区域由于受高温高盐的台湾暖流影响有限而导致颗石藻比例较低,而且颗石藻生长受营养盐组成影响较小,因此颗石藻的变化呈现出与硅藻和甲藻不同的变化趋势。
2.3 陆源输入变化的重建
粪醇由哺乳动物肠道内的细菌还原胆固醇而形成[17],被 广 泛 用 于 指 示 生 活 污 水 污 染[17,33-34]。 粪 醇 的MAR变化范围为9.3~21ng·cm-2·a-1,含量很低。鉴于粪醇在有氧条件下容易降解,Grimalt等人[35]提出另一生活污水污染指标——粪醇/(粪醇+二氢胆固醇),比值大于0.7说明受污染,小于0.3说明未受污染,这一指标能消除粒度的影响,指示意义更明确。岩芯DH5-1所有样品的粪醇/(粪醇+二氢胆固醇)比值均小于0.3(见图5B),说明近150a来此区域基本未受生活污水污染。由于研究区域离城市的海岸、排污口、河口较远,粪醇在输送过程中受到陆源物质冲淡稀释作用及降解的影响,所以未对研究区域造成污染,粪醇含量以及粪醇/(粪醇+二氢胆固醇)比值也就未表现出随着农业的增长、人口的增加而呈现上升的趋势。
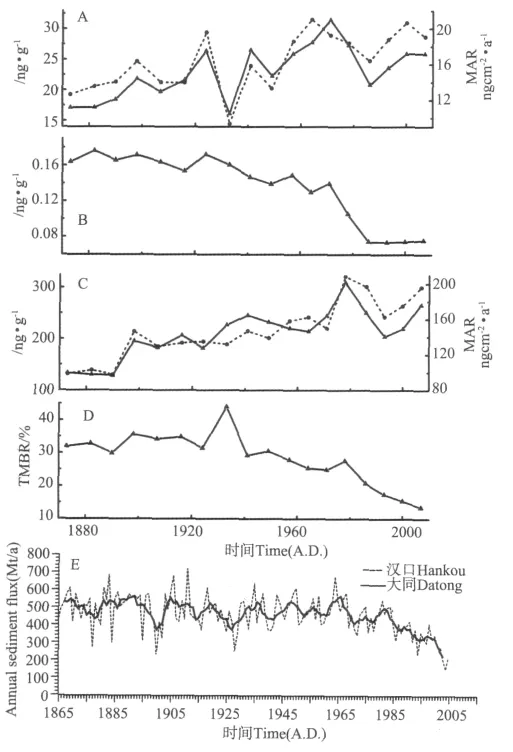
图5 A、C实线为生标的含量 (ng·g-1),虚线为对应的沉积通量 (ng·cm-2·yr-1)Fig.5 Solid lines of A and C indicate biomarker contents(ng·g-1),dashed lines indicate Mass Accumulation Rate(ng·cm-2·yr-1)
陆源生标C27+C29+C31长链烷烃的MAR变化范围为97.5~208.5ng·cm-2·a-1。长链正构烷烃来源于高等植物叶片的蜡质,具有奇碳数优势,尤其以C27、C29、C31正构烷烃含量最丰富,然而大型水生植物、细菌、石油也能产生长链正构烷烃,但是不具有奇偶优势[18,36,20,37]。利 用 碳 优 势 指 数 公 式:CPI25-33=1/2[(ΣC25+C27+C29+C31+C33)/(ΣC24+C26+C28+C30+C32)+(ΣC25+C27+C29+C31+C33)/(ΣC26+C28+C30+C32+C34)][38]得到DH5-1样品的CPI25-33范围为2.4~3.4,有很强的奇碳数优势,可以忽略细菌和石油污染的影响。综合上述因素,采用C27+C29+C31长链烷烃的总MAR来指示陆源高等植物输入。
虽然长链烷烃C27+C29+C31与粪醇一样,都来源于陆源输入,但是其MAR变化趋势与粪醇的MAR变化趋势不同(见图5A和5C)。粪醇处于低值范围波动,而长链烷烃呈现上升趋势,1970年后C27+C29+C31长链烷烃的MAR降低。2种陆源指标的不同变化主要与二者来源不同有关。粪醇主要来源于人类生活污水,而长链正构烷烃C27+C29+C31主要来源于陆源高等植物[17-18]。为显示陆源有机质比例的变化,作者用陆源指标 TMBR(Terrestrial and Marine Biomarker Ratio,TMBR=(C27+C29+C31长链烷烃)/[(C27+C29+C31长链烷烃)+菜子甾醇+甲藻甾醇+长链烯酮])表示陆海有机质比例,此指标消除了粒度的影响,能更好地指示陆源有机质相对输入,从TMBR的变化趋势来看近150a来陆源输入相对海源的比例在减少。Wang[39]等通过计算长时间尺度的长江入海沉积物通量发现,1968年开始由于建坝使长江入海沉积物通量呈降低趋势(见图5E)。水利设施的兴建可能是导致这一区域近40a来陆源有机质比例减小的原因。
3 结论
(1)生标记录显示东海浮游植物生产力从1930年开始呈增加趋势,与人类活动的增加和近百年来增强的东亚冬季风有关,而表层生标的高含量可能与氧化降解程度低有关。
(2)东海陆架区近百年来尤其是1940年以来浮游植物群落结构发生了明显变化,甲藻比例升高,硅藻比例降低,颗石藻比例处于低值范围波动。人类活动引起的长江冲淡水Si/N的降低是影响此区域浮游植物群落结构的主要因素。
(3)生活污水污染指标粪醇含量和粪醇/(粪醇+二氢胆固醇)比值的值都比较低,表明了研究区域近150a来基本未受人类生活污水污染。陆源指标TMBR指示近150a来输入的陆源有机质比例呈减少的趋势。
致谢:感谢国家基金委东海(长江口)海洋科学共享航次提供所需样品。
[1] Furuya K,Hayashi M,Yabushita Y,et al.Phytoplankton dynamics in the East China Sea in spring and summer as revealed by HPLC-derived pigment signatures[J].Deep Sea Research Part II:Topical Studies in Oceanography,2003,50(2):367-387.
[2] Werne J P,Hollander D J,Lyons T W,et al.Climate-Induced variations in productivity and planktonic ecosystem structure from the Younger Dryas to Holocene in the Cariaco Basin,Venezuela[J].Paleoceanography,2000,15(1):19-29.
[3] Schubert C J,Villanueva J,Calvert S E,et al.Stable phytoplankton community structure in the Arabian Sea over the past 200,000 years[J].Nature,1998,394(6693):563.
[4] Ragueneau O,Tréguer P,Leynaert A,et al.A review of the Si cycle in the modern ocean:recent progress and missing gaps in the application of biogenic opal as a paleoproductivity proxy [J].Global and Planetary Change,2000,26(4):317-365.
[5] Van Cappellen P,Dixit S,van Beusekom J.Biogenic silica dissolution in the oceans:Reconciling experimental and field-based dissolution rates[J].Global Biogeochem.Cycles,2002,16(4):1075.
[6] Parab S G,Prabhu Matondkar S G,Gomes H d R,et al.Monsoon driven changes in phytoplankton populations in the eastern Arabian Sea as revealed by microscopy and HPLC pigment analysis[J].Continental Shelf Research,2006,26(20):2538-2558.
[7] Sherrard N J,Nimmo M,Llewellyn C A.Combining HPLC pigment markers and ecological similarity indices to assess phytoplankton community structure:An environmental tool for eutrophication?[J].Science of the Total Environment,2006,361(1-3):97-110.
[8] Silva A,Mendes C R,Palma S,et al.Short-time scale variation of phytoplankton succession in Lisbon bay(Portugal)as revealed by microscopy cell counts and HPLC pigment analysis[J].Estuarine,Coastal and Shelf Science,2008,79(2):230-238.
[9] Solecki O,Jeanneau L,JardéE,et al.Persistence of microbial and chemical pig manure markers as compared to faecal indicator bacteria survival in freshwater and seawater microcosms[J].Water Research,2011,45(15):4623-4633.
[10] 崔崇威,张月红.水体受粪便污染的分子示踪物(粪醇)的研究[J].哈尔滨工业大学学报,2004,36(9):1187-1190.
[11] Mudge S,Lintern D G.Comparison of sterol biomarkers for sewage with other measures in Victoria Harbour,BC,Canada[J].Estuarine,Coastal and Shelf Science,1999,48(1):27-38.
[12] Sicre M A,Tian R C,Saliot A.Distribution of sterols in the suspended particles of the Chang Jiang Estuary and adjacent East China Sea[J].Organic Geochemistry,1994,21(1):1-10.
[13] Xing L,Zhang H,Yuan Z,et al.Terrestrial and marine biomarker estimates of organic matter sources and distributions in surface sediments from the East China Sea shelf[J].Continental Shelf Research,2011,31(10):1106-1115.
[14] Jeng W L,Huh C-A.Lipids in suspended matter and sediments from the East China Sea Shelf[J].Organic Geochemistry,2004,35(5):647-660.
[15] Robinson N,Eglinton G,Brassell S C,et al.Dinoflagellate origin for sedimentary 4α-methylsteroids and 5α(H)-stanols [J].Nature,1984,308(5958):439-442.
[16] Volkman J K,Farrington J W,Gagosian R B.Marine and terrigenous lipids in coastal sediments from the Peru upwelling region at 15°S:Sterols and triterpene alcohols[J].Organic Geochemistry,1987,11(6):463-477.
[17] Bethell P H,Goad L J,Evershed R P,et al.The study of molecular markers of human activity:The use of coprostanol in the soil as an indicator of human faecal material[J].Journal of Archaeological Science,1994,21(5):619-632.
[18] Eglinton G,Hamilton R J.Leaf epicuticular waxes[J].Science,1967,156(3780):1322-1335.
[19] Rampen S W,Abbas B A,Schouten S,et al.A comprehensive study of sterols in marine diatoms(Bacillariophyta):Implications for their use as tracers for diatom productivity [J].Limnol Oceanogr,2010,55(1):91-105.
[20] Volkman J K,Barrett S M,Blackburn S I,et al.Microalgal biomarkers:A review of recent research developments[J].Organic Geochemistry,1998,29(5-7):1163-1179.
[21] Fernandes M B,Sicre M A,Cardoso J N,et al.Sedimentary 4-desmethyl sterols and n-alkanols in an eutrophic urban estuary,Capibaribe River,Brazil[J].The Science of The Total Environment,1999,231(1):1-16.
[22] Canuel E A,Martens C S.Reactivity of recently deposited organic matter:Degradation of lipid compounds near the sediment-water interface[J].Geochimica et Cosmochimica Acta,1996,60(10):1793-1806.
[23] Middelburg J J.A simple rate model for organic matter decomposition in marine sediments[J].Geochimica et Cosmochimica Acta,1989,53(7):1577-1581.
[24] Gong G C,Chang J,Chiang K P,et al.Reduction of primary production and changing of nutrient ratio in the East China Sea:Effect of the Three Gorges Dam [J].Geophys Res Lett,2006,33(7):1-4.
[25] Tsai A Y,Gong G C,Sanders R W,et al.The impact of the Changjiang River plume extension on the nanoflagellate community in the East China Sea[J].Estuarine,Coastal and Shelf Science,2010,89(1):21-30.
[26] Wang B.Cultural eutrophication in the Changjiang(Yangtze River)plume:History and perspective[J].Estuarine,Coastal and Shelf Science,2006,69(3-4):471-477.
[27] 徐建军,朱乾根,周铁汉.近百年东亚冬季风的突变性和周期性[J].应用气象学报,1999,10(1):1-8.
[28] Hodgkiss I,Ho K.Are changes in N:P ratios in coastal waters the key to increased red tide blooms?[J].Hydrobiologia,1997,352(1):141-147.
[29] Justi D,Rabalais N N,Turner R E.Stoichiometric nutrient balance and origin of coastal eutrophication [J].Marine Pollution Bulletin,1995,30(1):41-46.
[30] Falkowski P G,Oliver M J.Mix and match:how climate selects phytoplankton[J].Nat Rev Micro,2007,5(10):813-819.
[31] 谢文玲.东海典型海域浮游硅藻群落结构与动态研究 [D].厦门:厦门大学,2006.
[32] King R,Schramm W.Calcification in the maerl coralline alga Phymatolithon calcareum:Effects of salinity and temperature[J].Marine Biology,1982,70(2):197-204.
[33] Pratt C,Warnken J,Leeming R,et al.Degradation and responses of coprostanol and selected sterol biomarkers in sediments to a simulated major sewage pollution event:A microcosm experiment under sub-tropical estuarine conditions[J].Organic Geochemistry,2008,39(3):353-369.
[34] 张龙军,宫萍,张向上.河口有机碳研究综述 [J].中国海洋大学学报:自然科学版,2005,35(5):737-744,842.
[35] Grimalt J O,Fernandez P,Bayona J M,et al.Assessment of fecal sterols and ketones as indicators of urban sewage inputs to coastal waters[J].Environmental Science & Technology,1990,24(3):357-363.
[36] Silliman J E,Schelske C L.Saturated hydrocarbons in the sediments of Lake Apopka,Florida [J].Organic Geochemistry,2003,34(2):253-260.
[37] 朱纯,潘建明,卢冰,等.长江、老黄河口及东海陆架沉积有机质物源指标及有机碳的沉积环境 [J].海洋学研究,2005,23(3):36-46.
[38] Ortiz J E,Gallego J L R,Torres T,et al.Palaeoenvironmental reconstruction of Northern Spain during the last 8000cal yr BP based on the biomarker content of the Ro?anzas peat bog(Asturias)[J].Organic Geochemistry,2010,41(5):454-466.
[39] Wang H,Yang Z,Wang Y,et al.Reconstruction of sediment flux from the Changjiang (Yangtze River)to the sea since the 1860s[J].Journal of Hydrology,2008,349(3-4):318-332.
