川芎嗪对肝纤维化大鼠肝细胞线粒体脂质过氧化的保护作用
2012-10-15李学农福建医科大学省立临床学院福建省立医院药学部福建福州350001
李学农福建医科大学省立临床学院/福建省立医院药学部,福建 福州 350001
脂质过氧化损伤是肝纤维化形成的重要病理因素,可以通过影响胶原代谢导致肝纤维化的形成。线粒体是细胞进行生物氧化和能量转换的主要场所,在氧化磷酸化的过程中可产生一定量的自由基,当体内抗氧化体系受到破坏时,线粒体就会因脂质过氧化作用而受到损伤[1]。因此,保护线粒体功能的稳定是抗肝纤维化治疗的一个潜在的靶点。川芎嗪是从中药川芎中分离提取的有效成分。大量研究证明,川芎嗪具有抗脂质过氧化、抗炎、清除自由基以及改善血液流变学等多方面的药理作用,其体内外实验均证实川芎嗪具有确切的预防和治疗肝纤维化的作用[2-5]。本研究建立在前期研究的基础上,通过观察川芎嗪对肝细胞线粒体的保护作用,进一步完善川芎嗪抗肝纤维化的机制。
1 材料
1.1 动物
清洁级SD大鼠40只,雄性,体重200±20g,由上海斯莱克公司提供,许可证号:SCXK(沪)2007-0005),标准饲料,高压灭菌垫料和饮水,适应性饲养1星期。
1.2 药物与试剂
四氯化碳为国产分析纯、橄榄油 (山东鲁花集团有限公司);盐酸川芎嗪 (山东潍坊制药厂有限公司);DPH(sigma);碱性磷酸酶 (ALP)、谷丙转氨酶 (ALT)、谷草转氨酶 (AST)半自动生化仪专用试剂盒、丙二醛(MDA)、超氧化物歧化酶 (SOD)、Na-K-ATP酶及、Ca2+-ATP酶试剂盒(南京建成生物工程研究所)。
2 方法
2.1 大鼠肝纤维化模型的建立
将40只大鼠适应性饲养1周后,随机分成5组,即正常组、模型组、川芎嗪低、中、高剂量组,每组8只。将CCl4配成50%橄榄油剂,模型组及给药组大鼠按1 ml/kg体重每周腹腔注射3次,同时正常组腹腔注射同体积的生理盐水,持续8周。自造模之日起,第3周开始用药组每周6次以川芎嗪低 (20mg/kg)、中 (40mg/kg)、高(60mg/kg)灌胃给药,正常及模型组灌胃同体积的蒸馏水。
2.2 肝功能指标ALT、AST、ALP的测定
末次给药后,将各组大鼠麻醉后颈总动脉取血,离心后分离血清,生化仪检测大鼠谷草转氨酶 (ALP)、谷丙转氨酶 (ALT)、碱性磷酸酶 (AST)的含量。
2.3 肝细胞线粒体的制备[6]
处死动物,迅速剖取肝脏,取一小块肝组织,称重后立即加入一定量的预冷生理盐水,冰浴匀浆,10 s/次,间歇30 S,连续2~3次,然后定容,制成10%肝匀浆,3 000×g 4℃冷冻离心10 min,弃沉淀取上清液以12000×g 4℃冷冻离心15 min,沉淀物即为线粒体,于-20℃冷冻过夜,融化后进行以下操作。
2.4 肝细胞线粒体内 MDA、SOD、Na-K+-ATP酶及Ca2+-ATP酶测定
收集的肝线粒体采用超声波法裂解,裂解后线粒体均用Bradford法测定蛋白含量。丙二醛 (MDA)采用硫代巴比妥酸 (TBA)法,超氧化物歧化酶 (SOD)采用羟胺法,Na-K+-ATP酶及Ca2+-ATP酶采用比色法,均按照试剂盒说明书进行操作。
2.5 肝细胞线粒体膜的流动性测定
采用荧光标记与荧光偏振法[7]。取线粒体3 ml,加入等体积DPH荧光探针液,混匀放25℃温育30 min,再离心经PBS洗涤1次,注入测试管。应用荧光分光光度计,在激发波长360nm,发射波长430nm测定膜荧光强度。膜脂流动性用荧光偏振度P、微粘度η表示,测量并记录样本的4个荧光强度。即 IVV、IVH、IHV、IHH,以 G(IHV/IHH)为校正因子。先按公式P=(IVV-GIVH)/(IVV+GIVH)计算出荧光偏振度P,再按公式η=2P/(0.46-P)计算出微粘度η。平均微粘度η越高,说明线粒体膜流动性越低,线粒体损伤越严重。
2.6 统计学分析
使用SPSS12.0统计软件进行数据分析,数据以均数±标准差 (±SD)表示,组间采用t检验,P<0.05具有统计学意义。
3 结果
3.1 肝纤维化大鼠造模结果
32只大鼠经造模后给药后,存活率为87.5%。其中,第2周死亡1例,第3周死亡1例,第6周死亡2例。死亡大鼠尸检可见腹腔内弥漫性化脓性炎症,肝脏颜色晦暗,肝组织上附着大量白斑及胶原状物质,组织学观察见肝组织广泛大面积坏死并伴有中性粒细胞浸润。
3.2 川芎嗪对大鼠肝功能指标ALT、AST、ALP的影响
结果显示,与正常对照组相比,模型组大鼠血清ALT、AST、ALP水平显著升高,具有极显著差异 (P<0.01)。而川芎嗪治疗后,大鼠各项血清指标均降低,且在川芎嗪高剂量组时,与模型组相比,各项指标均具有显著性差异(P <0.05)。见表1。
表1 川芎嗪对大鼠肝功能指标ALT、AST、ALP的影响 (SD)
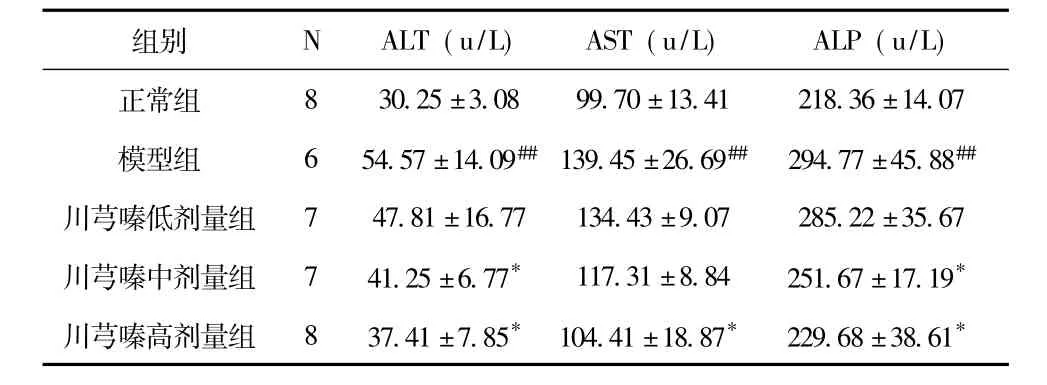
表1 川芎嗪对大鼠肝功能指标ALT、AST、ALP的影响 (SD)
注:与正常对照组比较,#P<0.05,##P<0.01;与模型组比较,* P<0.05,** P <0.01
组别 N ALT(u/L) AST(u/L) ALP(u/L)8 30.25 ±3.08 99.70 ±13.41 218.36 ±14.07模型组 6 54.57 ±14.09##139.45 ±26.69## 294.77 ±45.88##川芎嗪低剂量组 7 47.81 ±16.77 134.43 ±9.07 285.22 ±35.67川芎嗪中剂量组 7 41.25 ±6.77* 117.31 ±8.84 251.67 ±17.19*川芎嗪高剂量组 8 37.41 ±7.85* 104.41 ±18.87* 229.68 ±38.61正常组*
3.3 川芎嗪对肝细胞线粒体内MDA、SOD、Na-K+-ATP酶及Ca2+-ATP酶的影响
结果显示,与正常对照组相比,模型组的SOD、Na-K+-ATP酶及Ca2+-ATP酶的含量显著降低,MDA的含量显著升高,具有极显著性的差异 (P<0.01)。而川芎嗪治疗组能够显著的升高SOD、Na-K+-ATP酶及 Ca2+-ATP酶的含量,并且有效降低MDA的含量,与模型组相比,具有统计学意义。见表2。
表2 川芎嗪对肝线粒体内MDA、SOD、Na-K+-ATP酶及Ca2+-ATP酶的影响 (±SD)
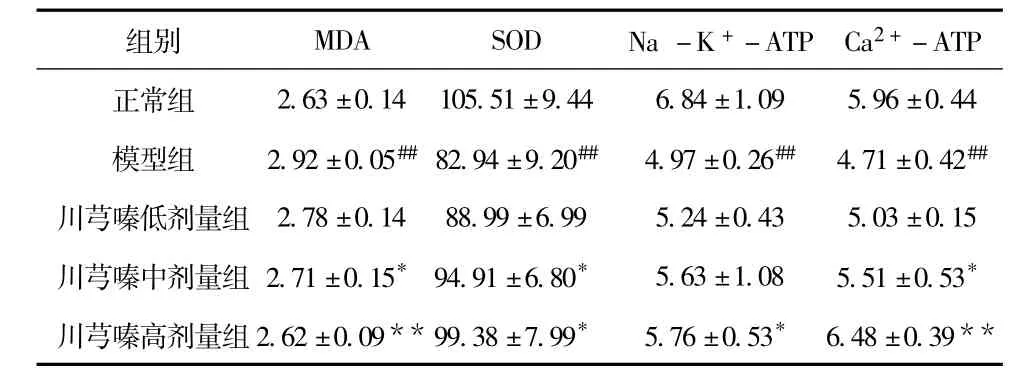
表2 川芎嗪对肝线粒体内MDA、SOD、Na-K+-ATP酶及Ca2+-ATP酶的影响 (±SD)
注:与正常对照组比较,#P<0.05,##P<0.01;与模型组比较,* P<0.05,** P <0.01
2.63 ±0.14 105.51 ±9.44 6.84 ±1.09 5.96 ±0.44模型组 2.92 ±0.05##82.94 ±9.20## 4.97 ±0.26## 4.71 ±0.42##川芎嗪低剂量组 2.78 ±0.14 88.99 ±6.99 5.24 ±0.43 5.03 ±0.15川芎嗪中剂量组 2.71 ±0.15* 94.91 ±6.80* 5.63 ±1.08 5.51 ±0.53*川芎嗪高剂量组2.62 ±0.09**99.38 ±7.99* 5.76 ±0.53* 6.48 ±0.39-ATP正常组组别 MDA SOD Na-K+-ATP Ca2+**
3.4 川芎嗪对肝细胞线粒体膜流动性的影响

图1 川芎嗪对肝线粒体膜流动性的影响
结果显示,与正常对照比相比,模型组的线粒题膜微黏度显著升高 (P<0.01),而经过川芎嗪治疗的大鼠的线粒体膜微黏度明显降低,具有剂量依赖性。与模型组比较,川芎嗪高剂量组具有显著性差异 (P<0.05),说明川芎嗪可以显著提高肝纤维化大鼠线粒体膜的流动性。见图1。
4 讨论
肝纤维化 (Hepatic Fibrosis)是肝细胞损伤后的修复机制,是多种慢性肝病发展到肝硬化的必由之路。研究表明,肝损伤导致体内自由基增多,引起肝脏脂质过氧化参与肝纤维化的发生发展过程。CCl4为亲肝性毒物,能够导致体内自由基增加,引起脂质过氧化,故本研究采用CCl4制作动物肝纤维化模型。其结果显示 CCl4模型血清中ALT、AST、ALP的含量明显高于正常组,而川芎嗪可以有效的减少以上各项指标。为了探讨其抗肝纤维化的具体的机制,我们分离了肝细胞线粒体进行以下研究。
脂质过氧化反应在体内胶原基因表达的调节中起主导作用,它是连结组织损伤与纤维化两个过程的纽带[8]。线粒体是细胞能量的主要来源,与氧自由基的产生、细胞死亡进程的调控有关。许多毒物可以通过脂质过氧化作用对线粒体膜、膜蛋白及线粒体DNA造成损伤。SOD是细胞内天然的氧自由基清除剂,而MDA则是氧自由基与细胞膜表面不饱和脂肪酸反应的产物,因此MDA与SOD构成了一对反应组织脂质过氧化和抗脂质过氧化的特征指标。本研究结果显示,肝纤维化大鼠线粒体中的MDA含量明显升高,SOD的活性显著降低,而川芎嗪给药组可以有效的逆转以上各项指标。Na-K+-ATP酶及 Ca2+-ATP酶是生物体内广泛存在的一种极为重要的膜酶,二者对维持线粒体膜的正常功能具有十分重要的作用。本实验结果显示,肝纤维化大鼠的肝细胞线粒体中Na-K+-ATP酶及 Ca2+-ATP酶的活性明显降低,在脂质过氧化反应增强,抗自由基损伤的作用减弱,其线粒体膜的微黏度升高,线粒体损伤严重。而川芎嗪可以可减轻肝纤维化过程中脂质过氧化和自由基损伤,恢复Na-K+-ATP酶及Ca2+-ATP酶的活性,增加线粒体膜的流动性,保护线粒体的脂质过氧化作用,从而逆转肝纤维化的进程。
[1]孙卫,郑学芝,李丽等.葛根素对糖尿病大鼠胰腺线粒体氧化应激及ATP酶的影响[J].临床合理用药,2011,4(8):13-14.
[2]朴志刚,朴惠善,金光春.川芎嗪对缺血心肌的保护及抗氧化作用的实验研究[J].中国野生植物资源,2000,19(5):203.
[3]黄智峰,赵玲,龚晓斌.川芎嗪对新生大鼠缺氧缺血性脑损伤的保护作用[J].中华实用中西医杂志,2004,4(17):2545.
[4]Yingxiu Kang,Minghua Hu,Yanhui Zhu,Xin Gao and Ming-Wei Wang.Antioxidative effect of the herbal remedy and its active compoment tertramethylpyrazine on high glucose-treated endothelial cells[J].Life Sci.2009,84(13-14):428-436.
[5]陈玮,陈维维,陆允敏等.川芎嗪干预大鼠实验性肝纤维化的研究[J].世界临床药物,2007,28(9):522-525.
[6]宋军,赵军宁,王晓东等.芍甘多苷对四氯化碳亚急性肝损伤大鼠肝细胞线粒体保护作用[J].中国中药杂志,2011,36(7):931-934.
[7]张萌,邸东华,李盈.川芎嗪对大鼠脑缺血再灌注后线粒体功能的影响[J].辽宁中医药大学学报,2009,11(2):172-173.
[8]Tsukamoto H,Rippe R,Niemela O,et a1.Roles of oxidative stress in activationu 0f Kupffer and bto cells in liver fibrogenesis.J Gastmenterol,1995,10(supp1):50.
