驱动蛋白与微管间盐键作用的定量分析
2012-10-13张亮
张 亮
(河北工业大学 生物物理研究所,天津 300401)
盐键又称盐桥或离子键,是蛋白质分子中带有正、负电荷的侧链基团互相接近,通过静电吸引而形成的,如羧基和氨基、胍基、咪唑基等基团之间的作用力.吸引力与电荷的电量乘积成正比,而与电荷间的距离平方成反比,但在溶液中,此吸引力将随着周围介质的介电常数增大而降低.在近中性环境的蛋白质分子中,成酸性的氨基酸,其残基侧链在电离以后,带上负电荷,然而对于成碱性氨基酸,其残基侧链在被电离之后,带上正电荷,然后在它们之间,就可以形成盐键了.盐键会随所加入的非极性溶剂而得到加强,反之会随所加入极性溶剂而减弱.
弱键相互作用在现代化学和生物学的许多方面起着至关重要的作用[1].在化学反应、分子识别和调节生化过程中,它们在决定分子结构上是重要的[2-4].弱键也称为非键作用(nonbonding interaction),其能量通常比化学键的能量小一个数量级,又比热运动能量高一个数量级.弱键的主要形式包括:氢键、阳离子、盐键和疏水相互作用.深刻理解这些相互作用有助于合理的理解在生物化学和材料科学所观察到的现象.

驱动蛋白kinesin以一定的方式沿着微管蛋白丝完成一系列运动[5].在这一系列的运动中,驱动蛋白先和轨迹结合,然后是一个产生力的构象变化,使其从微管表面上脱离,然后又变回到最初的构象.在这些构象变化中,伴随着化学能的转移.驱动蛋白的一系列产生力的循环的效果是一个连续的机械运动.生物分子马达的机械运动只是自然界循环之一,其在利用ATP化学能上有很高的能量利用率,机械效率可以接近50%,其中的技术意义仍然没有被充分认识.驱动蛋白kinesin可以抵抗约6 pN的阻力每步行进8 nm,利用了来自ATP分子水解产生的约100 pN nm的化学能[6].实验上已经发现,驱动蛋白处于ATP结合态时,其与微管处于强结合态;而在ATP水解后的ADP结合态,驱动蛋白与微管处于弱结合态[7].但是目前并不知道这两种状态下驱动蛋白与微管间的相互作用能量的确切大小,驱动蛋白与微管间的相互作用是由各种分子间弱键作用组成的,其中关键的弱键作用之一就是盐键.通过仔细分析驱动蛋白在ATP结合态和ADP结合态的晶体结构,找出了两种状态下驱动蛋白与微管蛋白之间所有可能形成的盐键,利用静电相互作用方式对这些盐键进行了定量计算和统计分析.这项工作是全面定量计算驱动蛋白与微管间相互作用的一个重要步骤.
1 方法
本研究内容主要涉及到了结晶结构(PDB ID:2HXF和2HXH), 对于此部分的能量计算,采取静电相互作用方式来计算能量,能量公式:

宏观的SI单位制不适用于原子尺度,本文采用这样的一套体系:能量的单位kJmol1,距离的单位,力的单位,电量的单位+e和 e,库仑力常数,内容参考Gromacs使用手册第7页和第43页.
在生物体的细胞内,水的介电常数是10[8-9],所以在这里的盐键能量采用以下公式计算:

2 结果
在结晶结构(PDB ID:2HXF和2HXH)查找到的驱动蛋白与微管之间的盐键相互作用的结合位点,如表1所示.经计算得到的能量值如图2所示.
根据图2中计算出的能量值,可以算出驱动蛋白与微管之间的盐键相互作用能量.
1)相互吸引能量.
在ATP强结合态和ADP弱结合态的总能量分别是: 355.487 595 kJ/mol和 472.611 0045 kJ/mol.
2)相互排斥能量.
在ATP强结合态和ADP弱结合态的总能量分别是:291.250 087 5 kJ/mol和476.389 350 7 kJ/mol.
ATP强结合态和ADP弱结合态两种状态的能量差:-68.0158537kJ/mol.
3 讨论
计算表明,驱动蛋白与微管之间,在ATP强结合态和ADP弱结合态两种状态总体上能量相差: 68.015 853 7 kJ/mol.此结果证实了,2004年Hirokawa等人的文章中指出的结论:驱动蛋白的头部在ATP结合态时与微管间的亲和力比较强,称为强结合态(strong-binding state),但在ADP态时其亲和力比较弱,被称为弱结合态(weak-binding state)[7],这一点和实验的结果是符合的.

表1 分子马达与微管中ATP和ADP态盐键结合位点Tab.1 Saltbridge sites of kinesin and microtubule at ATP and ADP states
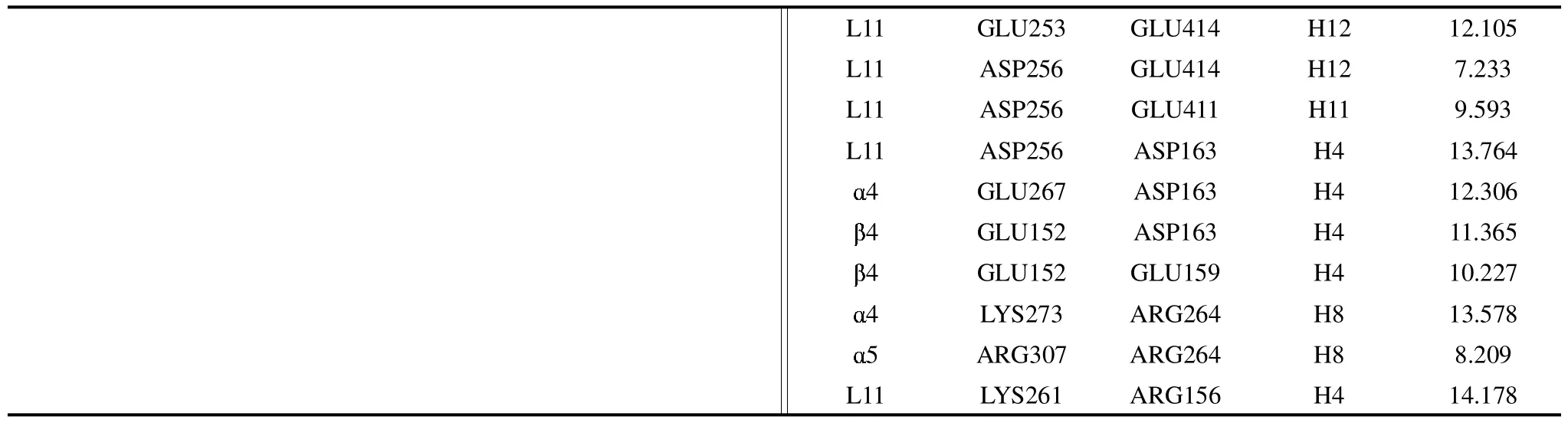
续表1
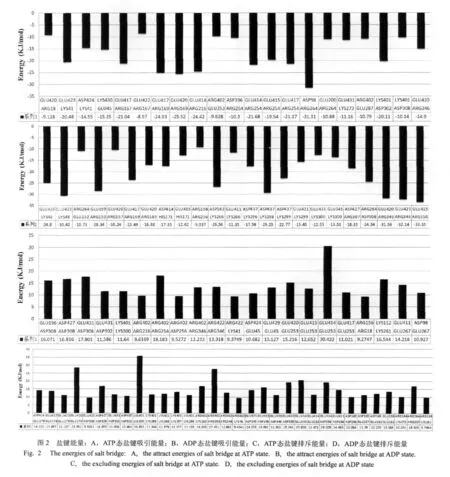
盐键的计算由于采用了静电计算公式,所以结果要依赖于介电常数的选择.本文根据有关的文献选择了介电常数为10,这是一个比较适中的数值.由此计算出的盐键作用的能量与通常关于蛋白质中的盐键能量的数值处于一个数量级内,因而比较合理.在本文的结果中可以看出,尽管在ADP态盐键引力大于ATP态,但同时在ADP态的静电排斥力却远大于ATP态.所以总的来说,静电作用在ATP态加强了马达与微管之间的结合能,在ADP态减弱了马达与微管的结合能.
4 结论
驱动蛋白kinesin以一定的方式沿着微管蛋白丝完成一系列运动.在这一系列的运动中,驱动蛋白先和轨迹结合,然后是一个产生力的构象变化,使其从微管表面上脱离,然后又变回到最初的构象.在这些构象变化中,伴随着化学能的转移.驱动蛋白的一系列产生力的循环的效果是一个连续的机械运动.生物分子马达的机械运动只是自然界循环之一,其在利用ATP化学能上有很高的能量利用率,机械效率可能接近50%.驱动蛋白kinesin可以抵抗约6 pN的阻力每步行进8nm,利用了来自ATP分子水解产生的约100 pN nm的化学能.驱动蛋白处于ATP结合态时,其与微管处于强结合态;而在ADP结合态,驱动蛋白与微管处于弱结合态.驱动蛋白与微管间的相互作用是由各种分子间弱键作用组成的,其中关键的弱键作用之一就是盐键.本文通过仔细分析驱动蛋白在ATP结合态和ADP结合态的晶体结构资料,找出了两种状态下驱动蛋白与微管蛋白之间所有可能形成的盐键.根据计算数据的分析,得到盐键,相互吸引能量,在ATP强结合态和ADP弱结合态的总能量分别是: 355.487 595 kJ/mol和 472.611 004 5 kJ/mol,相互排斥能量,在ATP强结合态和ADP弱结合态的总能量分别是:291.250 087 5 kJ/mol和476.389 350 7 kJ/mol,ATP强结合态和ADP弱结合态2种状态的能量差: 68.015 853 7 kJ/mol.通过对微管上的驱动蛋白微观水平上的研究和分析,加深了对于驱动蛋白沿微管运动的机理的理解,盐键的形成条件(包括键长、键角等各种微观上的结构参数)、作用机理和作用方式等有了较为深刻的认识.
[1]Schneider Hj.Binding Mechanisms in Supra molecular Complexes[J].Angew Chem IntEd Engl,2009:48(22):3924-3977.
[2]Oshovsky Gv,ReinhoudtDn,Verboom W.Supra molecular Chemistry in Water[J].Angew Chem IntEd 2007,46(14):2366-2393.
[3]KruppaM,König B.Reversible Coordinative Bonds in Molecular Recognition[J].Chem Rev,2006,106(9):3520-3560.
[4]Saalfrank Rw,Maid H,ScheurerA.Supra molecular Coordination Chem istry:The Synergistic EffectofSerendipity and Rational Design[J].Angew Chem IntEd Engl,2008,47(46):8794-8824.
[5]Vale Ronald D,Milligan Ronald A.The Way Things Move:Looking Under the Hood of Molecular Motor Proteins[J].Science,2000,288(5463):88-95.
[6]RiceS,Lin AbelW,SaferDaniel,etal.A Structural Change In The Kinesin Motor Protein ThatDrivesMotility[J].Nature,1999,402(6763):778-784.
[7]Isom DanielG,Casta edaCarlosA,Cannon Brian R,etal.Charges In The Hydrophobic Interior Of Proteins[J].ProcNatlAcad SciUSA,2010,107(37):16096-16100.
[8]Aguilella-Arzo Marcel,Andrio Andreu,Vicente M Aguilella,et al.Dielectric Saturation OfWater In A Membrane Protein Channel[J].Phys Chem Chem Phys,2009,11(2):358-365.
[9]NittaRyo,KikkawaMasahide,OkadaYasushi,etal.Kif1aA lternately UsesTwo Loops To BindM icrotubules[J].Science,2004,305(5684):678-683.
