泡沫分离水溶液中微量茶碱工艺研究
2012-09-17张星璨吴兆亮
张星璨,吴兆亮,傅 萍,粟 勇
(河北工业大学 化工学院,天津 300130)
0 前言
茶碱,化学名为1,3-二甲基-3,7-二氢-1H-嘌呤-2,6-二酮,是一种黄嘌呤类抗支气管痉挛药,具有良好的抗炎、平喘作用[1-2],茶碱也是化学合成咖啡因过程中一种重要的中间体.在生产咖啡因、茶碱等黄嘌呤系类产品的过程中,排放的制药废水里含有微量的、难降解的茶碱,此制药废水是一类高色度、难降解和具有生物毒性的有机废水[3],若直接排放在环境中,不仅危害生态系统,还对人体健康造成威胁[4-6],而且也浪费了资源.目前制药废水的处理技术有化学氧化处理技术[7]、物理处理技术[8]、生物处理技术[9-10]和物理化学处理技术[11],这些技术不仅处理成本高,而且很难回收药物组分,因此难以实现工业化.谭靓、曲媛媛等人[10]使用厌氧折流板反应器-高效生物曝气池工艺处理黄嘌呤类药物合成废水,虽然中试时使废水达到了二级排放标准要求,但是工艺流程复杂,成本很高.
泡沫分离技术是一种根据表面吸附原理而形成的新型分离技术,因具有设备简单、成本能耗低和无污染的特点而被广泛应用于废水处理[12-14]中.为了强化泡沫分离过程中的泡沫层排液,从而提高被分离组分的富集比,钱少瑜[15]研究了具有球形构件的泡沫分离设备对分离效率的影响,结果表明与普通泡沫分离设备相比,具有球形构件的泡沫分离设备能很好强化泡沫层排液,促进分离效率得到提高.Linke D和Zorn H等人[16]也曾使用类似的球形泡沫塔分离真菌产生的脂肪酶并取得了良好效果.因此本文以茶碱水溶液为模拟体系,十六烷基三甲基溴化铵CTAB为阳离子表面活性剂,在阐述泡沫分离富集茶碱原理的基础上,通过使用具有球形构件的泡沫分离塔,研究影响泡沫分离茶碱效率的因素和规律,从而确定合适的回收茶碱工艺.
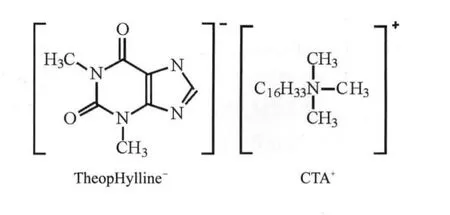
图1 茶碱和CTAB络合物(摩尔比1:1)Fig.1 Structureof TheopHylline/CTAB complex(molar ratio 1:1)
1 实验部分
1.1 实验原理
泡沫分离得以进行必须具备一个前提条件就是所需分离的组分应该是表面活性物质,如果不是表面活性物质,则必须与某些表面活性物质发生络合生成络合物,从而通过表面活性物质使得所生成的络合物吸附在气泡表面的气液界面上,这样通过富集此络合物达到富集不是表面活性的物质.茶碱不是表面活性物质,不能直接通过泡沫分离富集,但茶碱分子在碱性溶液中易电解成负离子,如图1所示.十六烷基三甲基溴化铵CTAB为阳离子表面活性剂,在水中易电解成十六烷基三甲基铵正离子,此负离子和正离子通过静电吸引产生络合物.由于CTAB是一种泡沫性能很好的表面活性物质,因此通过表面活性物质CTAB就可以利用泡沫分离技术富集茶碱.
1.2 实验试剂
茶碱(C7H8O2N4):工业级98.0%,天津中安制药厂;CTAB(C19H42NBr):分析纯,天津市化学试剂三厂;浓盐酸(HCl):分析纯,天津科密欧化学试剂有限公司;氢氧化钠(NaOH):分析纯,天津科密欧化学试剂有限公司.
1.3 实验仪器
752紫外可见分光光度计(上海精密科学仪器有限公司);FA1204B电子天平(上海精密科学仪器有限公司);LZB-3WB型空气转子流量计(天津五环仪表厂);AC0-318电磁式空气压缩机(广东海利集团有限公司).
1.4 实验装置和方法
泡沫分离装置如图2所示,泡沫分离塔由玻璃材质制成,总高度700mm,直塔部分高为500mm,塔内径40 mm,球体部分直径100 mm.塔底部位装有微孔气体分布器,高20 mm,直径25 mm.球体顶部由玻璃弯管导出泡沫进入泡沫收集器.
常温下(20±5℃),配制茶碱水溶液质量浓度为10 mg/L,通过调节泡沫分离过程中CTAB溶液浓度、初始pH、气体流量及装液量进行实验操作.通气后,泡沫将不断从玻璃弯管中导出,对导出泡沫进行收集,直至无泡沫流出时结束实验,通过测量消泡液和塔内残液的体积,并用紫外吸收法测量消泡液和塔内残液中茶碱的质量浓度,计算茶碱的富集比和回收率.
1.5 分析方法及分离效率表征
实验中茶碱浓度采用紫外吸收法测量,在271nm处[17]测定的茶碱质量浓度标准曲线为:=0.01814+0.0466C,式中表示所测的吸光度;C为稀释后溶液中茶碱的质量浓度,mg/L,茶碱的实际质量浓度应该乘以相应的稀释倍数;标准曲线的线性度2为0.9999,线性回归范围为0~20 mg/L.
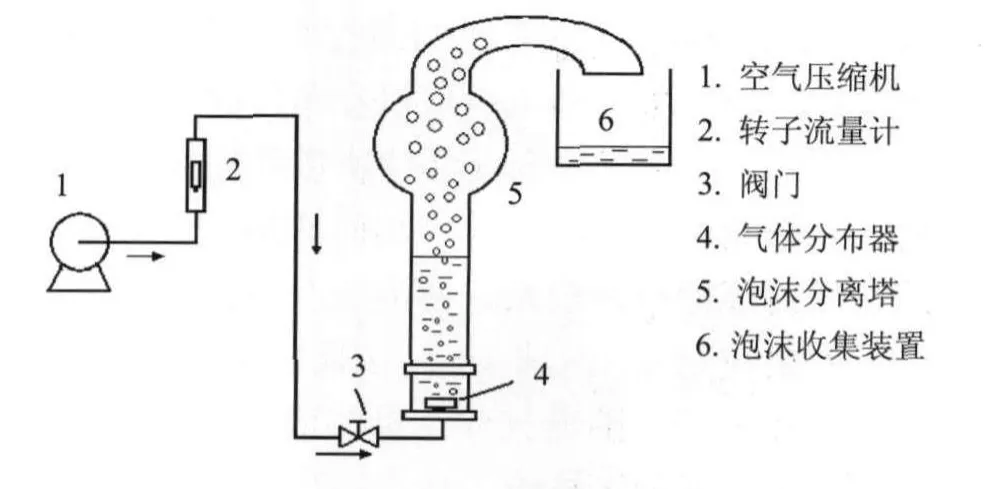
图2 泡沫分离装置图Fig.2 Experimental apparatusfor foam separation
茶碱的泡沫分离效率由富集比E和回收率R表征:
2 结果与讨论
2.1 表面活性剂CTAB浓度对泡沫分离效率的影响
分别向10mg/L茶碱溶液中加入一定量的CTAB,使溶液中CTAB浓度为0.15~0.35g/L,在气体流量400mL/min、初始pH 10.0和装液量400mL的实验条件下进行泡沫分离操作.CTAB浓度对茶碱富集比和回收率的影响如图3所示.
图3结果表明,CTAB浓度对泡沫分离效率有显著影响.随着CTAB浓度的增加,茶碱的回收率由49.0%增加到67.2%,当CTAB浓度超过其临界胶束浓度(0.32g/L)后,回收率继而减小到62.2%.同时随着CTAB浓度的增加,茶碱的富集比先增加,在CTAB浓度0.2g/L时达到最大值35.8,后减小到15.4,当CTAB浓度超过临界胶束浓度后,茶碱的富集比又增加到17.1.
受泡沫分离塔球体部分的影响,如果表面活性剂浓度较低,形成的泡沫不容易通过球体的最大直径处,使茶碱分子在较低的表面活性剂浓度范围内(低于0.35 g/L)不容易离开泡沫分离塔[15].随着CTAB浓度的增加,液相体系表面张力和表面能均减小,液相与气相间的传质更充分,同时更多的茶碱分子与CTAB络合,使富集比和回收率都有所增加.但是随着CTAB浓度的继续增加,产生的泡沫量会增大[18],这样会减缓泡沫的排液速率,使收集到的消泡液体积增加,富集比减小而回收率增加.当CTAB浓度超过临界胶束浓度时,CTAB在溶液中形成没有表面活性的胶束,相当于溶液中表面活性剂的实际浓度减小,使茶碱的回收率小幅度减小,而富集比小幅度增加.
重点考虑富集比和兼顾考虑回收率,合适的CTAB浓度是0.2 g/L.
2.2 气体流量对泡沫分离效率的影响
初始溶液中茶碱浓度和CTAB浓度分别为10 mg/L和0.2 g/L,调节气体流量G为200至500 mL/min,在初始pH 10.0和装液量400mL的条件下进行泡沫分离操作,研究气体流量对泡沫分离效率的影响,结果如图4所示.
由图4所示,随着气体流量的增加,茶碱的富集比由55.2减小到31.2,回收率由36.2%增加到63.2%,当气体流量超过300mL/min后,富集比和回收率的变化趋势均变缓慢.一般来说,较高的气体流量可以在单位时间和体积内产生更多气泡,有利于更多的表面活性物质吸附在气液界面上[19],因此回收率随着气体流量的增加而增加.在低气体流量下,泡沫在塔内停留时间较长,使泡沫在塔内上升时由重力引起的排液效果较充分,泡沫干燥,因而收集到的消泡液体积较小,富集比较大[20].随着气体流量的增加,泡沫在塔内停留时间缩短,不利于泡沫排液,使得塔顶处泡沫持液量仍较大,收集到的消泡液中茶碱浓度较低,富集比较小.

图3 CTAB浓度对富集比和回收率的影响Fig.3 Effectof initial CTABconcentrationontheenrichment ratio and recovery percentage

图4 气体流量对富集比和回收率的影响Fig.4 Effect of air flow rateon theenrichment ratio and recovery percentage
在本实验中,由于使用的泡沫分离塔具有球形构件,使泡沫随着气流上升通过球体时,泡沫的停留时间比通过圆柱体部分等内径等体积的普通泡沫分离塔的停留时间延长1.7倍[15],同时随着下半球的截面积由小增大,单位面积的气体通量减小,使气泡聚并现象更加显著,排液更加充分,这样可以缓解一般圆柱形分离塔内随气体流量增加时,泡沫停留时间变短不利于排液的问题,使富集比随气体流量增大而减小的趋势变缓慢.同时泡沫分离塔的球形构件也使泡沫稳定性降低,这样使塔内泡沫相对于普通泡沫分离塔更难排出,使回收率随气体流量增大而增加的趋势也变缓慢.
综合考虑茶碱的富集比和回收率,合适的气体流量是300 mL/min.
2.3 pH对泡沫分离效率的影响
初始溶液中茶碱浓度和CTAB浓度分别为10 mg/L和0.2 g/L,用稀HCl和NaOH溶液调节茶碱和CTAB混合溶液初始pH为6.0、6.5、6.8、7.0至11.0.在气体流量300 mL/min和装液量400 mL的条件下进行泡沫分离操作,研究pH对泡沫分离效率的影响,实验结果如图5所示.
由图5所示,随着pH的增加,茶碱的富集比和回收率同时先增大后减少.当pH小于7.0时,茶碱分子难电解成负离子,这时茶碱分子难和CTAB进行静电结合,所以在酸性条件下,茶碱的富集比和回收率非常小.当pH大于7.0时,茶碱分子容易电解成负离子,带负电荷的茶碱分子和带正电荷的CTAB络合,从而茶碱的富集比和回收率显著提高.当pH 8.0时富集比和回收率分别为48.8和57.4%,此时达到最大值.当pH继续增大时,茶碱的富集比和回收率都开始下降.这是由于当初始溶液的 pH较大时,溶液中的 OH也大量增加,这样会导致 OH和带负电的茶碱分子竞争R1R2R3-NH+Br[13],影响茶碱分子的络合和吸附,因此使茶碱的富集比和回收率在高pH环境时均减小.
综合考虑茶碱的富集比和回收率,合适的初始pH值是8.0.
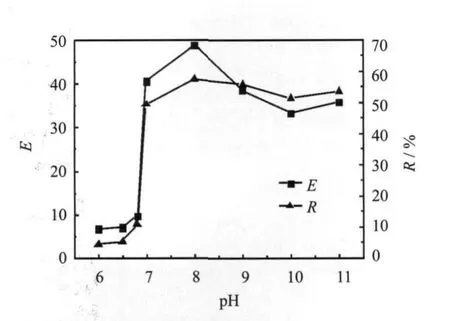
图5 pH对富集比和回收率的影响Fig.5 Effect of initial pH on theenrichment ratio and recovery percentage
2.4 装液量对泡沫分离效率的影响
初始溶液中茶碱浓度和CTAB浓度分别为10mg/L和0.2g/L,将液量分别为300mL至450mL,在初始pH 8.0和气体流量300mL/min的条件下进行泡沫分离操作,研究装液量对泡沫分离效率的影响,实验结果如图6所示.由图6可以看出,随着装液量的增加富集比由51.8减小到40.5,而回收率随装液量增加,在装液量为450 mL时达到最大值65.8%.
在泡沫分离过程中,当气体流量与泡沫分离塔高一定时,塔内装液量的增加意味着塔内液相的高度增加而泡沫相高度减少,即气泡在液相中的停留时间增加而在泡沫相停留时间减小[21].当气泡在液相中停留时间增加,使得气泡对茶碱的吸附量增加,回收率增加.而在泡沫相中,气泡在泡沫相停留时间的减小,总体来说不利于泡沫的聚并,导致泡沫的持液量增加,使泡沫中茶碱浓度减小,富集比降低.
综合考虑茶碱的富集比和回收率,合适的装液量是350 mL.

图6 装液量对富集比和回收率的影响Fig.6 Effect of liquid loading volumeon theenrichment ratio and recovery percentage
3 结论
1)十六烷基三甲基溴化铵CTAB为阳离子表面活性剂,是一种泡沫性能很好的表面活性物质,能与茶碱络合而通过泡沫分离技术进行富集.
2)采用一种利用球形构件加强排液的泡沫分离技术确定了合适的操作条件为CTAB浓度0.2 g/L、初始pH 8.0、气体流量300 mL/min和装液量350 mL时,在此条件下茶碱的富集比为49.3,回收率为56.9%.
[1]Gaudreault P,Guay J.Theophyllinepoisoning pharmacological considerationsand clinical management[J].Med Toxicol,1986,1:169-91.
[2]Hirose M,Yokoyama H,Iinuma K.Theophyllineimpairsmemory/learning in developing mice[J].Brain Dev,2004,26:448-452.
[3]黄晓兰,许玫英.高效液相色谱法同时测定制药废水中的交沙霉素、茶碱及扑热息痛 [J].色谱,2005,23(3):296-298.
[4]Segawa M,Mori K,Toda F.Applicationof host-guestcomplexationmethod toisolationof natural product[J].Chem Letters,1988,6(4):1755-1758.
[5]Zubair M U,Hassan M A,A1-Meshal IA Caffeine.analytical profilesof drugsubstances[M].New York:Academic press,1986,15:71-150.
[6]上海第十六制药厂.二甲基脲合成咖啡因 [J].中国医药工业杂志,1973,8:1-3.
[7]Hwang BJ,Lee K L.Electrocatalytic oxidation of 2-Chlorophenol on acomposite PbO2/Polypyrroleelectrodein aqueoussolution[J].JAppl Electrochem,1996,26(1):153-159.
[8]丁保宏,王晓立,马瑞廷,等.新型高效无极混凝剂聚硅酸铝的应用研究 [J].辽宁大学学报,2003,30(2):155-156.
[9]李利芳.咖啡因生产过程中水洗原母污水治理及资源的循环利用技术 [D].北京:北京化工大学,2010.
[10]谭靓,曲媛媛,赵玉成,等.黄嘌呤类药物合成废水的生物处理工程实践 [J].水技术处理,2007,33(1):88-91.
[11]王浙明,韩新伟,史惠祥.厌氧-A/O接触氧化工艺处理丝厂的高浓度有机废水 [J].工业水处理,2002,22(1):52-54.
[12]Kinoshita T,Akita S,Ozawa S,et al.Continuousrecovery of Gold(III)viafoam separation with nonionic surfactant[J].Miner Eng,2004,3(1):53-63.
[13]Qian SY,Wu Z L,Zheng H J,et al.Study on riboflavin recovery from wastewater by a batch foam separation process[J].Sep Sci Technol,2009,44(11):1-14.
[14]Han B,Wu Z L,Yin H,et al.Study on streptomycin sulfaterecovery by batch foam separation[J].Sep Sci Technol,2010,45:844-848.
[15]钱少瑜.泡沫层强化排液的泡沫分离塔的研究及应用 [D].天津:河北工业大学,2009.
[16]Linke D,Zorn H,Cerken B,et al.Foam fractionation of Exo-lipasesfrom agrowing fungus(Pleurotussapidus)[J].Lipids,2005,40(3):323-327.
[17]Munday D L,Fassihi A R.In vitro-in vivo correlation studies on a novel controlled release theophylline delivery system and on Theo-Dur tablets[J].Int JPharm,1995,118:251-255.
[18]Gerken BM,Nicolai A,Linke D,etal.Effectiveenrichmentand recovery of laccase Cusingcontinuousfoamfractionation[J].Sep Purif Technol,2006,49(3):291-294.
[19]Lu K,Zhang X L,Zhao Y L,etal.Removal of color from textiledyeingwastewater by foamseparation[J].JHazard Mater,2010,18(1-3):928-932.
[20]Crofcheck C,Gillette K.Evaluation of foam fractionation column scale-up for recovering bovineserum albumin[J].Transactionsof the ASABE,2003,46(6):1759-1764.
[21]Bhattacharjee S,Kumar R,Gandhi K S.Predictionof separationfactor infoamseparationof proteins[J].Chem Eng Sci,1997,52(24):4625-4636.
