温度、盐度和光照对一株有毒利玛原甲藻生长的影响研究
2012-10-13于仁成冯振洲李爱峰周名江
徐 杏, 于仁成, 罗 璇, 冯振洲, 李爱峰, 颜 天, 周名江, 白 洁
(1. 中国海洋大学 教育部海洋环境与生态重点实验室,山东青岛266100; 2. 中国科学院 海洋研究所海洋生态与环境科学重点实验室, 山东青岛266071)
目前, 有害赤潮已经成为全球性的海洋环境问题, 对人类健康、自然生态和海水养殖构成了巨大威胁[1-2]。其中, 有毒藻形成的有害赤潮尤其令人关注。有毒赤潮藻能够产生藻毒素, 在贝类和鱼类体内累积, 并沿食物链传递, 危害高营养级的海洋生物, 甚至危及人类健康。常见的藻毒素包括麻痹性贝毒(Paralytic Shellfish Poison), PSP)、腹泻性贝毒(Diarrhetic Shellfish Poison, DSP)、神经性贝毒(Neurotoxic Shellfish Poison, NSP)、记忆缺失性贝毒(Amnesic Shellfish Poison, ASP)和西加鱼毒素(Ciguatera Fish Poison, CFP)等[3]。其中, DSP 毒素是近年来受到密切关注的一类藻毒素[4-5]。
在以往研究中, 通常将 DSP毒素分为三类: 即酸性毒素大田软海绵酸(Okadaic acid, OA)及其衍生物鳍藻毒素(Dinophysistoxins, DTXs), 聚醚内酯类毒素(Pectenotoxins, PTXs)和带有硫酸基团的聚醚类毒素(Yessotoxins, YTXs)。但是, 后两类毒素实际上不会导致腹泻症状[6], 而 OA和DTX毒素能够抑制丝氨酸/苏氨酸蛋白磷酸酶PP1和PP2A, 从而诱导蛋白质的超磷酸化, 不仅会使中毒患者出现腹泻等症状, 而且会诱导细胞凋亡, 具有促进肿瘤形成的长期毒性效应[7]。因此, OA和DTX等DSP毒素是水产品质量控制中需要密切关注的一类毒素, 迫切需要开展全面的检测和分析工作。但是, DSP标准毒素价格昂贵, 这在很大程度上制约着对 DSP毒素检测和分析工作的开展。
根据以往文献报道, 鳍藻属(Dinophysis)和原甲藻属(Prorocentrum)中的一些藻种能够产生 DSP毒素,如Dinophysis fortii,D. acuminata,D. acuta,D.norvegica,D. mitra,D. rotundata,D. tripos,D. caudata, D. hastate, D. sacculus和Prorocentrum lima、P.concavum、P. redfieldi等[4,8-9]。但鳍藻属中藻种的培养非常困难[4,10-11], 近年来虽然有所突破[12], 但要依靠现有技术实现对鳍藻的大量连续培养仍然存在问题。因此, 从实验室培养的利玛原甲藻中分离纯化DSP毒素是获取DSP毒素的重要来源[13]。
在我国, DSP毒素污染问题比较突出。对我国沿海贝类中毒素污染情况进行的调查显示, 辽东湾、胶州湾、莱州湾、秦皇岛、福建等地沿海的贝类均有受到DSP毒素污染的报道[2,4,14-16]。1998年9~10月,渤海湾曾发生大面积赤潮, 其原因种之一就是能够产生 DSP毒素的倒卵形鳍藻[17]。可见, 在我国开展DSP毒素的研究非常重要。本文针对一株利玛原甲藻(Prorocentrum limaDodge), 分析其毒素产生情况,并通过设计多因子实验探讨了温度、盐度和光照强度等环境因子对利玛原甲藻生长的影响, 以期获得这株利玛原甲藻的最适培养条件, 为开展 DSP研究奠定基础。
1 材料与方法
1.1 藻种
利玛原甲藻购自美国 Bigelow海洋科学实验室海洋浮游植物培养中心 (Provasoli-Guillard National Center for Culture of Marine Phytoplankton, CCMP),藻株编号CCMP1966。
1.2 培养条件
培养利玛原甲藻所用的海水取自中国科学院海洋研究所水族楼, 是经沙滤处理后的青岛汇泉湾天然海水, 盐度为31, pH为7.9±0.1, 海水以0.45 μm混合纤维滤膜过滤后, 煮沸灭菌, 并转至高压灭菌的锥形瓶内, 添加 f/2-Si培养液后, 接入利玛原甲藻,在 20 °C, 4 800 lx下培养, 光暗比为 12 h∶12 h。
1.3 毒性测试与毒素分析
利玛原甲藻毒性的测试采用小鼠腹腔注射法,用于毒性测试的昆明系小白鼠(体重为20 g±1 g)购自青岛药物研究所。取稳定期的利玛原甲藻培养液300 mL, 滤至玻璃纤维滤膜上, 用剪刀剪碎后, 加入甲醇/丙酮提取液(体积比40∶60, 含0.3%乙酸)4 mL,振荡4 min后, 静置提取过夜。提取液以8 000 r/min离心8 min, 取出上清液至10 mL容量瓶中, 重复提取一次, 合并上清液, 定容至 10 mL, 置于-20°C保存。分别取0.9, 3, 5.1 mL藻毒素提取液, 氮气吹干后, 加入3 mL 1% 吐温-60试剂溶解后, 分别取1 mL腹腔注射3只小白鼠。对照组直接注射1%吐温-60试剂。观察其存活状况24 h。
采用液-质联用方法对利玛原甲藻产生的毒素进行分析。将培养的利玛原甲藻藻液200 mL过滤到玻璃纤维滤膜上, 剪碎, 置于 7 mL离心管中, 加入3mL酸化甲醇水提取液(甲醇: 0.05 mol/L乙酸= 9∶1), 振荡1 min后, 置于超声水浴中超声处理10 min,于4℃下静置提取过夜, 提取液8 000 r/min 离心10 min后, 取上清液以0.22 μm滤膜过滤, 滤液用于分析 DSP毒素成分。毒素分析采用美国热电公司(ThermoFinnigan, San Jose, CA, USA)制造的LC-MS系统, 其中 HPLC系统配备低压混合四元泵和自动进样器, 质谱检测器为Finnigan LCQTMDeca XP Plus离子阱检测器, 配备ESI离子化源。通过OA标准毒素的流动注射分析, 优化质谱检测器参数为: 毛细管温度275°C, 离子喷射电压3.0 kV, 鞘气流35 arb,毛细管电压23 V, 入口透镜电压为-74 V, 透镜电压为-18 V, 电子管透镜补偿为25 V, 多孔补偿电压1为-4.5 V, 多孔补偿电压2为-9.5 V, 多孔射频振幅为 400 Vp-p。采用选择离子检测(selective ion monitoring, SIM)方式, 在阳离子检测模式下检测OA和DTX1, 每一毒素分别检测三种阳离子, 质荷比分别为[OA+H]+: 805.0; [OA+NH4]+: 822.0; [OA+Na]+:827.0; [DTX1+H]+: 819.0; [DTX1+NH4]+: 836.0;[DTX1+Na]+: 841.0。用于分离OA和DTX毒素的色谱柱为PhenomenexLuna C18柱(150×2.0 mm, 3 μm,100 Å), 配备C18保护柱套(PhenomenexATO-4287,4×3 mm)。采用两相洗脱液, 洗脱液A为水溶液, 含有2 mmol/L甲酸和 50 mmol/L甲酸铵, 洗脱液B为95%乙腈溶液, 含有2 mmol/L甲酸和 50 mmol/L甲酸铵。用30%洗脱液A 和70%洗脱液B等梯度洗脱,流速 150 μL/min。样品注射量 10 μL。用于对比的OA和DTX1标准毒素分别购自加拿大国家科学院海洋生物学研究所和日本。
1.4 多因子影响实验设计
实验于中国科学院海洋研究所水族楼实验室进行。选择温度、盐度和光照三种环境因子, 根据这株利玛原甲藻分离地环境条件及实验室条件, 对三种因子分别选取三个水平, 其中温度为18、21和24°C,盐度为28、32和36, 光照强度为2 500、5 000和7 500 lx, 进行多因子影响实验, 总计27个处理组, 每组设置三个重复。实验在人工光照培养箱内进行, 容器为100 mL玻璃锥形瓶, 事先经高压灭菌消毒。实验中所用的不同盐度海水是通过以蒸馏水稀释天然海水、或向天然海水中补加氯化钠获得。接种用的利玛原甲藻为处于对数生长期中期的藻, 其中, 用于接种不同盐度实验组的藻预先在各实验盐度下进行适应培养后再用于接种。
对各处理组中的利玛原甲藻进行观察, 并从培养当天(0天)开始取样计数, 此后每隔2天取样一次,样品以鲁格试液(Lugol’s solution)固定后, 在显微镜下用浮游植物计数框计数, 记录细胞密度, 并计算细胞比增长率μ:

其中:Bt1和Bt2分别是培养t1和t2天后的细胞密度,t1和t2为培养天数。
1.5 统计分析
应用多因素方差分析方法对实验数据进行处理,通过F检验分析各环境因子不同处理水平对利玛原甲藻生长影响的显著性, 按概率(P<0.05)设置显著性检验阈值。
2 实验结果分析
2.1 利玛原甲藻的DSP毒性与毒素成分分析
通过小鼠生物测试法对培养利玛原甲藻的 DSP毒性进行了测试。结果如表1所示, 注射利玛原甲藻提取液的实验组都有小鼠死亡现象出现, 而且, 随着毒素提取液注射量的增加, 死亡小鼠比例增加。实验中对照组小鼠未死亡。可以看出, 培养的利玛原甲藻具有DSP毒性, 可能产生DSP毒素。根据实验结果, 实验组2(注射1.0 mL提取液)毒性最接近1个鼠单位, 以此计算, 每100 mL 培养液中利玛原甲藻的毒性应在 3.3 MU(mouse unit, 鼠单位)左右。
应用液-质联用分析方法, 通过与OA和DTX1标准毒素进行对比, 对利玛原甲藻提取液中的 OA和DTX1毒素进行了分析, 得到色谱图如图1所示。可以看出, 在利玛原甲藻提取液中存在 OA和DTX1毒素。在针对每一毒素的三种阳离子检测结果中, 质荷比为827.0和 841.0的阳离子[OA+Na]+和[DTX1+Na]+信号最高, 而另外两种阳离子的信号较弱。对比 OA和DTX1标准毒素, 计算得到每100 mL培养的利玛原甲藻中, OA和DTX1的含量分别为2.8 μg和6.8 μg。

表1 利玛原甲藻提取液DSP毒性的小鼠生物测试结果Tab. 1 Mouse bioassay results on the DSP toxicity of Prorocentrum lima extract
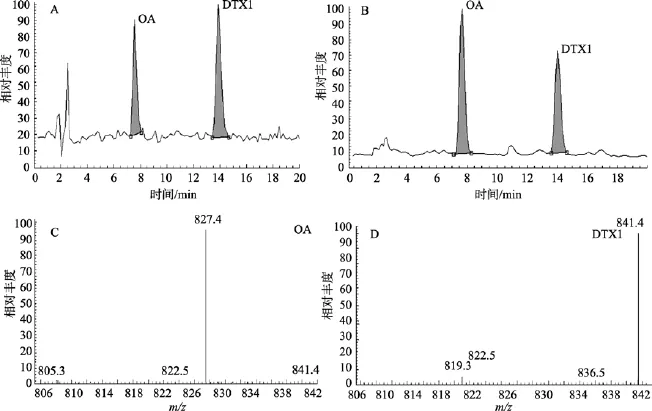
图1 应用液-质联用方法对利玛原甲藻中OA和DTX1的分析结果Fig. 1 Analysis of OA and DTX1 in the extract of Prorocentrum lima cells with liquid chromatography-mass spectrometry
2.2 温度、盐度和光照强度对利玛原甲藻生长的影响
采用比增长率作为指标, 比较了不同水平的温度、盐度和光照强度等环境因子对利玛原甲藻生长的影响, 结果如图2所示。应用多因素方差分析方法对实验结果进行了统计分析(表 2), 可以看出, 在三种环境因子中, 只有不同水平的盐度对利玛原甲藻的生长具有显著影响(F值为 5.45, 大于F0.05(2,54)=3.16), 对于不同水平的盐度处理组, 盐度为 28时利玛原甲藻的比增长率最高, 达到 0.18, 而当盐度分别为32和36的时候, 平均比增长率为0.16。温度和光照实验各水平对利玛原甲藻生长的影响没有显著差异(F值分别为1.74和1.69, 小于F0.05(2, 54)=3.16),但低温(18°C)和高光照(7 500 lx)下,利玛原甲藻表现出了较高的比增长率, 分别达到0.18和0.17。此外,温度和盐度及温度和光照强度之间的交互作用对利玛原甲藻的生长也有显著影响, 而盐度和光照强度之间的交互作用没有显著影响, 三者之间的交互作用对利玛原甲藻的生长也没有显著影响。

图2 温度、盐度和光照强度分别对利玛原甲藻生长的影响Fig. 2 The effects of temperature, salinity and light intensity on the growth of Prorocentrum lima

表2 温度、盐度和光照强度对利玛原甲藻生长的多因素方差分析结果(P<0.05)Tab. 2 Multifactor analysis of variance on the effects of temperature, salinity and light intensity on the growth of Prorocentrum lima
3 讨论
利玛原甲藻是一种重要的DSP产毒藻。但是, 目前国内对于利玛原甲藻的研究开展的并不多[18-21],本实验初步分析了一株利玛原甲藻的毒性情况, 并研究了温度、盐度和光照强度等环境因子对利玛原甲藻生长的影响, 以期建立最适培养条件, 为利玛原甲藻的培养和DSP毒素研究提供依据。
实验中通过小鼠生物测试法和液-质联用分析方法, 确定了所培养的利玛原甲藻具有腹泻性贝毒毒性, 并检出了OA和DTX1两种DSP毒素成分。对于其他可能存在的 DSP毒素, 由于缺少标准毒素,在此未作分析。目前, DSP小鼠生物测试法还是一种半定量的毒性测试方法, 无法给出准确的毒性测试结果。但是, 根据本实验的毒素分析和毒性测试结果计算, 每100 mL培养的利玛原甲藻中所含有的OA和DTX的量, 其毒性约为2.8 MU, 与小鼠生物测试法所得到的结果大致相当, 表明OA和DTX1应当是利玛原甲藻所产生的主要毒素成分。
由于利玛原甲藻是一种底栖或附生性海洋甲藻,极少形成高密度藻华, 因此, 对于其生长及其与环境因子之间的关系研究不多。在野外调查中发现[22-23], 利玛原甲藻的丰度表现出一定的区域和季节差异。Carlson和Tindall[24]在Virgin Islands的调查发现, 利玛原甲藻丰度的变化和温度有正相关性。Morton等[25]对从美国佛罗里达州采集的利玛原甲藻进行培养, 发现利玛原甲藻的最适温度是 27°C, 最适盐度为 30, 最适光照强度为 10%全日光, 有关最适温度的实验结果与本文有明显不同。本实验中利玛原甲藻(CCMP1996株)的最适温度为 18°C, 最佳生长盐度为28, 而光照强度为7 500 lx。但是, 在各因子的实验范围内, 不同水平的温度和光照对于利玛原甲藻的生长并没有显著影响。由于本实验所用的利玛原甲藻采自缅因湾海域, 水温偏低, 因此, 实验结果的差异可能是藻株对其生长环境长期适应的结果。
利玛原甲藻是底栖性或附生性甲藻, 尽管在实验培养过程中, 有一部分藻细胞处于浮游状态, 但仍有相当一部分藻细胞结合在一起, 呈絮状或网状附着在锥形瓶底, 给实验过程中的取样和计数带来了很大的困难。以往文献曾报道有多种能够反映藻类生长的指标, 如细胞显微计数、叶绿素a分析、分光光度法(比浊法)、库尔特计数法、流式细胞仪计数[26-27]等, 但这些指标在应用于利玛原甲藻生物量测定时都存在一定的问题, 叶绿素 a含量测定耗时长, 不利于连续测定; 而分光光度法和其他几种计数方法都会不同程度地受到絮状结块的利玛原甲藻细胞影响, 降低测定结果的准确性。为尽可能准确反映利玛原甲藻生长的情况, 我们选择了传统的显微计数方法, 同时在取样时振摇锥形瓶, 并用原培养液冲洗几次培养瓶, 增加对每组实验的计数, 以尽量降低取样和计数误差。此外, 实验过程中发现, 在藻细胞培养初期, 培养液中藻细胞密度相对较低,计数结果受误差影响较大, 重现性低。进入对数生长期后, 随着藻细胞密度的逐渐增加, 取样和计数误差对计数结果的影响有所降低。因此, 为尽可能降低取样和计数误差的影响, 比增长率的计算都选在对数生长初期进行, 也就是从接种后一周左右开始,计算此后10天里利玛原甲藻的平均比增长率, 用于数据分析。
4 结论
综上所述, 本文对一株利玛原甲藻进行了室内培养和毒性测试, 初步的实验结果显示这株利玛原甲藻可以产生OA和DTX1等DSP毒素。通过多因子实验研究了温度、盐度和光照强度对利玛原甲藻生长的影响, 结果表明不同水平的盐度对利玛原甲藻生长有显著影响, 而温度和光照强度的影响并不显著。在实验的温度、盐度和光照强度范围内, 利玛原甲藻在低温(18°C)、低盐(28)和高光照强度(7500 lx)条件下生长较好。这些结果为利用利玛原甲藻开展DSP研究提供了基础资料。
[1]Zingone A, Enevoldsen H O. The diversity of harmful algal blooms: a challenge for science and management[J]. Ocean & Coastal Management, 2000, 43:725-748.
[2]周名江, 朱明远, 张经. 中国赤潮的发生趋势和研究进展[J]. 生命科学, 2001, 13 (2): 54-60.
[3]齐雨藻, 周名江, 邹景忠, 等. 中国沿海赤潮 [M].北京: 科学出版社, 2003.
[4]杨维东, 彭春喜, 刘洁生, 彭志英, 等. 腹泻性贝毒研究现状[J]. 海洋科学, 2005, 29 (5): 66-72.
[5]丁君. 赤潮毒素中腹泻性贝毒和麻痹性贝毒的研究及进展[J]. 大连水产学院学报, 2001, 16 (3): 212-218.
[6]Miles C O, Wilkins A L, Munday R, et al. Isolation of pectenotoxin-2 fromDinophysis acutaand its conversion to pectenotoxin-2 seco acid, and preliminary assessment of their acute toxicities[J]. Toxicon, 2004,43:1-9.
[7]Fernández J J, Candenas M L, Souto K L, et al.Okadaic acid, useful tool for studying cellular processes.Current Med Chem, 2000, 9(2): 229-262.
[8]Viviani R. Eutrophication, marine biotoxins, human health [J]. Sci Total Environ, Suppl, 1992: 631-662.
[9]Hallegraeff G M, Anderson D M, Cembella A D. Manual on harmful marine microalgae [M]. Paris: Intergovernmental Oceanographic Commission, UNESCO,1995.
[10]Lawrence J E, Cembella A D. An immunolabeling technique for the detection of diarrhetic shellfish toxins in individual dinoflagellate cells [J]. Phycologia, 1999,38(1): 60-65.
[11]周名江, 于仁成. 有害赤潮的形成机制、危害效应与防治对策 [J]. 自然杂志, 2007, 29 (2): 72-77.
[12]Park M G, Kim S J, Kim H S, et al. First successful culture of the marine dinoflagellateDinophysis acuminata[J]. Aquat Microb Ecol, 2006, 45: 101-106.
[13]Bravoa I, Femandez M L, Ramiloa I, et al. Toxin composition of the toxic dinoflagellateProrocentrum limaDodgeisolated from different locations along the Galician coast (NW Spain)[J].Toxicon, 2001, 39:537-1545.
[14]周名江, 李钧. 赤潮藻毒素研究进展[J]. 中国海洋药物, 1999, 18(3): 48-54.
[15]李伟才, 栾刚, 李立, 等. 我国沿海部分海区贝毒毒素的调查[J]. 海洋科学, 2000, 24(9): 19-22.
[16]刘宁, 潘国伟, 李春盛, 等. 辽东湾赤潮污染海区贝类软海绵酸的染毒情况调查分析[J]. 中国公共卫生,1999, 15 (3): 209-210.
[17]陈则玲, 付云娜, 巩宁.腹泻性贝毒及其高效液相色谱检测方法[J].海洋通报, 2000, 19(1): 73-78.
[18]邱德全, 林永水, 周近明. 利玛原甲藻腹泻性贝毒的生物学测定[J]. 热带海洋, 1996, 15 (4):46-49.
[19]杨维东, 钟娜, 刘洁生, 等. 不同磷源及浓度对利玛原甲藻生长和产毒的影响研究[J]. 环境科学, 2008,29(10): 2760-2765.
[20]杨维东, 李丽璇, 刘洁生, 等. 海洋底栖甲藻——利玛原甲藻(Prorocentrum lima)对三种赤潮藻的化感作用[J]. 环境科学学报, 2008, 28(8): 1631-1637.
[21]钟娜, 杨维东, 刘洁生, 等. 不同氮源对利玛原甲藻(Prorocentrum lima)生长和产毒的影响研究[J]. 环境科学学报, 2008, 28 (6): 1186-1191.
[22]Jo F, Duncan A P, Steven M, et al. Epiphytic abundance and toxicity ofProrocentrum limapopulations in the Fleet Lagoon, UK [J]. Harmful Algae, 2005, 4:1063-1074.
[23]Lucie M, Susannah C, Paul E H.Prorocentrum lima(Dinophyceae)in northeastern USA coastal waters I.Abundance and distribution [J]. Harmful Algae, 2007, 6:1-9.
[24]Carlson R D , Tindall D R. Distribution and periodicity of toxic dinoflagellates in the Virgin Islands[A]//Anderson D M. Toxic Dinoflagellates.New York:Elsevier, 1985: 171-176.
[25]Steve L M, Dean R N, Jeffrey W B. Effect of temperature, salinity and light intensity on the growth and seasonality of toxic dinoflagellates associated with ciguatera [J]. J Exp Mar Biol Ecol, 1992, 157: 79-90.
[26]董正臻, 董振芳, 丁德文. 快速测定藻类生物量的方法探讨[J]. 海洋科学, 2004, 28(11): 1-5.
[27]侯建军, 黄邦钦, 戴相辉. 赤潮藻细胞计数方法比较研究[J]. 中国公共卫生, 2004, 20(8): 907-908.
