抗真菌转基因水稻秸秆降解对土壤细菌数量及多样性的影响
2012-10-12陈丽华林碧娇李玥仁
陈丽华,吕 新,林碧娇,李 巍,李玥仁
福建省农业科学院中心实验室,福建省精密仪器农业测试重点实验室,福建福州350003
随着转基因作物的大面积种植,其潜在的环境安全性问题备受关注。转基因作物的生态风险评估主要包括靶标害虫对转基因作物的抗性、转基因作物对非靶标生物的影响、转基因作物对生物多样性及环境生态系统的影响、转基因作物与近缘物种之间的基因漂移等(郭建英等,2008;王振等,2007)。其中,转基因作物的外源基因和基因表达产物通过根系分泌物和残体降解进入土壤生态系统,可能对土壤微生物群落组成以及土壤生态系统造成影响(宋亚娜等,2012;王振等,2007),因此,该领域的内容已成为研究热点。Lin&Pan(2010)通过DGGE分析认为,转抗黄瓜花叶病毒的西红柿对土壤微生物群落的影响非常小。Chun et al.(2011)研究表明,原卟啉氧化酶转基因水稻与非转基因水稻在微生物群落多样性及群落组成上没有差异。陈晓雯等(2011)通过DGGE和Biolog技术分析了转Bt基因水稻对土壤微生物群落结构及功能的影响,结果表明,在水稻不同生育期,转Bt基因水稻与其对照对土壤细菌数量、土壤微生物遗传多样性及功能多样性的影响存在一定差异,但这种差异并不持久。袁红旭等(2005)对转几丁质酶和葡聚糖酶基因的抗真菌水稻七转39种植后根际土壤微生物群落和酶活性进行了分析,发现七转39根际土壤真菌和细菌数量少于非转基因水稻七丝软粘。李本金等(2006)研究表明,与相应非转基因水稻七丝软粘相比,转基因水稻七转39、E90、E10根际土壤细菌、放线菌和真菌数量发生了一定的变化,但差异不显著。
水稻收获后的残茬常重返稻田以提高土壤肥力,但其可能对土壤微生物产生影响。本研究通过室内模拟田间秸秆还田试验,分析抗真菌转基因水稻秸秆降解对土壤细菌数量及多样性的影响,以期为抗真菌转基因水稻的环境安全性评估提供依据。
1 材料与方法
1.1 供试材料
供试土壤取自福建省福州市闽侯县良种场水稻田(未种植过转基因水稻)0~20 cm土层。将取回的土壤剔除杂质后室温下自然晾干,于德国莱驰超离心研磨仪(ZM200)中研磨,过20目筛网后,储存于4℃冰箱备用。土壤为黄红壤,部分理化性状:pH 5.00,总碳20.35 g·kg-1,总氮5.51 g·kg-1,有效磷 27.20 mg·kg-1,速效钾 27.74 mg·kg-1。
供试水稻种子由广东海洋大学提供,分别为含有RC24和β-1,3-Glu基因的双价抗真菌转基因水稻转品8,含RC24、RCH10、RAC22基因的三价抗真菌转基因水稻转品1以及相应非转基因水稻七丝软粘。其中,RC24和RCH10为水稻碱性几丁质酶基因,RAC22为水稻酸性几丁质酶基因,β-1,3-Glu是来源于苜蓿的葡聚糖酶基因。转品1和转品8是通过基因枪法将串联的2~3个外源基因导入七丝软粘中,经多代(R8代)选育,证实外源基因能稳定遗传并对稻瘟病和纹枯病表现出中抗的转基因水稻品系(冯道荣等,1999、2001)。
试验所用秸秆为转品1、转品8和七丝软粘收获后的秸秆,将其晒干后分别剪成小于1 cm的碎段,置于德国莱驰超离心研磨仪(ZM200)中研磨,过10目筛后存于阴凉处备用。
1.2 土壤处理
试验设4个处理(赵勇等,2005):不加秸秆的土壤(S),含50 g·kg-1转品1秸秆的土壤(S-Z1),含50 g·kg-1转品8秸秆的土壤(S-Z8),含50 g·kg-1七丝软粘秸秆的土壤(S-CK)。将样品充分混匀后,分装于25个100 mL的烧杯中,每个烧杯装处理土样50 g,用灭菌的去离子水调节含水量至最大后,室温黑暗培养,进行室内秸秆降解试验。培养过程中通过称重法保持土壤含水量一致。试验设3次重复。
1.3 土壤细菌数量的测定
黑暗培养后0、10、20、30、40、50、90 d 取样,每次每个处理随机取样3次。采用稀释平板法测定可培养细菌数量,培养基为牛肉膏蛋白胨。细菌总数的测定:取一定稀释度的土壤悬液,依次过8、5、3 μm滤膜,去除大部分土壤颗粒,然后参照肖琳等(2004)测定水体中细菌的方法,以吖啶橙染色后在荧光显微镜(Olympus,BX51)上观察并计算土壤悬液的细菌数,最后换算成单位样品中的细菌数。
1.4 土壤细菌群落多样性分析
1.4.1 DNA的提取 称取0.5 g土壤样品,按照FastDNA®SPIN for Soil Kit(MP Biomedicals,LLC.)的步骤提取土壤样品微生物总DNA,并将其置于-20℃保存待用。
1.4.2 PCR扩增 使用细菌通用引物357f和518r(Yu& Morrison,2004)扩增16S rRNA V3区。引物序列:357f为5'-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGGCCTACGGGAGGCAGCAG-3',518r为5'-ATTACCGCGGCTGCTGG-3'。反应体系:5 μL 10 ×Taq-Plus buffer,4 μL dNTPs(2 mmol·L-1),10 μmol·L-1上、下游引物各1 μL,DNA 模板约20 ng,2 U Taq-Plus DNA polymerase,无菌超纯水补足50 μL。以无菌超纯水作为阴性对照。反应条件:94℃3 min;94℃ 1 min,60℃ 1 min,72℃ 2 min,35个循环;72℃ 10 min。PCR扩增产物经1%(w/v)琼脂糖凝胶电泳检测。
1.4.3 DGGE分析 丙烯酰胺凝胶浓度为8%,变性剂梯度为40% ~60%[100%变性剂中包含7 mol·L-1尿素和40%(v/v)去离子甲酰胺]。将凝胶板制做好后,组装放入1×TAE缓冲液中,60℃恒温、90 V恒压下电泳18 h(INGENY phorU-2 system)。待电泳结束后,SYBR Gold避光染色20 min,在 Kodak Gel Logic 2200成像系统下拍照。
1.5 数据处理
采用Microsoft Excel 2003进行数据统计分析与做图,对不同土壤处理采用SPSS 13.0中的随机单位组设计的两因素无重复观察值方差分析进行比较。通过Quantity One软件(Bio-Rad)对DGGE图谱中条带的位置和亮度进行数字化处理,并采用Shannon-Wiener多样性指数(H′)、均匀度(J′)和丰富度(S)来评价土壤样品的细菌群落多样性(李刚等,2011)。

其中,Pi为第i条带灰度占样品总灰度的比率;S为DGGE图谱泳道中的条带数,也称为丰富度。
2 结果与分析
2.1 秸秆降解对可培养细菌数量的影响
秸秆降解过程中,不同处理土壤可培养细菌数量的变化趋势见图1。0~20 d,4种处理的可培养细菌数量均呈上升趋势。20~40 d,S-Z1、S-Z8和S呈下降趋势;而S-CK呈上升趋势。40~90 d,S和S-Z1的变化趋势一致,均为略下降后再上升;而S-Z8和S-CK的变化则完全相反,前者为先上升后下降,后者为先下降后上升。在整个降解过程中,S的可培养细菌数量均最低,且显著低于转基因和非转基因处理(P<0.05)。虽然转基因和非转基因处理的变化趋势有所差别,但是SPSS分析结果表明,两者的土壤可培养细菌数量无显著差异(P>0.05)。
2.2 秸秆降解对细菌总数的影响
秸秆降解过程中,不同处理土壤细菌总数的变化趋势见图2。4种处理均表现相似的变化趋势:0~30 d,缓慢上升;30~40 d,急剧上升,到第40天时达到最大值;40~90 d,急剧下降。在整个降解过程中,空白对照的细菌总数与转基因和非转基因处理之间差异显著 (P<0.05),而转基因与非转基因处理土壤细菌总数之间差异不显著(P>0.05)。

2.3 不同处理土壤细菌群落多样性
对细菌16S rRNA扩增产物的DGGE指纹图谱分析(图3)表明,不同处理土壤间有很强的相似性,大多数为共有条带,且在转基因和非转基因处理之间未发现特异性条带。从表1可以看出,不同温育时间下,4种处理土壤细菌群落的丰富度没有显著差异;在秸秆降解的整个时期,多样性指数和均匀度在4种处理间均无显著差异,但在不同降解时间有所差别,其中,黑暗培养0 d的多样性指数相对最高,黑暗培养40 d的多样性指数次之。
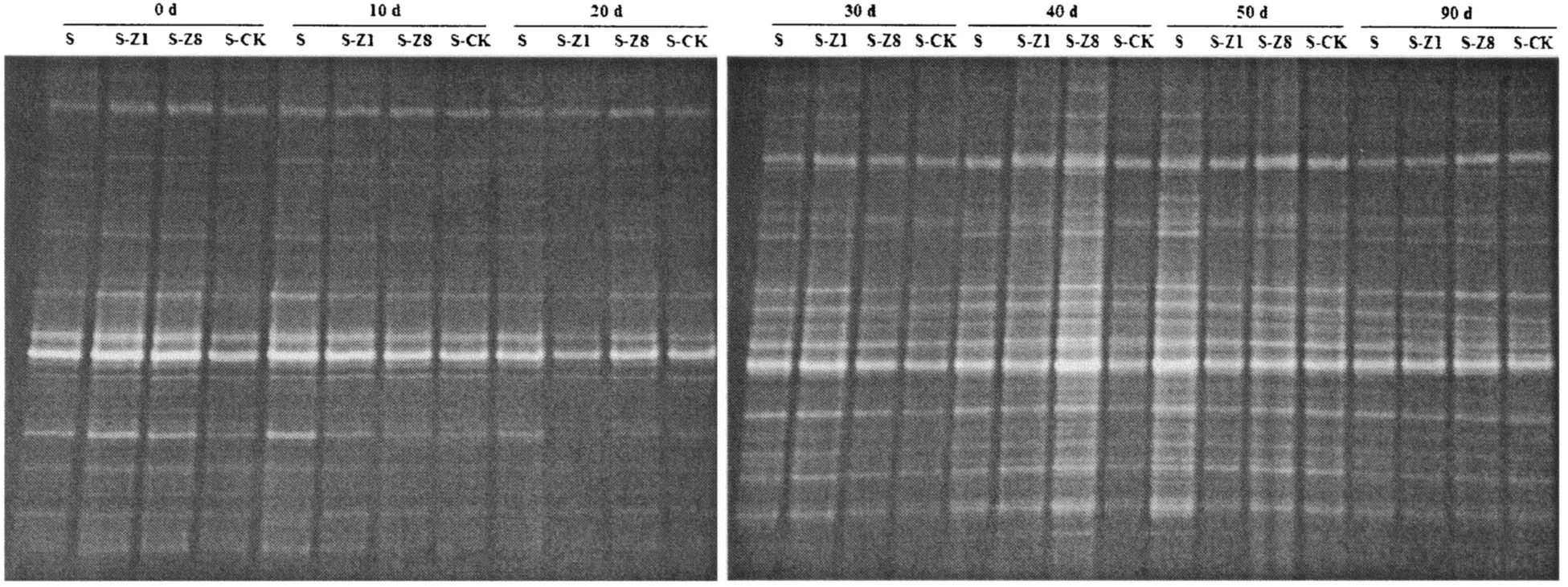
图3 不同处理土壤细菌的PCR-DGGE指纹图谱Fig.3 DGGE fingerprinting of bacteria in different soil treatments
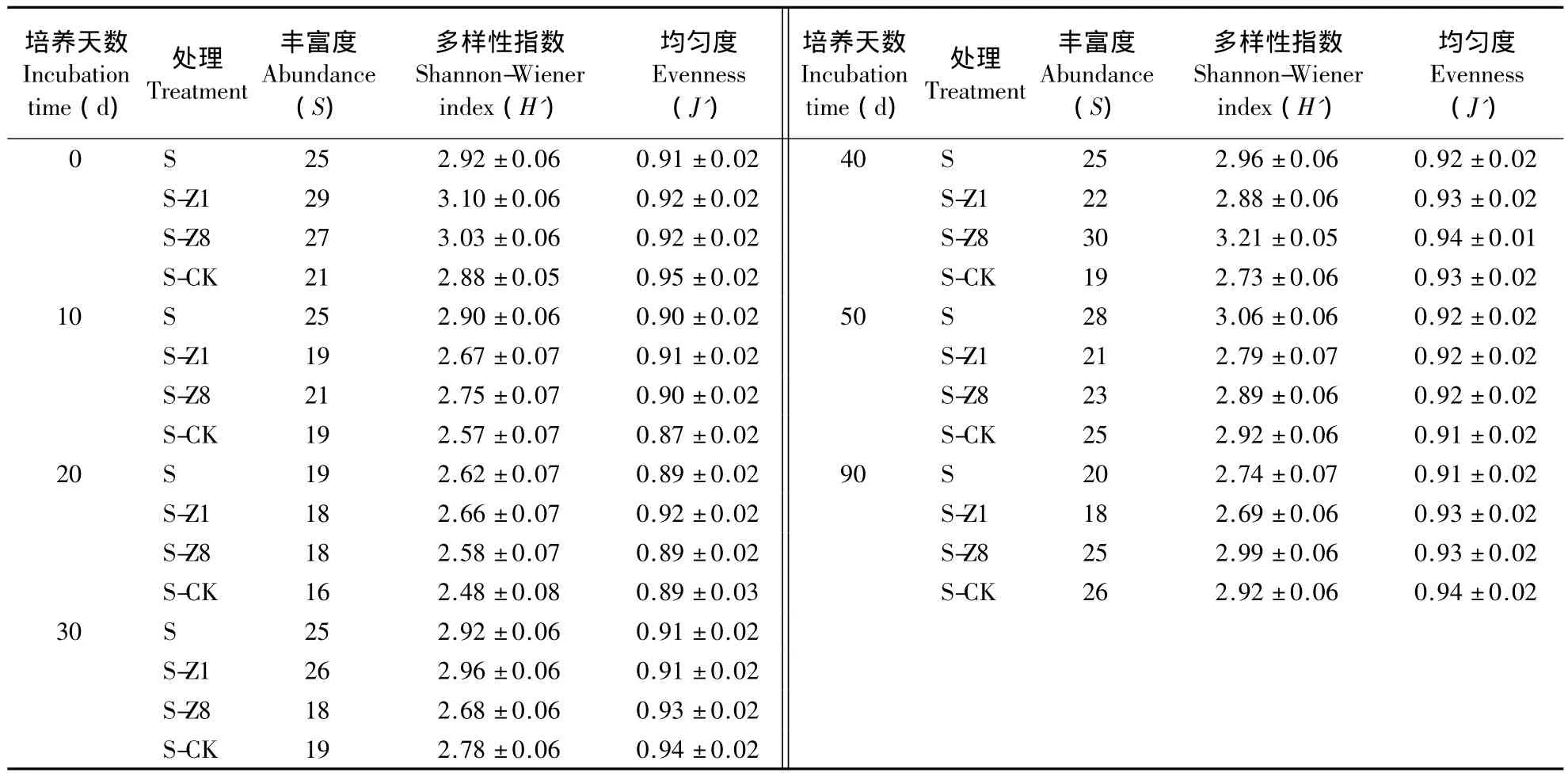
表1 不同处理土壤细菌群落的丰富度、多样性指数和均匀度Table 1 Abundance,Shannon-Wiener index and evenness of bacterial community in different treatments
3 讨论
目前,关于转基因水稻对土壤微生物数量及多样性的影响还存在争议。有研究认为,转基因水稻对土壤微生物没有显著影响(宋亚娜等,2012;Liu et al.,2008;Lu et al.,2010b、2010c);也有研究认为,转基因水稻对土壤微生物存在一定的影响(王洪兴等,2004;Lu et al.,2010a;Wu et al.,2004a、2004b)。本研究结果与前一种观点一致,认为抗真菌转基因水稻秸秆降解对土壤细菌数量的影响不显著(P>0.05),且转基因土壤样品与非转基因土壤样品之间的多样性指数、均匀度和丰富度均无显著差异(P>0.05)。
本试验不仅采用传统的平板计数法测定了土壤中可培养细菌的数量,而且利用表面荧光显微镜直接计数法(epifluorescence direct counting method,FDC)测定了土壤中的细菌总数,比较全面地分析了抗真菌转基因水稻秸秆降解过程中细菌数量的变化情况。对于转基因水稻土壤细菌数量的分析,研究人员一般只测定可培养细菌数(李本金等,2006;王洪兴等,2004)。本研究对土壤样品进行前处理时,先通过振荡培养获得土壤细菌悬浮液,再通过微孔滤膜过滤去除残留的大部分土壤颗粒,从而在荧光显微镜下计数时能比较清楚地计算细菌总数。由于FDC操作过程比较费时,且成本高,本试验在计算细菌总数时,把每次取样时的3个重复样品等量混合成一个样品来制备土壤细菌悬浮液,然后计数至少400个细菌细胞以得到较为精确的结果。此外,由于DGGE图谱条带复杂,DGGE与克隆测序相结合的方法常被用来分析不同处理间微生物菌群的变化。本研究也利用PCR-DGGE技术分析了不同处理土壤细菌多样性的变化情况。笔者还将进一步通过克隆测序分析来明确转基因水稻秸秆降解过程中存在的主要细菌类群。
转基因水稻的种植以及秸秆还田对土壤生态系统的影响是一个长期的过程,其潜在的生态风险可能要在相当长的时期内才能表现出来。因此,有必要对抗真菌转基因水稻做长期的跟踪监测研究,同时应结合其他非生物因素(如土壤类型、气候因子、生长时期等)对其环境安全性进行全面、客观的评价。
陈晓雯,林胜,尤民生,杨广,王锋.2011.转基因水稻对土壤微生物群落结构及功能的影响.生物安全学报,20(2):151-159.
冯道荣,许新萍,李宝键.2001.转多基因水稻植株的获得.植物生理学报,27(4):331-336.
冯道荣,许新萍,卫剑文,李宝键,杨祈云,朱小源.1999.使用双抗真菌蛋白基因提高水稻抗病性的研究.植物学报,41(11):1187-1191.
郭建英,万方浩,韩召军.2008.转基因植物的生态安全性风险.中国生态农业学报,16(2):515-522.
李本金,李玥仁,胡奇勇,郑宇,胡习斌.2006.抗真菌转基因水稻对根际土壤微生物群落的影响.福建农林大学学报:自然科学版,35(3):319-323.
李刚,赵建宁,杨殿林.2011.抗草甘膦转基因大豆对根际土壤细菌多样性的影响.中国农学通报,27(1):100-104.
宋亚娜,苏军,林艳,王锋.2012.转cry1Ac/cpti基因水稻对土壤氨氧化细菌群落组成和丰度的影响.生物安全学报,21(1):67-73.
王洪兴,陈欣,唐建军,叶庆富,王忠华.2004.转Bt基因水稻秸秆降解对土壤微生物可培养类群的影响.生态学报,24(1):89-94.
王振,赵廷昌,刘学敏,邓欣.2007.转基因作物对土壤微生物多样性影响.植物保护,33(4):15-20.
肖琳,杨柳燕,尹大强,张敏跃.2004.环境微生物实验技术.北京:中国环境科学出版社.
袁红旭,张建中,郭建夫,许新萍,李玥仁.2005.种植转双价抗真菌基因水稻对根际微生物群落及酶活性的影响.土壤学报,42(1):122-126.
赵勇,李武,周志华,张晓君,潘迎捷,赵立平.2005.秸秆还田后土壤微生物群落结构变化的初步研究.农业环境科学学报,24(6):1114-1118.
Chun Y J,Kim H J,Park K W,Jeong S C,Lee B,Back K,Kim H M and Kim C G.2011.Two-year field study shows little evidence that PPO-transgenic rice affects the structure of soil microbial communities.Biology and Fertility of Soils,DOI:10.1007/s00374-011-0626-5.
Lin C H and Pan T M.2010.PCR-denaturing gradient gel electrophoresis analysis to assess the effects of a genetically modified cucumber mosaic virus-resistant tomato plant on soil microbial communities.Applied and Environmental Microbiology,76:3370-3373.
Liu W,Lu H H,Wu W X,Wei Q K,Chen Y X and Thies J E.2008.Transgenic Bt rice does not affect enzyme activities and microbial composition in the rhizosphere during crop development.Soil Biology and Biochemistry,40:475-486.
Lu H H,Wu W X and Chen Y X.2010a.Effect of cry1Ab gene transformation on the microbial mediated decomposition of rice residues under intensive rice cropping system.Molecular Environmental Soil Science at the Interfaces in the Earth′s Critical Zone,5:325-327.
Lu H,Wu W,Chen Y,Wang H,Devare M and Thies J E.2010b.Soil microbial community responses to Bt transgenic rice residue decomposition in a paddy field.Journal of Soils and Sediments,10:1598-1605.
Lu H,Wu W,Chen Y,Zhang X,Devare M and Thies J E.2010c.Decomposition of Bt transgenic rice residues and response of soil microbial community in rapeseed-rice cropping system.Plant and Soil,336:279-290.
Wu W X,Ye Q F,Min H,Duan X J and Jin W M.2004a.Bt-transgenic rice straw affects the culturable microbiota and dehydrogenase and phosphatase activities in a flooded paddy soil.Soil Biology and Biochemistry,36:289-295.
Wu W X,Ye Q F and Min H.2004b.Effect of straws from Bttransgenic rice on selected biological activities in water-flooded soil.European Journal of Soil Biology,40:15-22.
Yu Z T and Morrison M.2004.Comparisons of different hypervariable regions of rrs genes for use in fingerprinting of microbial communities by PCR-denaturing gradient gel electrophoresis.Applied and Environmental Microbiology,70:4800-4806.
