CM-Dil体外标记骨髓间充质干细胞及其在烧伤大鼠模型肠组织内的示踪
2012-10-10孟春阳周煜博王冬耀杨小玉
尹 飞,郭 丽,孟春阳,周煜博,张 晗,王冬耀,杨小玉
(1.吉林大学第一医院脊柱外科,吉林 长春 130021;2.吉林大学公共卫生学院毒理学教研室,吉林 长春 130021;3.吉林大学中日联谊医院骨科,吉林 长春 130033)
严重烧伤一直是困扰医学界的难题,目前由于治疗措施的改善,直接因为休克或感染死亡的人数日益减少,主要死因是脏器功能衰竭。肠道是严重烧伤后最早发生低灌注的器官,也是对缺血、缺氧最为敏感的器官之一,是最先受累和损伤较重的内脏器官[1]。目前严重烧伤以对症支持治疗等为主,但是效果不理想,间充质干细胞(mesenchymal stem cells,MSCs)的发现为其治疗带来了新希望。MSCs是属于中胚层的一类多能干细胞,主要存在于人类、鸟类、啮齿类等动物的骨髓中,具有进入体内后可定位于受损部位并修复其损伤的作用[2-3]。但是采取何种有效的标记方法追踪移植细胞在体内的分布和定植成为探讨MSCs修复严重烧伤机制的前提。目前标记移植干细胞的方法主要有两种:一种是传统的标记方法,另一种是分子影像学技术。传统的标记物主要有胞浆标记物、核酸标记物和改变细胞基因使其表达特异性的标志物3种。影像学技术目前主要有光学成像、核医学分子显像活体示踪和磁共振细胞成像活体示踪3种技术[4]。氯甲基苯甲酰胺(chloromethyl-benzamidodialkyl-carbocyanine,CM-Dil)是一种亲脂性荧光染料,容易嵌入生物质膜内并在膜内做侧向扩散运动而标记整个细胞,在标记细胞内消失慢[5]。本文作者拟探讨CM-Dil体外标记骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSCs)的情况及标记后干细胞在严重烧伤模型大鼠肠组织内的定植情况,为BMSCs进一步修复严重烧伤大鼠的肠损伤提供实验依据。
1 材料与方法
1.1 试 剂DMEM-F12(美国Gibco公司);胎牛血清(美国HyClone公司);维甲酸(retinoic acid,RA,美国Sigma公司);碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、表皮生长因子(epidermal growth facto,EGF)均为美国PeproTech公司产品;神经元特异核蛋白(NeuN)、S-P试剂盒和DAB显色剂(福州迈新生物技术开发有限公司);兔抗神经细胞特异性标志微管相关蛋白-2(MAP-2,北京博奥森生物技术有限公司);CM-Dil(美国Invitrogen公司);Hoechst33342(美国Sigma公司);CCK-8试剂盒(上海炎衫化工科技有限公司)。
1.2 实验动物健康雄性成年Wistar大鼠,体质量(220±20) g,1周龄Wistar大鼠均购于吉林大学实验动物中心,合格证号:SCXK-(吉)2008-0005。
1.3 BMSCs的分离和培养1周龄Wistar大鼠脱颈处死后无菌取出股骨和胫骨,用DMEM-F12培养基冲出骨髓于培养皿内,过4号针头,制成单细胞,以1×106mL-1的细胞密度接种于75 mL培养瓶中,37℃、5%CO2饱和湿度孵箱培养。72 h后首次换液,7 d传代。细胞70%~80%融合后0.25%胰蛋白酶消化传代,每2~3 d传代1次。
1.4 诱导BMSCs分化为神经元样细胞取第4代细胞,以每孔1×105个细胞密度接种于铺有涂多聚赖氨酸的盖玻片的24孔培养板中,培养24 h后更换培养液,加入无血清DMEM-F12培养液培养。2 d后加入含10 μg·L-1bFGF、10 μg·L-1EGF和15%FBS的DMEM-F12培养液继续培养。3 d后加入含1 μmol·L-1的RA培养。3 d后取出盖玻片,免疫细胞化学法检测神经元表面标志NeuN和MAP-2 的表达。
1.5 免疫细胞化学法检测神经元表面标志NeuN和MAP-2 的表达1% TritonX-100 PBS溶液孵育20 min,内源性过氧化酶阻断剂室温孵育10 min,动物非免疫血清封闭10 min,第一抗体4℃孵育过夜,生物素标记的第二抗体孵育,链霉素抗生物素蛋白-过氧化酶孵育30 min,DAB显色数秒,苏木精复染,脱水、透明,树脂封片。
1.6 CCK-8法检测CM-Dil对BMSCs的细胞毒性作用取生长良好的第4代细胞,以每孔细胞密度5×103个接种于96孔培养板,每组4个复孔,每孔加入完全培养基200 μL,37℃、5%CO2条件下培养24 h后,分别加入终浓度为4、6和8 mg·L-1的CM-Dil冰浴15 min,每孔加入10 μL CCK-8溶液,37℃孵育4 h。酶标仪测定450 nm各孔的吸光度(A)值。同时设置空白孔(加培养基和CCK-8溶液,无细胞)和对照孔(不含CM-Dil培养基和CCK-8溶液,有细胞)。细胞活力(%)=(加药细胞A值-空白A值)/(对照细胞A值-空白A值)×100%。
1.7 检测CM-Dil标记BMSCs的标记率取生长良好的第4代细胞,胰酶消化后制成单细胞悬液,加入终浓度为4 mg·L-1CM-Dil冰浴15 min,流式细胞仪分析标记率。
1.8 烧伤大鼠模型建立Wistar大鼠用8%的硫化钠进行全身30%脱毛处理,脱毛处理24 h后,用10%水合氯醛进行麻醉(3 mL·kg-1),麻醉后,将大鼠脱毛部分浸入(97±1)℃水中18 s。
1.9 BMSCs的移植收取细胞,过4号针头,制成单细胞,离心去上清。以4 mg·L-1CM-Dil溶液标记细胞,PBS洗3次。分别于烧伤后30 min和24 h后经球后静脉移植BMSCs,每次移植5×106个细胞,体积0.1 mL。模型组给予同等剂量的PBS溶液。
1.10 肠组织冰冻切片制备及激光共聚焦显微镜观察细胞移植烧伤大鼠2周和6个月后,取大鼠肠组织,中性甲醛溶液固定1 d,25%~30%蔗糖溶液沉淀1 d。将沉淀好的肠组织进行冰冻切片,5 mg·L-1Hoechst 33342染色,激光共聚焦显微镜下进行观察。
2 结 果
2.1 大鼠BMSCs的体外培养原代培养中,细胞种植后3 h贴壁。3 d 首次换液后,贴壁细胞增多,形态为梭形和三角形。7 d左右胰酶消化传代,传代后的细胞生长速度较快,每3~4 d可传代1次。
2.2 诱导BMSCs分化为神经元样细胞BMSCs加入含bFGF、EGF和 RA培养后,部分细胞出现长的突触,免疫细胞化学结果显示:诱导组有NeuN和MAP-2 阳性细胞表达,对照组未见阳性表达细胞,表明骨髓MSCs经诱导后分化为神经元样细胞,见图1(插页一)。
2.3 CCK-8法检测CM-Dil对BMSCs的细胞毒性作用8 mg·L-1CM-Dil组细胞毒性显著高于对照组(P<0.05)。与对照组比较,4和6 mg·L-1组差异无统计学意义(P>0.05),但是6 mg·L-1组细胞活力下降,因此4 mg·L-1被确定为移植细胞的标记浓度。见表1。倒置显微镜下观察,4 mg·L-1CM-Dil标记后细胞形态无变化。
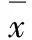
表1 CCK-8法检测CM-Dil 标记后BMSCs细胞活力的变化
2.4 流式细胞仪检测细胞标记率4 mg·L-1CM-Dil标记BMSCs后,流式细胞仪检测标记率为93.9%。见图2。
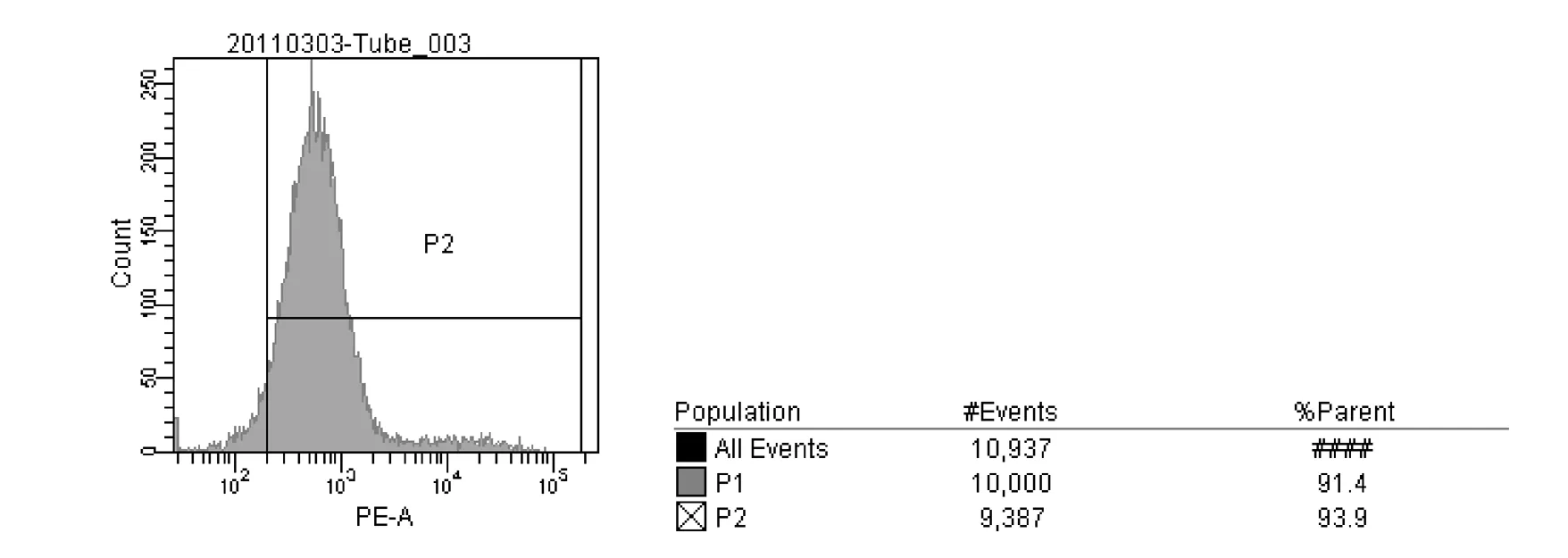
图2 流式细胞仪检测4 mg·L-1 CM-Dil对BMSCs的标记率
2.5 荧光显微镜观察CM-Dil标记的BMSCsCM-Dil标记细胞后,荧光显微镜下可见BMSCs细胞胞浆发出红色荧光。见图3(插页一)。
2.6 激光共聚焦显微镜观察BMSCs在肠组织内的分布激光共聚焦显微镜观察发现:细胞移植后2周可见标记的干细胞定位在受损伤的肠组织区中,出现红色荧光标记细胞,并可见细胞结构,表明被CM-Dil标记的BMSCs已定植到受损伤的肠组织内;细胞移植后6个月,在小肠组织中仍可观察定植的干细胞。见图4(插页二)。
3 讨 论
本实验结果显示:8 mg·L-1组细胞毒性显著高于对照组,4和6 mg·L-1组差异无统计学意义,6 mg·L-1组细胞活力下降(86.41%),因此选用4 mg·L-1进行标记;流式细胞仪结果显示:标记率为93.9%,提示绝大多数BMSCs已被标记,能够达到其在体内示踪的要求;激光共聚焦显微镜观察发现:移植后2周出现红色荧光标记细胞,并可见到细胞结构,可见标记的干细胞定位在受损伤的肠组织区中,表明被CM-Dil标记的BMSCs已定植到受损伤的肠组织内,细胞移植后6个月,在小肠组织中仍可观察到定位的干细胞。
关于干细胞移植示踪的方法有多种。亲脂性碳花青荧光膜染料CM-Dil是目前最好的荧光示踪染料,能够与含肽和蛋白质的硫氢基相结合,可通过活体细胞的胞饮作用进入胞质,从而标记整个细胞质[6-8],其荧光激发波长为553 nm,激发后可发出波长570 nm红色荧光。已有研究[9]表明:CM-Dil标记的BMSCs能够在体内示踪长达30 d,而且经过固定和石蜡包埋过程后仍然可检测到,是一种使用方便、标记稳定的荧光膜染料。Zong 等[10]将CM-Dil 标记的人MSCs 的乳酸-羟基乙酸共聚物(poly-lactic-co-glycolic acid,PLGA)支架移植到大鼠颅骨缺损部位,10周后荧光显微镜下仍可检测到标记细胞。本研究结果表明:CM-Dil标记的细胞可再体内示踪达6个月。
MSCs主要存在于结缔组织和器官间质中,如骨髓、骨骼肌、脐血、胎盘及脂肪组织等,具有强大的增殖能力和多向分化潜能,在适宜的体内或体外环境下可分化为肌细胞、肝细胞、成骨细胞及内皮细胞等多种细胞。本实验所培养的BMSCs经诱导后可以分化为神经元样细胞。BMSCs还具有“归巢”的特点,在进入体内后受到许多趋化因子的调控,可定位于受损伤的部位并修复损伤。近几年,大量实验证实了BMSCs能够定位于受损的心肌组织并能修复损伤,修复心脏损伤的机制包括分化成新的心肌细胞取代坏死的心肌细胞以及对心脏梗死区域内血管再通起作用等[11-14]。此外,在肝脏、肾脏等疾病研究中,移植后的BMSCs也可定植于相应组织器官内[15-16]。Sémont等[17]将人BMSCs移植进放射性胃肠道损伤的NOD/SCID小鼠中,能促进小鼠小肠结构和功能的快速恢复,延长了小鼠的寿命,这种作用是由于MSCs促进了小肠上皮的更新;通过免疫组织化学检测Ki67和TUNEL染色检测凋亡,表明MSCs是通过促进放射性损伤的小肠上皮细胞的增殖和抑制凋亡来重建细胞的内稳态,从而有利于小肠组织的重建。
本研究中CM-Dil标记的BMSCs通过球后静脉移植后,能够长期定位于受损的大鼠肠组织内,表明CM-Dil标记的BMSCs可以用于烧伤大鼠的肠组织定植的示踪研究。
[参考文献]
[1]杨宗诚.烧伤早期脏器损害发病机制的探讨 [J].解放军医学杂志,1998,23(2): 84-87.
[2]丁国永,郭 丽,杜忠君,等.骨髓间充质干细胞对肾缺血再灌注损伤后肾功能及氧化应激水平的改善作用 [J].吉林大学学报: 医学版,2009,35(4): 587-590.
[3]丁国永,傅 强,卢日峰,等.骨髓间充质干细胞移植促肾缺血-再灌注损伤修复的机制初探 [J].细胞与分子免疫学杂志,2009,25 (8): 690-694.
[4]段 峰,王茂强.干细胞标记示踪技术的研究进展 [J].国际医学放射学杂志,2009,32(6): 563-566.
[5]Weir C,Morel-Kopp MC,Gill A,et al.Mesenchymal stem cells: isolation,characterisation and in vivo fluorescent dye tracking [J].Heart Lung Circ,2008,17(5):395-403.
[6]Wei H,Ooi TH,Tan G,et al.Cell delivery and tracking in post-myocardial infarction cardiac stem cell therapy: an introduction for clinical researchers [J].Heart Fail Rev,2010,15(1):1-14.
[7]Schormann W,Hammersen FJ,Brulport M,et al.Tracking of human cells in mice [J].Histochem Cell Biol,2008,130(2):329-338.
[8]Hu KX,Wang MH,Fan C,et al.CM-DiI Labeled Mesenchymal stem cells homed to thymus inducing immune recovery of mice after haploidentical bone marrow transplantation[J].Int Immunopharmacol,2011,11(9):1265-1270.
[9]钟跃思,林 楠,潘楚芝,等.氯甲基苯甲酰氨荧光染料标记大鼠骨髓间质干细胞的体内示踪 [J].中国组织工程研究与临床康复,2008,12(51): 10090-10094.
[10]Zong C,Xue D,Yuan W,et al.Reconstruction of rat calvarial defects with human mesenchymal stem cells and osteoblast-like cells in poly-lactic-co-glycolic acid scaffolds [J].Eur Cell Mater,2010,20:109-120.
[11]Miyahara Y,Nagaya N,Kataoka M,et al.Monolayered mesenchymal stem cells repair scarred myocardium after myocardial infarction [J].Nat Med,2006,12(4): 459-465.
[12]Berry MF,Engler AJ,Woo YJ,et al.Mesenchymal stem cell injection after myocardial infarction improves myocardial compliance [J].Am J Physiol Heart Circ Physiol,2006,290(6): H2196-203.
[13]Tang J,Xie Q,Pan G,et al.Mesenchymal stem cells participate in angiogenesis and improve heart function in rat model of myocardial ischemia with reperfusion [J].Eur J Cardiothorac Surg,2006,30(2): 353-361.
[14]Sato T,Iso Y,Uyama T,et al.Coronary vein infusion of multipotent stromal cells from bone marrow preserves cardiac function in swine ischemic cardiomyopathy via enhanced neovascularization [J].Lab Invest,2011,91(4):553-564.
[15]Vosough M,Moslem M,Pournasr B,et al.Cell-based therapeutics for liver disorders [J].Br Med Bull,2011,100:157-172.
[16]Asanuma H,Meldrum DR,Meldrum KK.Therapeutic applications of mesenchymal stem cells to repair kidney injury [J].J Urol,2010,184(1):26-33.
[17]Sémont A,Mouiseddine M,François A,et al.Mesenchymal stem cells improve small intestinal integrity through regulation of endogenous epithelial cell homeostasis[J].Cell Death Differ,2010,17(6):952-961.
