脱氧胞苷激酶对HeLa细胞放化疗敏感性的影响
2012-10-10刘晓冬徐慧英孔德娟贺梦子贾立立马淑梅
梁 冰,刘晓冬,徐慧英,信 瑞,孔德娟,贺梦子,贾立立,徐 波,马淑梅
(吉林大学公共卫生学院 卫生部放射生物学重点实验室,吉林 长春 130021)
子宫颈癌是仅次于乳腺癌的全球第二种最常见的妇科恶性肿瘤,而且发展中国家所占发病比例极高(> 80%)[1],严重危害妇女的健康与生命。目前,放疗作为宫颈癌治疗的常规手段,广泛地应用于临床,而化疗因其作用效果存在争议,应用范围较小。据统计约有80%的宫颈癌患者需要以放射治疗作为单独治疗或综合治疗,虽然早期患者放射治疗效果较好,但是中、晚期患者的治疗效果仍较差,主要原因是辐射敏感性不理想等问题。因此,如何提高肿瘤的放射敏感性,成为当前宫颈癌治疗的关键问题之一。近年来,随着分子生物学的发展,发现某些基因的表达在分子水平上影响着肿瘤细胞的放射敏感性。脱氧胞苷激酶(deoxycytidine kinase,DCK)是脱氧核苷酸生物合成补救途径中的关键酶,在维持正常的脱氧核苷库方面起着重要的生理学作用。大量研究[2-3]发现:电离辐射和其他基因毒性因子刺激可引起细胞DCK激酶活性增高而促进DNA损伤的修复。目前,有关RNA干扰技术沉默HeLa细胞DCK基因改变其放化疗敏感性的研究尚未见报道。本研究利用干扰技术特异性地阻断DCK 基因在宫颈癌细胞中的表达,观察其对人宫颈癌细胞药物敏感性及辐射敏感性的影响,为宫颈癌的基因治疗提供新的靶点和思路。
1 材料与方法
1.1 主要试剂与仪器实时定量PCR所需引物及RNAiso plus、SYBR Premix Ex Taq试剂盒(荧光为SYBR Green Ⅰ)等均购自大连宝生物公司。DCK一抗为英国Abcam公司产品;GAPDH一抗、增强化学发光法(ECL)发光试剂盒等为Santa Cruz 公司产品;羊抗兔及兔抗鼠二抗购自北京中山金桥公司。
1.2 细胞培养与照射人宫颈癌细胞HeLa由本实验室保存,用DMEM培养基(含10%FBS及青霉素与链霉素各100 U·mL-1),37℃、5%CO2培养箱中培养。照射采用国产X.S.S.205(FZ)型固定式X射线深部治疗机,滤板0.5 mm Cu+1.0 mm Al。照射条件为靶皮距600 mm,吸收剂量率0.41 Gy·min-1。
1.3 细胞转染细胞计数并在含血清、但不含抗生素的正常培养基中铺板,转染当天细胞密度达到50%~80%。取FuGENE 6 30 μL,用无血清培养基稀释到100 μL,混匀孵育5 min,10 μg DCK siRNA质粒(由美国Methodis Hospital Research Institute,徐教授惠赠)用无血清培养基稀释至100 μL,二者混匀并孵育30 min,逐滴加入HeLa细胞中,转染48 h后用浓度为1 mg·L-1嘌呤霉素筛选至阳性克隆出现。
1.4 实时定量PCR检测DCK基因表达根据GenBank中序列设计引物,目的基因引物序列:DCK,5′-TGCAGGGAAGTCAACATT-3′和5′- TCCCACCATTTTTCTGAG-3′;内参GAPDH引物序列,5′-GCACCGTCAAGGCTGAGAAC-3′和5′-CATTCCATTCCACGGGAACAC-3′。PCR扩增条件:95℃预变性30 s,95℃变性20 s,60℃退火延伸20 s;循环45次。以假照组为校正样本,按照ΔΔCt解析法来进行目的基因与管家基因的相对定量。
1.5 Western blotting检测DCK蛋白的表达收集细胞,加入适量含有PMSF单去污裂解液,冰浴30 min,12 000 r·min-1离心5 min,取上清移入新Ep管中。蛋白煮沸5 min进行变性,用10%的SDS聚丙烯酰胺凝胶电泳分离蛋白,电转移至硝酸纤维素滤膜上,5%脱脂牛奶封闭1 h,一抗于 4°C摇床过夜,二抗反应90 min,ECL化学发光法显色,X光胶片显影。
1.6 细胞增殖情况测定取指数生长期的3组细胞,计数后按1×104接种于12孔板内,分别于24、48、72、96、120、144、168、192 h计数孔内细胞总数,每个时间点设3个复孔。
1.7 MTT检测细胞药物敏感性将空白对照组、阴性对照组及DCK siRNA组的HeLa细胞以4 000个/孔数量接种于96孔板。AraC药物组:浓度分别为0、0.05和0.1 μmol·L-1;每个浓度设3个复孔,药物作用48 h后检测细胞存活率。选择490 nm波长,酶标仪测定各孔吸光度(A)值,细胞存活率(%)=实验组A值 /对照组A值×100%,设对照组细胞存活率为1。
1.8 克隆形成实验检测细胞辐射敏感性将750、2 000、4 000、6 000、8 000个/皿细胞分别接种于6孔板中,每组均设3复孔,分别照射0、2、4、6、8 Gy,37℃、5%CO2培养箱中培养10 d,弃掉培养基,PBS小心清洗,甲醇固定30 min,GIEMSA染色10 min,自然晾干后计数≥50个细胞的单克隆数,计算克隆形成率及存活分数。克隆形成率(%)=(克隆细胞数/接种细胞数)×100%,存活分数=照射后细胞的克隆形成率/未受照射细胞的克隆形成率。
2 结 果
2.1 转染前后细胞中DCK mRNA的表达实时定量PCR结果显示:转染HeLa后,siRNA组DCK mRNA表达水平(0.38±0.08)与空白对照组及阴性对照组(1.00±0.12和0.89±0.15)比较均明显降低,差异有统计学意义(P<0.05);2个对照组间DCK mRNA表达水平接近,差异无统计学意义(P>0.05),表明DCK siRNA对DCK基因的干扰沉默作用具有特异性。
2.2 转染前后细胞中DCK蛋白的表达Western blotting结果显示:转染后siRNA组DCK蛋白表达水平(0.22±0.05)与空白对照组及阴性对照组(1.00±0.07和0.96±0.12)比较均明显降低,差异有统计学意义(P<0.05);2个对照组间DCK蛋白表达水平比较差异无统计学意义(P>0.05)。与DCK mRNA的表达结果一致。见图1。
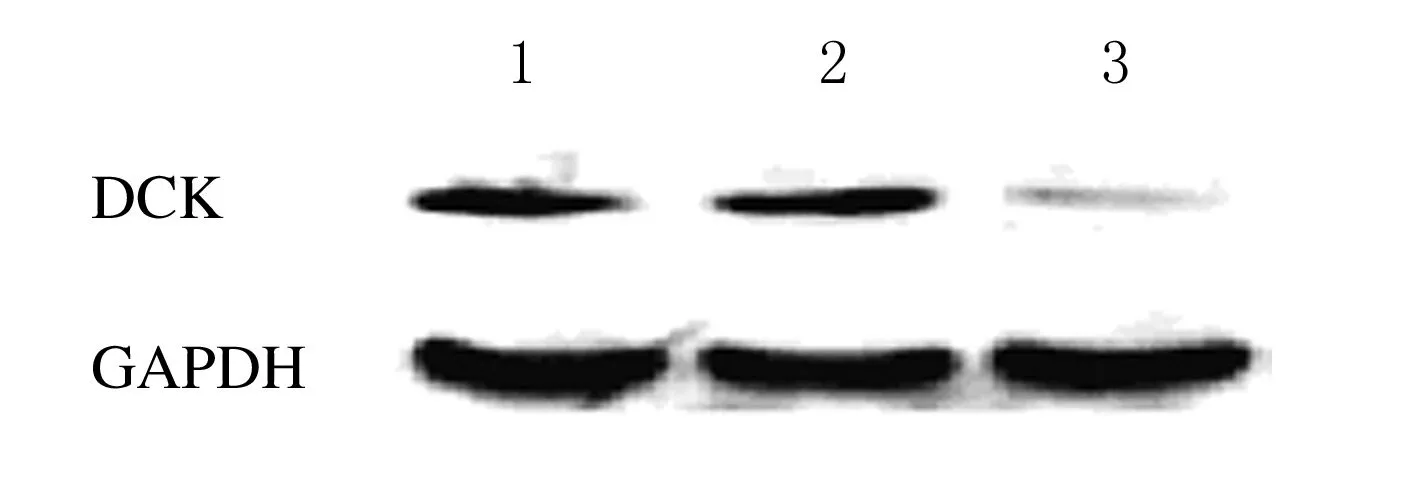
图1 DCK蛋白表达结果
2.3 细胞增殖情况测定结果为了比较空白对照组、阴性对照组及DCKsiRNA组的HeLa细胞生长速度是否存在差异,采用细胞计数的方法对不同时间的3组细胞的增殖进行监测,结果显示:3组细胞的增殖速度接近,差异无统计学意义(P>0.05)。见表1。
表1 不同时间各组HeLa细胞的增殖情况
2.4 沉默DCK后Hela细胞药物敏感性的变化MTT结果显示: AraC药物作用后48 h,siRNA组细胞存活分数明显高于阴性对照组及空白对照组,差异有统计学意义(P<0.05);而2个对照组HeLa细胞的细胞存活分数比较差异无统计学意义(P>0.05)。见表2。
表2 不同剂量AraC作用下HeLa细胞的存活分数
2.5 沉默DCK后宫颈癌细胞辐射敏感性的变化克隆形成结果显示:siRNA组细胞存活分数明显少于阴性对照组及空白对照组,差异有统计学意义(P<0.05);而2个对照组HeLa细胞的细胞存活分数无明显差异(P>0.05)。见表3。
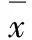
表3 不同剂量电离辐射作用下HeLa细胞的存活分数
3 讨 论
DCK基因位于染色体的 4q13.3-q21.1,约含有2 618 bp,是一种相对分子量为61 000的磷酸激酶,包括2个30 500的相同亚基。DCK表达水平具有组织特异性,胸腺和白血病的T淋巴细胞中的DCK活性要比其他类型细胞中同一种酶的活性高。其主要存在于细胞质内,集中在细胞核周围和细胞膜区域,如果DCK过量表达,则主要集中在细胞核内。DCK作为磷酸激酶,显示出广泛的底物特异性,除了自然产生的dAdo、dGuo及dCyd外,DCK还是AraC、CNDAC等核苷类化疗药物活化的限速酶和关键酶。DCK 活性降低或丧失,可导致细胞对一系列化疗药物产生耐药。研究[4-6]表明:肿瘤耐药细胞中存在一个或多个DCK基因结构的突变,或者基因的高度甲基化,导致DCK表达降低或不表达,从而使AraC和CNDAC等药物活化受抑制,导致肿瘤细胞对化疗药物敏感性降低。有学者用逆转录病毒或腺病毒将DCK基因导入细胞增加DCK的活性,可以提高细胞对药物的敏感性。动物实验[7]也显示:通过基因转染方式增加DCK活性,动物在给予抗癌药吉西他滨后,肿瘤体积缩小。本实验结果显示:DCK siRNA组细胞中DCK mRNA及蛋白的表达水平与空白对照组及阴性对照组比较明显降低;细胞计数法检测结果提示,沉默DCK基因对细胞生长无明显影响;AraC作用48 h后siRNA组中细胞存活分数明显高于阴性对照组及空白对照组,由于DCK被沉默后降低AraC药物磷酸化,抑制其活化,进而减弱细胞毒性作用[8-9]。提示沉默DCK的HeLa细胞对AraC的药物敏感性降低。
放射治疗是恶性肿瘤治疗的主要手段,单纯放射治疗常导致治疗失败,加大放疗剂量则导致正常组织的放射性损伤,研究[10]表明:肿瘤细胞对放疗的敏感性可能是决定放射治疗疗效的关键因素。影响肿瘤放射敏感性的因素有很多,包括DNA双链断裂修复效率、细胞周期阻滞和细胞凋亡等,由于电离辐射对DNA的主要损伤形式是DNA双链断裂,所以DNA 双链断裂修复效率被认为是影响放疗敏感性的首要决定因素[11]。研究显示:DCK与肿瘤细胞放射敏感性密切相关;van Den Neste等[12]发现:用B-CLL细胞经30 J·m-2UV-C照射30 min后,DCK活性增高3倍,细胞进行积极的DNA损伤修复,证明DCK活性上调有助于细胞对UV引起的DNA损伤修复,因此,DCK可能是肿瘤细胞放射增敏的理想靶点。本实验结果显示:不同剂量电离辐射照射后DCK siRNA组细胞存活分数与对照组比较显著降低,可能是DCK基因的沉默降低了天然脱氧核苷酸底物磷酸化程度,减少了DNA合成补救途径所需的dNTPs底物[13],DNA损伤修复无法完成,使辐射敏感性增加。
本实验结果表明:siRNA阻断DCK mRNA及蛋白的表达,可以降低宫颈癌细胞对药物的敏感性及提高对辐射的敏感性,DCK可以作为对宫颈癌治疗的一个潜在靶点。
[参考文献]
[1]Costa LS,Telles CB,Oliveira RM,et al.Heterofucan from Sargassum filipendula induces apoptosis in HeLa cells [J].Mar Drugs,2011,9(4): 603-614.
[2]Sigmond J,Haveman J,Kreder NC,et al.Enhanced activity of deoxycytidine kinase after pulsed low dose rate and single dose gamma irradiation [J].Nucleosides Nucleotides Nucleic Acids,2006,25(9-11):1177-1180.
[3]Haveman J,Sigmond J,van Bree C,et al.Time course of enhanced activity of deoxycytidine kinase and thymidine kinase 1 and 2 in cultured human squamous lung carcinoma cells,SW-1573,induced by gamma-irradiation [J].Oncol Rep,2006,16(4):901-905.
[4]van Bree C,Castro-Kreder N,Loves WJ,et al.Sensitivity to ionizing radiation and chemotherapeutic agents in gemcitabine-resistant human tumor cell lines[J].Int J Radiat Oncol Biol Phys,2002,54(1):237-244.
[5]Song JH,Kim SH,Kweon SH,et al.Defective expression of deoxycytidine kinase in cytarabine-resistant acute myeloid leukemia cells[J].Int J Oncol,2009,34(4):1165-1171.
[6]Qin T,Jelinek J,Si J,et al.Mechanisms of resistance to 5-aza-2′-deoxycytidine in human cancer cell lines[J].Blood,2009,113(3):659-667.
[7]Braess J,Voss S,Jahns-Streubel G,et al.The pharmacodynamic basis for the increased antileukaemic efficacy of cytosine arabinoside-based treatment regimens in acute myeloid leukaemia with a high proliferative activity[J].Br J Haematol,2000,110(1):170-179.
[8]Réjiba S,Bigand C,Parmentier C,et al.Gemcitabine-based chemogene therapy for pancreatic cancer using Ad-dCK:UMK GDEPT and TS/RRsiRNA strategies [J].Neoplasia,2009,11(7):637-650.
[9]Sigmond J,Bergman AM,Leon LG,et al.Staurosporine increases toxicity of gemcitabine in non-small cell lung cancer cells: role of protein kinase C,deoxycytidine kinase and ribonucleotide reductase[J].Anticancer Drugs,2010,21(6):591-599.
[10]吴晓芬,洪承皎,郭文秀,等.槲皮素对HeLa细胞辐射敏感性影响及其机理[J].辐射研究与辐射工艺学报,2011,29(2):104-108.
[11]Mondello C,Smirnova A,Giulotto E.Gene amplification,radiation sensitivity and DNA double-strand breaks[J].Mutat Res,2010,704(1-3):29-37.
[12]van Den Neste E,Smal C,Cardoen S,et al.Activation of deoxycytidine kinase by UV-C-irradiation in chronic lymphocytic leukemia B-lymphocytes[J].Biochem Pharmacol,2003,65(4):573-580.
[13]Keszler G,Szikla K,Kazimierczuk Z,et al.Selective activation of deoxycytidine kinase by thymidine-5′-thiosulphate and release by deoxycytidine in human lymphocytes[J].Biochem Pharmacol,2003,65(4):563-571.
