pH敏感的分子筛组装体药物缓释性能研究*
2012-10-10李晓丰于霁厚
李晓丰,王 宇,于霁厚
(1.东北石油大学华瑞学院,黑龙江哈尔滨150025;2.哈尔滨师范大学化学化工学院,黑龙江哈尔滨;150025;3.黑龙江省科学院石油化学研究院,黑龙江哈尔滨150040)
介孔分子筛是指孔径为2~50 nm,具有规则有序孔道结构的无机多孔材料。通常以表面活性剂作为模板剂,利用溶胶、凝胶、乳化等化学过程,通过控制有机物和无机物之间的界面作用来合成。介孔二氧化硅材料的研究最早始于1990年[1]。该材料在光学、催化以及药物输送[1~3]等领域都具有潜在的应用价值。由于介孔二氧化硅材料具有稳定的介孔结构、较高的比表面积、孔径分布可调、可修改的表面性质[1,4]、无毒的性质[5],以及良好的生物相容性[6,7],因此常被用来作为缓控释给药载体。此外,由于介孔二氧化硅材料表面含有丰富的自由硅羟基,因而具有良好的化学反应活性,通过表面硅羟基与活性组分相互作用,可将催化活性位引入孔道或骨架,从而可以增加载药量,调节药物的释放[8~10]。
人体各消化器官的pH值各不相同,胃(pH值1.0-3.0)、小肠(pH 值 6.5-7.0)、结肠(pH 值 7.0-8.0)变化,以及在肿瘤组织中(pH值6.5-7.2)。因此,可以设计pH敏感的药物组装体,通过检测周围环境的pH值,来实现药物的靶向释放[4],以达到降低副作用及药物毒性,提高疗效的作用。
盐酸二甲双胍是一种治疗糖尿病的药物,广泛应用于非胰岛素依赖型(Ⅱ型)糖尿病的降糖药,口服后主要通过降低肝及外周组织对胰岛素的敏感度来降低血糖水平。
本文采用原位合成法,利用氰乙基三烷氧基氯硅烷作为修饰剂,在SBA-15的表面用嫁接了-COOH官能团。载入盐酸二甲双胍后,在药物组装体外包裹pH敏感聚合物壳聚糖,合成出一种新型介孔pH敏感材料的控释释放系统。该系统可以根据不同pH值环境,利用-COOH官能团与壳聚糖之间的相互作用,以达到药物的pH值敏感和肠道靶向释放。
1 实验材料和仪器设备
1.1 主要试剂

表1 实验试剂Table1 Reagents used in the experiments
1.2 主要仪器设备
样品的扫描电镜在Hitachi S-4800扫描电子显微镜上进行(加速电压20~30 kV)。紫外用上海光谱仪器有限公司的752型紫外分光光度计。X-射线粉末衍射(XRD)数据在Siemens D5005型衍射仪上收集,管电压40 kV,管电流50 mA,Cu Kα辐射(λ=1.540598 nm),扫描速度 1°/min。氮气吸附 /脱附实验在液氮温度下进行,由Micromeritics ASAP 2010M分析仪上测得。红外光谱在Nicolet Impact 410 FT-IR光谱仪上测定,采用KBr压片(样品占1 wt%),测试范围 400~4000 cm-1,真空脱气至压力小于3×10-4Torr。比表面积采用BET比表面积,孔分布利用BJH方法计算,孔容根据t-plot计算。高分辨透射电镜照片在日本电子公司的JEM-2010透射电子显微镜上进行(加速电压200 kV)。
2 实验部分
2.1 介孔分子筛的合成
SBA-15的合成:将4 g P123加入到30 g水和120 g 2 mol/L HCl混合溶液中,搅拌使其溶解。然后加入8.50 g TEOS搅拌5 min。混合液在35℃静置陈化20 h后,100℃晶化5d。将所得产物洗涤、过滤、室温干燥后550℃焙烧样品5 h除去表面活性剂。
-COOH修饰的SBA-15合成:将2 g P123加入到75 g 2 mol/L HCl中,搅拌使其溶解。然后加入4.50 g TEOS和CTES,35℃搅拌2 h,过滤后用乙醇洗涤3次。将所得产物过滤、室温干燥。将样品加入到50 wt%H2SO4中,在100℃加热24 h,然后产品过滤用去离子水洗涤至中性得到最终产品。
2.2 药物在分子筛中的组装
药物组装的基本过程如下:配置0.1 M的MetH的水溶液,取165 mg的SBA-15样品加入到10 mL的上述溶液中,在室温下搅拌2 h,搅拌过程中仪器要要密封以防止溶剂挥发,再通过室温下真空过滤和干燥来分离载药后的粉末样品。取1.0 mL的滤液适当的稀释后,取一定量进行紫外分光光度计测定,计算得出装载量。
2.3 甲壳素中提取可溶性壳聚糖
取0.5 g的甲壳素溶解在20 g 40%的NaOH溶液中剧烈搅拌10 min,混合物在80℃条件下保持24 h。最后把样品洗涤、过滤取上层清液稀释至50 mL待用。
2.4 рH敏感聚合物的包裹
pH敏感的药物释放系统的包覆Chit/COOH/SBA-15过程如下:取样品约0.18 g在3.0 MP压成直径约为10 mm,厚度约为0.5 mm的片剂。同时取0.32 g的壳聚糖溶解于水溶液中,室温下搅拌。取载药后的COOH/SBA-15的片剂采用蘸取-浸渍法包覆壳聚糖。再把Chit/COOH/SBA-15片剂置于室温下干燥,即得到包覆好的样品。
2.5 药物释放性能测试
药物释放过程中,取不同分子筛片剂样品206 mg,室温37℃下浸泡于500 mL模拟人工胃液(pH=1.2的缓冲溶液)和模拟人工小肠液 (pH=7.4的缓冲溶液)中,经一定时间间隔后吸附一定量(3 ml)释液,同时立即补充等量的模拟人工胃液或者模拟人工小肠液。吸取液用0.45 μm的微孔滤膜过滤,适当稀释,在波长为233 nm紫外法测定药物的释放量。
释放液中所释放布洛芬精确量的计算是根据以下公式进行:
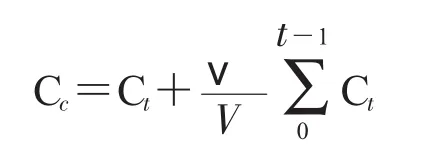
公式中Cc是在t时间时推倒后的浓度,Ct是在t时间时的测定浓度,V是加入释放液体的总体积,ν是吸取释放液的体积。
3 结果讨论
3.1 小角粉末XRD分析
图1-1分别为介孔分子筛修饰前后的小角粉末X射线衍射图。由图可以看出样品修饰前后,在2θ=2°处均出现明显的(100)晶面的衍射峰,与未修饰前比较,羧基修饰后的介孔分子筛在(100)晶面的衍射峰强度明显增强,说明经过羧基修饰后,仍然保持介孔相结构。羧基嫁接后的COOH/SBA-15的衍射峰较之SBA-15的衍射峰稍微低,这是由于羧基嫁接之后孔道塌陷造成的。
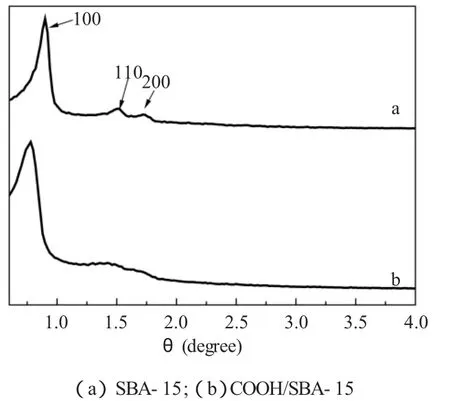
图1样品的小角粉末XRDFig.1 XRDPatterns at low diffraction angles
3.2 氮气吸附/脱附测试分析
图2 a为羧基修饰前后样品的氮气吸附-脱附等温曲线图,由图可见两种样品均为Ⅳ型等温曲线H1型滞后环。图2 b为样品的孔径分布图,由图b可以看出,未修饰的SBA-15平均孔径约为7.1 nm,羧基修饰后孔径下降至约为4.2 nm。

图2 样品的氮气吸附脱附图Fig.2 Sample nitrogen adsorption/desorption isotherm
Table 2为样品的比表面积、孔容及孔径数据。由表中的数据中可知SBA-15具有较大的比表面积(706 m2/g)和孔容(1.08 cm3/g),平均孔径为 (7.1 nm)。羧基修饰后,材料的比表面积 (534 m2/g)和孔容(0.53 cm3/g),孔径(4.2 nm),由此可知,加入修饰剂后孔径变小,相应的比表面积和孔容也随之降低,这可能是由于-COOH嫁接到分子筛中,占据了一部分孔道。这与XRD分析结果相一致。

表2 样品氮气吸附脱附表面积数据Table 2 Parameters of sample nitrogen adsorption/desorption surface area
图3为样品的红外光谱图。由图3 b可知羧基修饰后,波长在1648和3023 cm-1处有两个吸收峰,这分别是羧基集团中C=O的伸缩振动峰和修饰剂中烷基振动峰。说明羧基已经成功嫁接在SBA-15介孔分子筛上。从图3 c可见,波长在1078,1458,和1687 cm-1处有三个振动峰,分别是硅烷化残基C─H的伸缩振动峰,并在807和780 cm-1处出现Si─ C的 υ(C-O-C),δ(N-H)and υ(C=O)伸缩振动峰[11],说明壳聚糖已经包裹分子筛。

图3 样品的红外光谱图Fig.3 IR spectra of samples
3.3 介孔分子筛的组装和释放
图4 是组装不同浓度的MetH(2 h),其组装量随浓度的变化曲线,当浓度达到0.1 mol/L时,两种样品均达到最大组装量。SBA-15的最大载药量为25.32%,而羧基修饰的SBA-15的最大载药量可达52.3%。可见修饰后的SBA-15具有更大的载药量。这是由于修饰后的材料表面富含-COOH,这些基团可与药物分子中的-NH2产生氢键相互作用,增加了分子筛与药物分子之间的作用,即使在比表面积较小的情况下,仍然具有较大的载药量。

图 4 样品最大载药量曲线Fig.4 Sample maximum drug loading curve
图 5 a、b和 c分别表示 SBA-15、COOH/SBA-15和Chit/COOH/SBA-15载药后在pH=4.0以及pH=7.4中的缓释曲线。由图可见SBA-15与COOH/SBA-15在两种pH条件下都具有良好的释放曲线。由SBA-15释放曲线可见,在pH=4.0时盐酸二甲双胍2 h内有43 wt%的首释放,70 wt%经48 h释放完全,与SBA-15相比,盐酸二甲双胍在COOH/SBA-15的释放较慢,盐酸二甲双胍2 h内有29 wt%的首释放,55 wt%经48 h释放完全,COOH/SBA-15体系的释放率要略低于SBA-15,这是因为-COOH基与药物分子中的-NH2在pH=4.0的环境下产生作用力,SBA-15中的孪Si-OH与药物分子的作用力稍弱,因此纯SBA-15体系的释放量要比COOH/SBA-15药物释放体系的释放速度快。然而在pH=7.4的条件下,COOH/SBA-15的初释放率要快于SBA-15,这是由于在微碱性条件下COOH/SBA-15中的羧基与药物分子作用减弱,因此导致COOH/SBA-15的释放率较快。由氮气吸附数据可知,SBA-15的孔道大于COOH/SBA-15,而SBA-15的释放速度在7 h后快于COOH/SBA-15体系。因为COOH/SBA-15具有较小的孔道,介空孔道内部的药物分子较难释放出来,故此在7 h之后COOH/SBA-15的释放速率开始减慢。这表明一定时间之后,介孔分子筛的孔径成为决定药物分子释放的关键。

图5 盐酸二四双胍释放曲线Fig.5 Cumulative release rates of meth
Chit/COOH/SBA-15系统在pH=7.4具有良好的释放曲线,而在pH=4.0时难以释放,主要原因在于壳聚糖分子中富含大量的-NH2基,这些基团与分子筛表面形成氢键堵塞孔道,因此释放率较低。根据Chit/COOH/SBA-15的释放曲线可见该体系在pH 7.4时具有良好的释放性能,但是在pH 4.0时的释放量非常小。在pH 7.4的释放过程中,Chit/COOH/SBA-15体系在1 h释放45%的药物,在经过12 h释放了近50%。在pH 4.0的环境下包裹的分子筛的释放能力明显降低,其经过24 h只释放低于20%的盐酸二甲双胍。这是因为壳聚糖在这个体系起到了pH控制阀的作用。当在低pH环境中,壳聚糖与分子筛上的羧基氢键作用力较强阻塞孔道,因此药物释放量降低;反之当在高pH环境下,壳聚糖与分子筛上的羧基氢键作用力较弱,因此药物释放量升高。
4 结论
本试验主要合成了一个新型的pH敏感的药物靶向释放系统,这个释放系统采用壳聚糖包覆COOH/SBA-15片剂而形成,该系统药物释放在胃液中受到抑制,而尽量多的释放到小肠液中,因此可以针对小肠病变形成靶向释放的效果。从而能够极大地增加了药效,降低毒副作用,该系统将具有很好的应用前景。
[1]Q S HUO,R LEON,P M.PETROFF,et al.Mesostructure Design with Gemini Surfactants-Supercage Formation in a 3-Dimensional Hexagonal Array[J].Science.1995,268∶1324~1327.
[2]G S ALLARD,J C GLYDE,C G GOLINER.Liquid-crystalline Phases as Templates for the Synthesis of Mesoporous Silica[J].Nature.1995,378∶366~368.
[3]X S ZHAO,G Q LU,A K WHITTAKER,et al.Comprehensive Study of Surface Chemistry of MCM-41 Using 29Si CP/MAS NMR,FTIR,Pyridine-TPD and TGA[J].J.Phys.Chem.B,1997,101∶6525~6531.
[4]P T TANEV,M CHIBWE,T J Pinnavaia.Titanium-containing Mesoporous Molecular Sieves for Catalytic Oxidation of Aromatic Compounds[J].Nature.1994,368∶321~323.
[5]Q S.HUO,D L MARGOLESE,U CIESLA,et al.Generalized Synthesis of Periodic Surfactant/Inorganic Composite Materials[J].Nature.1994,368∶317~321.
[6]Q S HUO,D L MARGOLESE,U CIESLA,et al.Organi-zation of Organic Molecules with Inorganic Molecular Species inNanocomposite Biphase Arrays[J].Chem.Mater.1994,6∶1176~1191.
[7]A CORMA.Inorganic Solid Acids and Their Use in Acid-catalyzed Hydrocarbon Reactions [J]..Chem.Rev.1995,95∶559~614.
[8]K SUZUKI,K IKARI,H IMAI.Synthesis of Silica Nanoparticles Having a Well-ordered Mesostructure Using a Double Surfactant System[J]..J.Am.Chem.Soc.2004,126∶462~463.
[9]P T TANEV,T J PINNAVAIA.A Neutral Templating Route to Mesoporous Molecular Sieves[J].Science.1995,267∶865~867.
[10]A MONNIER,F SCHUTH,Q HUO,et al.Cooperative Formation of Inorganic-Organic Interfacesin the Synthesisof Silicate Mesostructures[J].Science.1993,261∶1299~1303.
[11]DONG YANMING,WANG MIAN,WU YUSONG,et al.FTIR Spectroscopic Determinations of Chitosan Derivatives[J].journal of Cellulose Science and Technology.2001,9(2)∶42~56.
