丙戊酸钠逆转组蛋白低乙酰化水平对肝癌细胞侵袭转移的体外实验研究
2012-10-09高峰杨季红张爱民马芳康然
高峰 杨季红 张爱民 马芳 康然
丙戊酸钠(sodium valproate,VPA)是目前临床应用广泛的抗癫痫药物,近期研究发现其具有很强的组蛋白去乙酰化酶抑制剂(histonedeacetylase inhibitor,HDACI)活性[1],其通过逆转组蛋白低乙酰化水平,上调相关抑癌基因表达,起到抑制肿瘤细胞增殖、促进凋亡或者诱导分化,同时还具有抑制肿瘤血管新生、抑制瘤细胞转移的作用[2],在白血病及多种实体瘤中显现出较好的抗肿瘤效应,但其具体作用机制尚未明了。本研究通过观察VPA对体外培养的人肝癌细胞系SMMC-7721细胞凋亡及细胞周期的影响,并观察VPA对该细胞系体外侵袭、迁移和黏附能力的影响以及对乙酰肝素酶(heparanase,HPA)和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)表达的影响,进一步探讨VPA的抗肿瘤机制。
1 材料与方法
1.1 实验材料 人肝癌细胞系SMMC-7721细胞,由中国科学院上海细胞生物所提供。VPA(Sigma公司);RPMI-1640培养基及Trizol试剂(Gibco公司);胎牛血清(FCS)(杭州四季青公司);Annexin-V-FITC凋亡分析试剂盒(Becton Dickinson公司);Matrigel胶、Transwell小室(BD公司);Cytobuster TM细胞裂解液(Novagen公司);山羊抗人 HPA、PCNA、β-actin(Santa Cruz Biotechnology公司);辣根酶标记的兔抗山羊二抗及DAB显色剂(北京中杉金桥生物技术公司)。
1.2 实验方法
1.2.1 细胞培养及实验分组:肝癌细胞株SMMC-7721细胞,用含10%小牛血清的RPMI-1640培养液,置于37℃、5%CO2(体积分数)、饱和湿度的培养箱内培养,待细胞贴壁生长达亚融合状态时,用0.25%的胰蛋白酶消化细胞备用。实验用细胞均处于对数生长期,苔盼蓝计数活细胞大于95%。设VPA浓度梯度为2、4、8 mmol/L为试验组(n=3),以等量的磷酸盐缓冲液(PBS)为对照组(n=3),培养24、48或72 h。
1.2.2 流式细胞仪(FCM)检测细胞凋亡率和细胞周期:不同浓度VPA作用细胞48 h,收集细胞,预冷PBS洗涤两遍,1×Annexin-V缓冲液悬浮细胞,调整细胞浓度为1×106/ml,取悬液 100 μl,加入 Annexin-V-FITC 5 μl、碘化丙啶(PI)10 μl,避光染色15 min,每管加入300 μl的1×Annexin-V缓冲液,FCM检测凋亡细胞阳性率和细胞周期变化,并以FCM检测结果作为后继试验选择药物浓度和作用时间的参考依据。Annexin-V(-)并PI(-)为活细胞,Annexin-V(-)并PI(+)为机械损伤细胞,Annexin-V(+)并PI(+)为晚期凋亡细胞,试验中以Annexin-V(+)作为凋亡细胞。
1.2.3 肝癌细胞体外迁移实验:SMMC-7721细胞以2×105/孔接种于6孔板,培养至单层细胞覆盖率90%左右,更换为无血清的RPMI1640培养基,饥饿培养12 h。用橡皮刮片在孔板中央刮出一条整齐的宽度为10 mm无细胞划痕区,轻轻洗涤后弃上清,加入含10%胎牛血清培养液2 ml,并在孔内分别加入空白对照 PBS液和2、4、8 mmol/L的VPA。37℃、5%CO2下培养24 h。显微镜下放大100倍观察刮痕区,每孔随机选择5个视野,计数每个视野中向刮痕中迁移的细胞总数。
细胞迁移抑制率(%)=(对照组迁移细胞数-试验组迁移细胞数)/对照组迁移细胞数×100%。
1.2.4 肝癌细胞体外侵袭实验:Transwell小室的聚碳酯膜下表面使用0.1%的明胶室温包被过夜,上表面加入20 μl Matrigel,37℃、5%CO2下温育1 h使胶凝固,用来模拟体内的细胞外基质和基底膜环境。SMMC-7721细胞制成2×105/ml细胞悬液,取 200 μl接种于 Transwell小室上室,分别加入 2、4、8 mmol/L的VPA,同时设对照组。下室中加入含10%FBS的NIH-3T3细胞培养上清液,37℃、5%CO2条件下培养24 h。去除滤膜上层细胞,4%多聚甲醛固定后行瑞氏吉姆萨染色。镜下(×200)随机选取5个视野,计数滤膜下表面的细胞数。实验重复3次。以穿膜细胞相对数目表示SMMC-7721细胞的侵袭能力并计算侵袭抑制率。
细胞侵袭抑制率(%)=(对照组穿膜细胞数-试验组穿膜细胞数)/对照组穿膜细胞数×100%。
1.2.5 肝癌细胞体外黏附能力试验:不同浓度(2、4、8 mmol/L)的VPA作用SMMC-7721细胞24 h,以含10%血清的培养液重悬细胞,按2×105/孔接种于预先铺好Matrigel的96孔板,设4个平行孔,继续孵育60 min后每孔加入无血清的RPMI1640 培养基200 μl和 MTT(5 mg/ml)20 μl,继续孵育4 h。弃上清,每孔加入二甲基亚砜(DMSO)100 μl,震荡 10 min,在全自动酶标仪492 nm波长处测定吸光度(OD)值。
细胞黏附率(%)=试验组OD值/对照组OD值×100%。1.2.6 Western-blot法测定SMMC-7721细胞HPA及PCNA蛋白含量:收获细胞后,冰PBS漂洗2次,收集细胞,立即加入500 μl细胞裂解液,冰上静置 10 min,4℃、14 000 r/min离心10 min,取上清,考马斯亮蓝测定总蛋白浓度。取50 μg蛋白进行聚丙烯酰胺凝胶电泳,电转移至PVDF膜上,5%脱脂奶粉封闭非特异性抗原,加入1∶300稀释的山羊抗人HPA多克隆抗体或山羊抗人PCNA多克隆抗体或1∶300稀释的山羊抗人β-actin作为阳性对照,4℃过夜,用含0.1%Tween20的TBS洗膜,加入辣根过氧化物酶(HRP)标记的兔抗山羊二抗,37℃中作用1 h,洗膜后DAB显色。将结果扫描成像后用GeL-ProAnalysis图像分析软件进行条带吸光度值分析,以HPA(50 kU)、PCNA(36 kU)与β-actin(42 kU)测定结果的比值,作为 HPA和PCNA蛋白表达水平的参数,对HPA和PCNA产物相对定量。
1.3 统计学分析应用SPSS 12.0统计软件,计量资料以±s表示,采用方差分析和t检验,P<0.05为差异有统计学意义。
2 结果
2.1 细胞凋亡率和细胞周期变化 经2、4、8 mmol/L VPA作用细胞48 h后FCM显示,随着VPA浓度增加,SMMC-7721细胞凋亡率逐渐增高。以8 mmol/L VPA分别作用细胞24、48及72 h后,检测细胞凋亡率亦逐渐增高,各组差异有统计学意义(P<0.05),且呈现浓度和时间依赖性。细胞周期分析显示G0/G1期、S期细胞百分率逐渐下降,而G2/M期细胞百分率逐渐升高,且呈浓度和时间依赖性(P<0.05)。表1、2。
表1 不同浓度VPA作用48 h后SMMC-7721细胞凋亡率及细胞周期改变n=3,%,±s

表1 不同浓度VPA作用48 h后SMMC-7721细胞凋亡率及细胞周期改变n=3,%,±s
注:与对照组比较,*P<0.05;与2 mmol/L组比较,#P<0.05;与4 mmol/L组比较,△P<0.05
组别 凋亡率 G0/G1期 S期 G2/M期3.7±0.3 58.5±1.7 30.3±0.9 9.02±0.29 2 mmol/L组 9.7±0.4* 52.3±1.0* 25.2±0.9* 13.68±0.36*4 mmol/L组 19.8±1.1*# 47.4±1.4*# 19.3±0.7*# 18.69±0.80*#8 mmol/L组 35.6±1.7*#△ 39.6±1.2*#△ 11.0±1.1*#△ 23.98±1.32*#△对照组
表2 8 mmol/L VPA作用不同时间后SMMC-7721细胞凋亡率及细胞周期改变n=3,%,±s

表2 8 mmol/L VPA作用不同时间后SMMC-7721细胞凋亡率及细胞周期改变n=3,%,±s
注:与对照组比较,*P <0.05;与24 h组比较,#P <0.05;与48 h组比较,△P <0.05
组别 凋亡率 G0/G1期 S期 G2/M期1.6±0.3 57.2±1.0 31.3±0.7 8.96±0.21 24 h 28.7±0.7* 48.4±1.0* 20.4±0.8* 19.38±0.82*48 h 35.6±1.7*# 39.6±1.2*# 11.0±1.1*# 23.98±1.32*#72 h 46.1±1.3*#△ 43.3±1.0*#△ 9.1±0.9*#△ 26.31±1.02*#△对照组(24 h)
2.2 肝癌细胞体外迁移实验 不同浓度的VPA作用细胞24 h后,对照组向划痕部位迁移细胞数目多于VPA试验组,细胞迁移数目随药物浓度升高而逐渐减少,该作用呈浓度依赖性,组间差异有统计学意义(P<0.05)。见表3。
2.3 肝癌细胞体外侵袭实验 不同浓度的VPA试验组穿膜细胞数较对照组明显减少,且呈现出浓度依赖性,计算得出细胞侵袭抑制率亦随实验浓度升高而逐渐升高,组间差异有统计学意义(P <0.05)。见表3。
2.4 肝癌细胞体外黏附能力试验 VPA试验组吸光度(OD)值明显低于对照组,随VPA浓度由2、4、8 mmol/L递增,计算得出各浓度组细胞黏附率呈降低趋势,组间差异有统计学意义(P <0.05)。见表3。
2.5 SMMC-7721细胞HPA及PCNA蛋白含量的变化 Western-blot结果显示,对照组HPA和PCNA蛋白表达水平较高,随着VPA浓度的升高,HPA和PCNA蛋白表达水平逐渐下降,组间差异有统计学意义,存在浓度依赖性(P<0.05)。同一浓度下随作用时间延长,该下调作用亦逐渐加强,组间差异有统计学意义,即存在时间依赖性(P>0.05)。见表4。
表3 不同浓度VPA对SMMC-7721细胞迁移、侵袭、黏附能力的影响n=3,%,±s
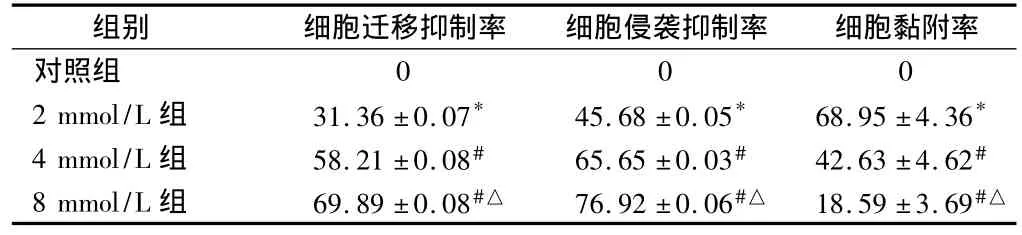
表3 不同浓度VPA对SMMC-7721细胞迁移、侵袭、黏附能力的影响n=3,%,±s
注:与对照组比较,*P <0.05;与2 mmol/L组比较,#P <0.05;与4 mmol/L组比较,△P <0.05
组别 细胞迁移抑制率 细胞侵袭抑制率 细胞黏附率对照组000 2 mmol/L组 31.36±0.07* 45.68±0.05* 68.95±4.36*4 mmol/L组 58.21±0.08# 65.65±0.03# 42.63±4.62#8 mmol/L组 69.89±0.08#△ 76.92±0.06#△ 18.59±3.69#△
表4 不同浓度VPA作用不同时间SMMC-7721细胞HPA和PCNA蛋白含量测定n=3,±s
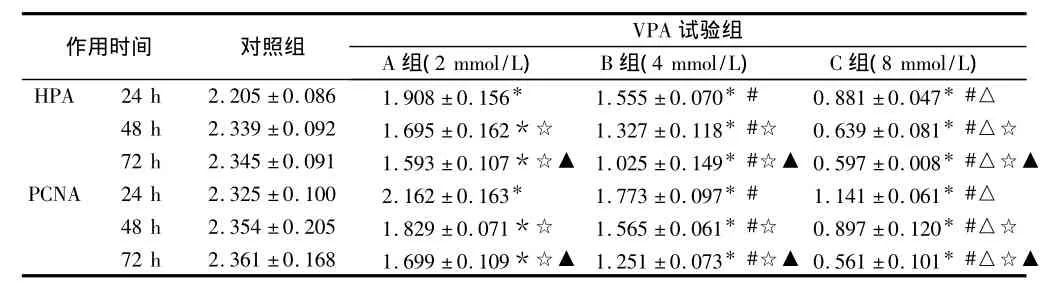
表4 不同浓度VPA作用不同时间SMMC-7721细胞HPA和PCNA蛋白含量测定n=3,±s
注:与对照组比较,*P<0.05;与A组比较,#P<0.05;与B组比较,△P<0.05;与同一浓度组24 h比较,☆P<0.05;与同一浓度组48 h比较,▲P<0.05
作用时间 对照组 VPA 试验组A组(2 mmol/L) B组(4 mmol/L) C组(8 mmol/L)HPA 24 h 2.205±0.086 1.908±0.156* 1.555±0.070*# 0.881±0.047*#△△☆▲48 h 2.339±0.092 1.695±0.162*☆ 1.327±0.118*#☆ 0.639±0.081*#△☆72 h 2.345±0.091 1.593±0.107*☆▲ 1.025±0.149*#☆▲ 0.597±0.008*#△☆▲PCNA 24 h 2.325±0.100 2.162±0.163* 1.773±0.097*# 1.141±0.061*#△48 h 2.354±0.205 1.829±0.071*☆ 1.565±0.061*#☆ 0.897±0.120*#△☆72 h 2.361±0.168 1.699±0.109*☆▲ 1.251±0.073*#☆▲ 0.561±0.101*#
3 讨论
肝细胞性肝癌是世界范围内常见的恶性肿瘤,在我国恶性肿瘤死亡分类构成中高居第二位[3]。目前认为,肿瘤的发生最终由基因组水平的改变引起,是一个多基因事件累积的复杂过程。其中,组蛋白的乙酰化调节是基因表达调控的关键环节之一,其由一对功能相互拮抗的蛋白酶,即组蛋白乙酰化酶(histoneacetylase,HAT)和组蛋白去乙酰化酶(histonedeacetylase,HDAC)共同调控,二者之间的动态平衡控制着染色质结构和基因的正常有序表达。已有研究报道,HDAC水平与多种肿瘤的发生发展相关[4],而HDACI可通过促进组蛋白乙酰化水平,上调相关抑癌基因表达,起到抑制肿瘤细胞增殖、促进凋亡或者诱导分化的作用[1],但其作用机制尚未阐明。VPA是临床常用的抗癫痫药,最近研究发现它有较强的HDACI活性[2]。研究证明HDACI可通过抑制肿瘤细胞增殖、诱导凋亡、抑制肿瘤血管生成及转移、降低肿瘤侵袭力等机制发挥抗肿瘤作用[5]。
本研究观察了VPA对SMMC-7721细胞凋亡及细胞周期的影响,流式细胞仪检测结果提示随着VPA浓度增加和作用时间的延长,SMMC-7721细胞凋亡率逐渐增高,表明 VPA对SMMC-7721细胞具有诱导凋亡作用,且呈现浓度和时间依赖性。细胞周期分析显示随着VPA浓度增加,G0/G1期、S期细胞百分率逐渐下降,分别由(58.53±1.68)%、(30.32±0.87)%降至(39.64±1.22)%、(11.02±1.09)%。而G2/M期细胞百分率逐渐升高,由(9.02±0.29)%增至(23.98±1.32)%,提示VPA能使细胞周期阻滞于G2/M期,显著抑制了肿瘤细胞的增殖,这与Kaiser等[6]的研究结果一致。PCNA作为DNA聚合酶δ的辅助蛋白直接参与DNA的合成,其表达与细胞周期相关,是评价细胞增殖状态的生物学活性指标[7]。有研究表明,PCNA异常表达于多种肿瘤细胞,其高表达与肿瘤的恶性程度和预后密切相关[8]。本实验同时观察到不同浓度的VPA作用于肝癌SMMC-7721细胞不同时间后,细胞中PCNA蛋白的表达显著下调,并呈现时间依赖性和浓度依赖性。提示VPA可能通过下调PCNA的表达,抑制肿瘤细胞的增殖化。
细胞体外迁移实验、侵袭试验以及黏附能力试验均为体外模拟并检测肿瘤细胞恶性生物学特性的经典试验方法。肿瘤细胞的黏附是恶性肿瘤发生侵袭转移的始发步骤,黏附作用包括同质黏附(细胞—细胞黏附)和异质黏附(细胞—基质黏附),同质黏附能力下降,有利于瘤细胞脱离原发肿瘤而向远处转移,异质黏附能力增强则有利于转移的瘤细胞和转移处的基质结合,继而释放蛋白酶降解基质,便于瘤细胞在转移部位侵袭性生长。参与肿瘤侵袭转移的分子成员众多,HPA是目前发现的哺乳动物细胞中唯一能切割细胞外基质中HSPG侧链的内源性糖苷酶,通过破坏基底膜的完整性,促进肿瘤浸润、转移,同时还可促进VEGF、bFGF等肿瘤血管生成相关因子的表达以及促进肿瘤细胞的增殖,其在肿瘤中的高表达提示预后不良[9,10]。而应用反义寡核苷酸或RNA干扰技术降低肝癌细胞HPA的表达,可显著抑制肿瘤细胞的侵袭、转移能力[11]。本试验将不同浓度VPA作用SMMC-7721细胞不同时间,观察瘤细胞生物学特性的变化,结果表明,试验组细胞迁移能力、侵袭能力以及细胞黏附能力均显著低于对照组,提示VPA能显著抑制肿瘤细胞侵袭转移能力。试验进一步检测了VPA对SMMC-7721细胞 HPA表达的影响,Western-blot结果显示,对照组HPA蛋白表达水平较高,而试验组随着VPA浓度的升高和作用时间的延长,HPA蛋白表达水平第次下降,存在浓度依赖性和时间依赖性。提示VPA可通过降低SMMC-7721细胞HPA的表达,弱化瘤细胞降解突破基底膜以及与转移处基质的黏附能力,间接发挥其抑制瘤细胞侵袭转移的抗肿瘤效应。
综上所述,本试验应用VPA逆转肝癌细胞系SMMC-7721细胞组蛋白低乙酰化修饰水平,可显著抑制癌细胞增殖,降低癌细胞侵袭转移能力。下调HPA和PCNA表达可能是其发挥作用的主要机制之一。VPA作为新近证实的HDACI在肝癌的治疗方面存在较好的应用前景。
1 马洪玉,李际君.丙戊酸钠对肿瘤细胞影响的体外研究.河北医药,2010,32:595-596.
2 Mottet D,Castronovo V.Histone deacetylases:target enzymes for cancer therapy.Clin Exp Metastasis,2008,25:183-189.
3 赵平,孔灵芝主编.肝癌.中国肿瘤死亡报告——全国第三次死因回顾抽样调查.第1版.北京:人民卫生出版社,2010.37.
4 Choi JH,Kwon HJ,Yoon BI,et al.Expression profile of histone deacetylase in gastric cancer tissues.Cancer Res,2001,92:1300-1304.
5 Zhang Y,Jung M,Dritschilo A,et al.Enhancement of radiation sensitivity of human squamous carcinoma cells by histone deacetylase inhibitors.Radiat Res,2004,161:667-674.
6 Kaiser M,Zavrski I,Sterz J,et al.The effects of the histone deacetylase inhibitor valproic acid on cell cycle,growth suppression and apoptosis in multiple myeloma.Haematologica,2006,91:248-251.
7 Buyukbayram H,Cureoglu S,Arslan A,et al.Prognostic value of PCNA and mutant p53 expression in laryngeal squamous cell carcinoma.Cancer Invest,2004,22:195-202.
8 Dirim A,Haberal AN,Goren MR,et al.VEGF,COX-2,and PCNA expression in renal cell carcinoma subtypes and their prognostic value.Int Urol Nephrol,2008,40:861-868.
9 Bar-Sela G,Kaplan-Cohen V,Ilan N,et al.Heparanase expression in asopharyngeal carcinoma inversely correlates with patient survival.Histopa-thology,2006,49:188-193.
10 Rubinfeld H,Cohen-Kaplan V,Nass D,et al.Heparanase is highly expressed and regulates proliferation in GH-secreting pituitary tumor cells.Endocrinology,2011,152:4562-4570.
11 Zhang Y,Li L,Wang Y,et al.Downregulating the expression of heparanase inhibits the invasion,angiogenesis and metastasis of human hepatocellular carcinoma.Biochem Biophys Res Commun,2007,358:124-129.
