C-反应蛋白与慢性肾脏病的关系
2012-10-09马开慧
金 晔,王 炜,马开慧
(首都医科大学附属北京友谊医院 检验科,100050)
慢性肾脏病(CKD)共同的特点是肾功能以不同速度进行性恶化,终会进展为终末期肾脏病。炎症是导致和加重肾小管间质纤维化,促进CKD进展的主要原因。2000年Schoming M 等[1]提出了尿毒症患者存在着“微炎症状态”(microinflammatory state),这种微炎症既有别于病原微生物感染引起的普通炎症,亦不等同于全身炎症反应综合征(systemic inflammatory responsesyndrome,SIRS)。患者无明显临床感染症状,仅表现为全身循环中炎症因子、急性反应蛋白轻度升高。近期研究结果表明,随着CKD病程的进展,这种微炎症状态可能促进动脉粥样硬化、营养不良、贫血等并发症的发生并且与患者死亡率明显相关。慢性肾脏病患者随着肾功能的减退,往往出现CRP水平的持续升高,炎症反应是肾纤维化和CKD发展的关键环节[2],那么CRP作为一种促炎症介质是否反过来促进肾功能进一步恶化,导致CKD进行性发展?本研究通过分析CRP与CKD患者肾功能减退的关系,初步探讨CRP在慢性肾脏病进展中的潜在作用。
1 资料与方法
1.1 病例选择
参照美国肾脏病基金会(NFK)2002年制定的慢性肾脏病临床实践指南提出的关于CKD诊断和分期标准,共入选86例尚未接受透析的CKD住院患者,男性46例,女性40例,年龄29-65岁,平均年龄(46±9)岁。所有患者肾小球滤过率 (GFR)<60 mol/min/1.73m2并持续3个月以上。根据肾功能将患者分为:CKD3期25例,CKD4期34例,CKDS期27例。所有患者均除外急性感染和自身免疫性疾病,无肾病综合征水平的蛋白尿,亦未接受免疫抑制治疗。对照组:非住院健康体检者80例,男40例、女40例。年龄36-62岁,平均年龄(43±6)岁。研究对象组和对照组两组病例性别构成、年龄经统计学处理,差异均无统计学意义(P﹥0.05),具有可比性。
CKD诊断和分期标准:根据NFK-K/DOQI提出的关于CKD的诊断定义:肾脏损伤超过3个月或GFR<60mol/min/1.73m2超过3个月。依据GFR水平进行分期:l期 GFR≥90mol/min/1.73 m2;2 期 GFR60~89mol/min/1.73m2:3 期GFR30~59mol/min/1.73m2;4 期 GFR15~29 mol/min/1.73m2;5 期 GFR<15mol/min/1.73 m2或透析。
1.2 试验方法
受试患者禁食5h以上静脉抽血3ml置于血清管,待标本凝集后置于3 000转/分离心机离心10min,取上清进行各种项目的检测,同时进行质控检测。
1.3 统计学处理
应用SPSS15.0统计分析软件对结果进行处理。符合正态分布或近似正态分布的计量数据用均数±标准差(¯x±s)表示,两组均数比较采用t检验,相关分析采用Pearson检验,P<0.05认为差异有统计学意义。
2 结果
非透析CKD患者肾功能严重降低,CRP升高明显,CKD组与对照组间的CRP值有统计学差异(P<0.05)。CKD患者检测的各种炎症因子与肾功能的相关性比较,CRP与GFR的相关性最大。见表1,2。

表1 各检测项目的平均值
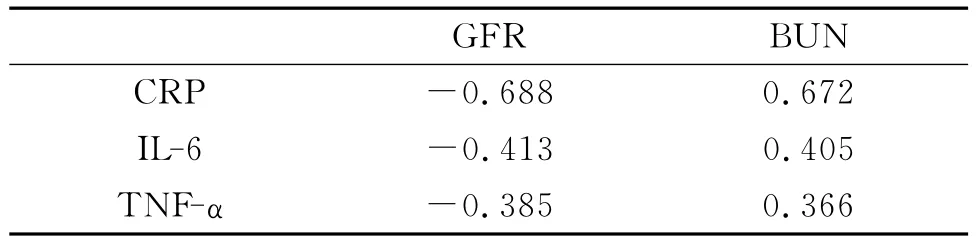
表2 CKD患者炎症因子与肾功能的相关性(P<0.05)
3 讨论
CRP由5个等同亚基非共价、对称地围成一中心孔状五聚体结构,分子量105kD。近年研究发现CRP不仅是炎症的标志物,其本身也具有许多重要生物活性而主动参与了炎症反应本身。其生物学作用包括与单核巨噬细胞、血管内皮细胞和平滑肌细胞上的Fcγ受体结合激活细胞,介导炎症反应,如上调粘附分子,诱导趋化因子产生,募集并激活循环单核细胞等炎症细胞。有研究表明,循环中高水平的CRP能够与受损的肾组织细胞结合并沉积于包括肾小球、肾小管间质、管周微循环的肾组织中。CRP可诱导肾小球系膜细胞产生活性氧,促进单核细胞趋化蛋白-1表达,并可刺激近端肾小管上皮细胞合成分泌趋化因子RANTES,提示CRP具有活化肾固有细胞的促炎症作用。CRP还具有许多类似免疫球蛋白IgG的特性,CRP可以与特定配体结合后,激活补体经典途径,并通过Fcγ受体和补体受体活化单核巨噬细胞,促进炎症反应扩大。众多证据表明,CRP与慢性肾衰竭患者动脉粥样硬化等并发症的发生密切相关。CRP在血管壁沉积可诱导血管内皮细胞粘附分子 (ICAM-1、VCAM等)表达增加,使单核/巨噬细胞在血管内皮细胞粘附并浸润到血管壁内,调理巨噬细胞胞饮摄入LDL形成泡沫细胞沉积于血管壁内;CRP促进巨噬细胞释放组织因子,使局部血栓形成[3-6]。
本研究发现CKD病人普遍存在CRP水平增高,轻度肾功能减退的CKD病人体内CRP即开始升高,且随肾功能恶化进行性升高。体外研究表明,IL-6、TNF-α可刺激肝细胞合成释放 CRP,而 CRP可诱导单核巨噬细胞释放IL-6、TNF-α。CKD患者随着肾功能的减退而出现微炎症状态,炎症状态下单核细胞衍生的细胞因子和CRP等正性急性时相反应物增多与肾功能减退呈一定相关性,提示微炎症有可能促进CKD的肾功能进行性衰竭。
综上所述,CKD患者透析前期已普遍存在微炎症状态,随着肾功能下降有加重趋势,并且可进一步促进营养不良的发生及肾功能恶化,从而加速CKD进程进展。减轻和控制患者的微炎症状态,将成为临床治疗CKD、提高患者生存质量,减少死亡率的新突破点,但对于不同微炎症状态程度对于机体影响及针对性干预治疗结果评估,尚需进一步临床实验研究。
[1]Schoming M,Eisenhandt A,Ritz E.The microinflammatory state of uremia[J].Blood Purif,2000,18(4):327.
[2]Kalousová M,Zima T.Tesar V .Advanced glycoxidation end productsin chronic diseases-clinical chemistry and genetic background[J].Mutat Res,2005,579(1-2):37.
[3]Lu J,Marnell LL,Marjon KD.Structural recognition and functional activation of FcγR by innate pentraxins[J].Nature,2008,456(7224):989.
[4]Chonchol M.Neutrophil dysfunction and infection risk in endstage renal disease[J].Semin Dial,2006,19(4):291.
[5]Szalai AJ,McCrory MA,Cooper GS.Association between baseline levels of C-reactive protein(CRP)and a dinucleotide repeat polymorphis-m in the intron of the CRP gene[J].Genes Immun,2002,3(1):14.
[6]叶云洁,倪兆慧,钱家麒.终末期肾病微炎症状态和动脉粥样硬化的关系[J].中华肾脏病杂志,2004,20(3):173-176.
