RNA干扰COPS3表达对肺癌细胞增殖影响的分析
2012-10-09孔庆彧崔久嵬于得海王雪梅王冠军
孔庆彧,崔久嵬,于得海,李 薇,王雪梅,2,王冠军*
(1.吉林大学第一医院肿瘤中心,吉林 长春130021;2.吉林省人民医院 血液科)
肺癌为死亡率最高的恶性肿瘤之一,在全世界范围内死亡率仍呈逐年上升趋势。近年来随着对肿瘤发生研究的不断深入,人们发现并证实肿瘤发生与转移根本原因在于相关基因的异常表达,尤其是调控细胞生长与分化的癌基因的激活或抑癌基因的失活更成为肿瘤发生机制研究的热点[1]。COPS3(constitutive photomorphogenic homolog subunit 3 of COP9)是新近发现的一种与肿瘤发生及转移密切相关的基因,是肿瘤治疗的潜在靶点。RNA干扰(RNA interference,RNAi)是一种高效、特异地降解靶基因mRNA的实验技术,目前已广泛应用于基因功能领域的研究[2,3]。
本研究通过建立COPS3慢病毒RNAi载体,观察干扰COPS3基因表达后,肺癌细胞A549增殖、周期分布及细胞凋亡情况,以探讨其在肺癌发展中的作用。
1 材料与方法
1.1 主要材料
人肺腺癌细胞株A549、人胚胎肾上皮细胞株293T(ATCC);表达载体 pFH1UGW-GFP(上海Hollybio公司);慢病毒载体及辅助载体(上海吉凯基因 技 术 公 司);M-MLV 反 转 录试剂 盒 (Promega);ECL试剂(Amersham);COPS3兔抗小鼠单克隆抗体、β-actin兔抗小鼠多克隆抗体、HRP标记山羊抗小鼠抗抗体(Snata Cruz)。
1.2 COPS3基因的RNA干扰
1.2.1 RNAi慢病毒载体构建 针对COPS3基因mRNA序列,通过“Target Finder Tool”软件(Gen-Scrip)设计干扰序列及对照序列(表1)。单链DNA退火后产生双链DNA oligo,再与双酶切后的慢病毒干扰载体连接,进而转化感受态DH5α,挑单克隆进行PCR鉴定;对阳性菌落进行测序。
1.2.2 慢病毒包装及感染细胞 293T细胞生长至对数生长期时开始转染,参照Lipofectamine 2000说明书,在6孔板中加入si-COPS3或si-CTRL 2 μg、pCMV载体1.5μg、pVSVG载体1μg。转染后8h更换正常培养基,继续培养48h,在此期间观察转染效率。最后收集上清液,进行过滤、浓缩并测定病毒滴度。

表1 COPS3基因干扰序列
以5×104细胞/孔将A549细胞接种于96孔板,以含有适量病毒的DMEM培养基培养24h,更换新鲜培养基继续培养72h,在荧光显微镜下观察绿色荧光蛋白表达情况。
1.2.3 慢病毒感染后COPS3基因沉默分析 收集慢病毒感染5d的A549细胞,分别应用real-time PCR及Western blot法分析检测慢病毒感染A549细胞后COPS3mRNA及蛋白表达水平。
1.3 BrdU法检测细胞增殖
收集慢病毒感染5d的A549细胞,按5×103细胞/孔接种于96孔板,检测时间设为接种后24h和72h。调整每孔BrdU终浓度为25μmol/l,继续培养8h,固定细胞并用核酸酶室温消化30min后加入BrdU单克隆抗体(1∶200稀释)与辣根过氧化物酶标记的山羊抗鼠二抗,室温孵育1.5h,然后加入TMB显色底物,暗处孵育30min后终止反应。酶标仪读取490nm处OD值。
1.4 细胞周期分析
收集慢病毒感染细胞以1×106个细胞/孔接种于6孔板,培养24h后收集细胞并固定,加入配制的PI溶液(100μg/ml PI,10μg/ml RNase A)染色30min。应用流式细胞仪进行细胞周期分析。
1.5 细胞凋亡检测
取慢病毒感染细胞以5×105个细胞/孔接种于6孔板,培养5d,消化并收集细胞,分别加入100μl结合缓冲液、5μl Annexin V 溶液及5μl PI,于暗处室温孵育5min。取1×106个细胞,应用流式细胞仪进行细胞凋亡分析。
1.6 统计数据处理
所有数据均以平均值¯x±SD表示,每组实验重复三次。数据采用SPSS16.0软件进行pairedt检验,P≤0.05认为具有统计学意义。
2 结果
2.1 慢病毒感染A549细胞
将慢病毒感染A549细胞96h后,在倒置荧光显微镜下观察GFP表达情况,可见明显绿色荧光,证明病毒表达质粒已成功转入细胞中,感染效率可达50%以上(图1)。

图1 慢病毒感染A549细胞96h后GFP表达情况(×200)
2.2 RNAi COPS3基因沉默效果验证
与对照组相比,转染si-COPS3的A549细胞COPS3mRNA及蛋白质表达水平均显著下降(图2,3)。
2.3 干扰COPS3表达对A549细胞增殖的影响
BrdU细胞增殖实验结果表明,与对照组相比,si-COPS3转染A549细胞72h后细胞增殖显著受抑(图4)。

图2 Real-time PCR分析转染干扰质粒后A549细胞COPS3mRNA表达情况
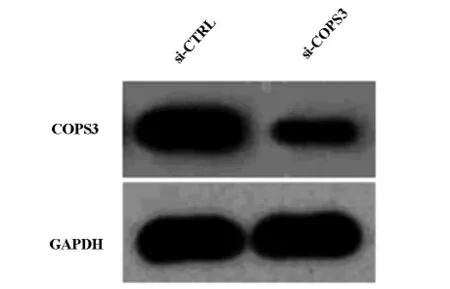
图3 Western blot分析转染干扰质粒后A549细胞COPS3蛋白质表达水平
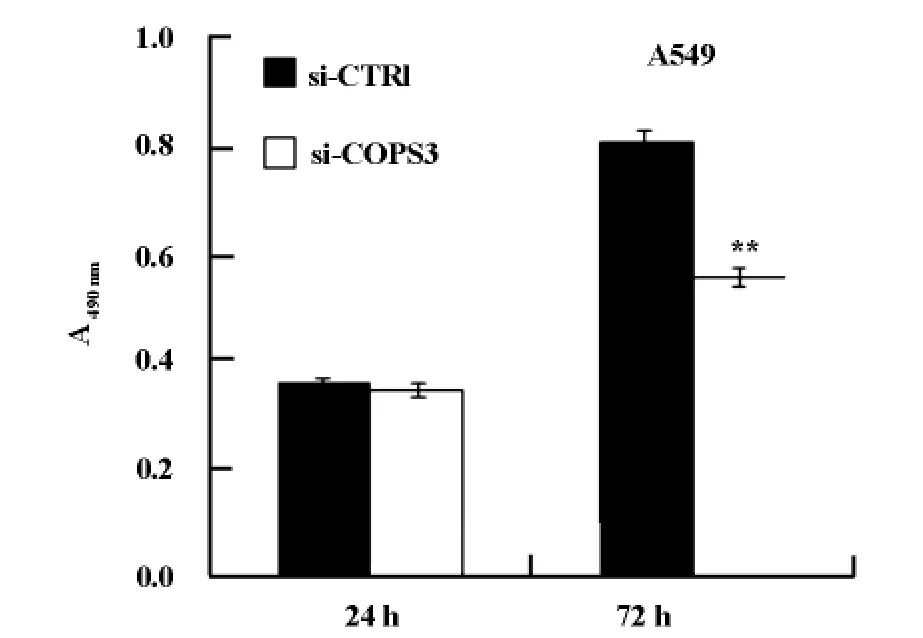
图4 BrdU法分析干扰COPS3基因表达后A549细胞增殖情况
2.4 COPS3基因沉默对A549细胞周期的影响
流式细胞仪检测细胞周期结果表明,与对照组不同,COPS3基因沉默后细胞周期大多停滞于G0/G1期(图5A、B)。

图5 流式细胞术分析干扰COPS3基因后A549细胞周期情况(A)及其定量分析(B)
2.5 COPS3基因沉默对A549细胞凋亡的影响
流式细胞术分析经 Annexin V-PI双染后的A549细胞凋亡情况,结果显示,实验组凋亡细胞比例均显著高于对照组(图6A、B)。

图6 流式细胞术分析干扰COPS3基因后A549细胞凋亡情况
3 讨论
近年来,肿瘤治疗分子靶点的探索及相应药物研发成为抗肿瘤新药研发的前沿和热点[3]。
COPS3基因是高度保守COP9信号传导通路中的一部分,位于人染色体17p11.2。该基因能调控细胞内诸多生物学过程,包括细胞周期、细胞增殖、细胞凋亡和转移等[4,5]。Dartel等[5]通过 DNA微阵列法亦发现COPS3基因在多种肿瘤中呈现高表达;Yan等[6]研究发现该基因在高度恶性骨肉瘤组织中高表达,而当COPS3过表达后抑制p53基因,可促进肿瘤细胞生长,敲除COPS3基因后,可抑制骨肉瘤细胞增殖。
慢病毒载体具有十分广泛的宿主范围,分裂期及非分裂细胞均能感染,并且能够将较大的外源基因片段有效地整合至宿主基因组中,是目前较为理想的基因转移载体之一[7]。本实验以慢病毒为载体,成功建立了COPS3的干扰体系,并将其导入肺癌细胞。发现通过干扰COPS3基因表达,肺癌细胞增殖能力受到明显抑制,并可以导致细胞周期阻滞于G0/G1期,诱导细胞凋亡,提示COPS在肺癌发生发展中可能起到重要的作用。
本研究为进一步深入探讨COPS3基因沉默后在肺癌发生与发展过程中的机制奠定了实验基础。
[1]Skrzypski M,Dziadziuszko R,Jassem J.MicroRNA in lung cancer diagnostics and treatment[J].Mutat Res,2011,717(1):25.
[2]Halimi Y,Dessau M,Pollak S,et al.COP9signalosome subunit 7 from Arabidopsis interacts with and regulates the small subunit of ribonucleotide reductase(RNR2)[J].Plant Mol Biol.,2011,77(1-2):77.
[3]Emanuele MJ,Creighton CJ,Schlabach MR,et al.A genome-wide RNAi screen identifies multiple synthetic lethal interactions with the Ras oncogene[J].Cell,2009,137(5):835.
[4]Fuchs B,Pritchard DJ.Etiology of osteosarcoma[J].Clin Orthop Relat Res,2002,397(4):40.
[5]van Dartel M,Cornelissen PW,Redeker S,et al.Amplification of 17p11.2approximately p12,including PMP22,TOP3A,and MAPK7,in high-grade osteosarcoma[J].Cancer Genet Cytogenet,2002,139(2):91.
[6]Yan T,Tang G,Ren T,et al.RNAi-mediated COPS3gene silencing inhibits metastasis of osteogenic sarcoma cells[J].Cancer Gene Ther.2011,18(6):450.
[7]Cockrell AS,Kafri T.Gene delivery by lentivirus vectors[J].Mol Biotechnol,2007,36(3):184.
