葛花多糖对X射线照射小鼠抗氧化应激能力的影响
2012-10-09陈奕冰柳鸿敏冯艳群吴岩林
陈奕冰,柳鸿敏,冯艳群,李 路,吴岩林,李 静
(吉林大学公共卫生学院,吉林 长春130021)
放射治疗是治疗恶性肿瘤主要手段之一,但是其在杀伤肿瘤细胞的同时也会对机体造成一定程度的损伤,包括氧化应激损伤、造血系统的功能异常、免疫功能障碍等,因此,放射防护剂的应用对保护患者正常组织,提高放射剂量,增加治愈率及医护人员、其它人群的辐射防护具有重要意义[1]。
目前临床应用的辐射防护剂主要有以下几类:雌激素类化合物、氨巯基化合物、雌激素类化合物、硫辛酸类化合物、细胞因子和植物多糖及中药复方等[2-6]。天然植物毒副作用小、资源丰富,现已成为辐射防护药物研究的新热点,葛花为豆科植物葛(Pueraria lobata(Willd.)Ohwi)的干燥未开放的花,主产湖南、河南、广东等地资源丰富[7]。葛花具有解酒醒脾,治伤酒发热烦渴、不思饮食、呕逆吐酸、吐血、肠风下血等功效[8],是传统医学中最具代表性的解酒药物。葛花的乙醇提取物能防治酒精性肝损伤能明显减少模型动物的肝脏系数、降低血清中的ALT和AST水平[9]。但有关葛花多糖的抗辐射作用研究较少。本文以X射线照射损伤小鼠为模型,观察葛花多糖对照射损伤小鼠抗氧化应激能力的影响,探讨葛花多糖的抗辐射作用,为研究天然辐射防护剂的奠定基础。
1 材料与方法
1.1 试验药物制备
葛花购自吉林大药房,经李平亚教授鉴定为豆科植物葛(Pueraria lobata(Willd.)Ohwi)的干燥花蕾。常规方法提取及纯化葛花多糖。
1.2 主要试剂仪器
SOD试剂盒、GSH-px试剂盒、CAT试剂盒(南京建成生物工程研究所);754紫外可见光分光光度计 (山东高密彩虹分析仪器有限公司);(LD25-2低速自动平衡离心机(北京医用离心机厂)。
1.3 实验动物及分组处理
健康昆明种雄性小鼠60只,体重(20±2)g,由吉林大学实验动物中心提供。
常规喂养5天后,随机分为6组,每组10只。除正常对照组和照射对照组外其余4组分别给予不同剂量的葛花多糖。①正常对照组:不照射,以蒸馏水代替药物;②低剂量组:不照射,每天灌胃给药(300mg/kg.bw.);③高剂量组:不照射,每天灌胃给药(600mg/kg.bw.);④照射对照组:X 射线照射,以蒸馏水代替药物;⑤低剂量照射组:X射线照射,每天灌胃给药(300mg/kg.bw.);⑥高剂量照射组:X射线照射,每天灌胃给药(600mg/kg.bw.)。
连续给药14d。末次给药后以X射线对照射对照组、低剂量照射组、高剂量照射组小鼠进行一次全身均匀照射,总剂量为5.0Gy,照射后24h将小鼠处死,取肝脏,用生理盐水制成10%的组织匀浆,置于4℃冰箱中保存备用[10]。
1.4 照射条件
小鼠经X射线全身均匀照射,剂量率为1.0Gy/min,电压180kV,电流18mA,滤板为0.5 mm Cu+1.0mm Al,照射源距靶中心垂直距离50 cm,总剂量为5.0Gy。
1.5 小鼠肝脏组织中SOD、GSH-Px、CAT的活力的测定
按照试剂盒说明书方法操作,测定小鼠肝脏组织中SOD、GSH-Px、CAT的活力。
1.6 小鼠肝脏组织中MDA含量的测定
采用硫代巴比妥酸(TBA)显色法测定MDA的含量[11]。取10%的肝组织匀浆400μL于试管中,同时取同样体积的标准应用液(MDA,10nmol/mL)做对照组,分别向上述溶液中加入20%的三氯乙酸2.5mL,混匀,再加入1%的TBA 1.0mL,混匀,沸水浴反应40分钟,用流水冷却至室温,2000rpm离心10min,吸取上清,在532nm下波长下,用蒸馏水调零,1cm比色杯,测定吸光度值。
1.7 小鼠肝脏组织中蛋白含量的测定
采用考马斯亮蓝比色法[21]测定小鼠肝脏组织中蛋白含量。将肝组织匀浆用生理盐水稀释成1%的组织匀浆。取样品30μl,加入0.97ml的生理盐水,再加入3.0ml的考马斯亮蓝溶液,混匀,静置10min。用1.0ml生理盐水和3.0ml的考马斯亮蓝的混合液调零,在595nm波长下,1cm比色杯测定吸光度值。
1.8 统计学处理
采用SPSS16.0统计软件包进行数据统计学分析组间比较采用t检验,P<0.05为有统计学意义。
2 结果
2.1 葛花多糖对X射线照射小鼠肝组织中SOD活力的影响
从表1可以看出照射对照组的SOD活力明显低于正常对照组(P<0.05),高剂量照射组的SOD活力明显高于照射对照组(P<0.05),低剂量照射组的SOD活力也高于照射对照组,但差异无显著性。
表1 葛花多糖对X射线照射小鼠肝组织中SOD活力的影响 (±s)

表1 葛花多糖对X射线照射小鼠肝组织中SOD活力的影响 (±s)
*P<0.05与正常对照组相比 ΔP<0.05与照射对照组相比
组别 n SOD(U/mgprot)正常对照组10 245.46±53.28低剂量组 10 245.19±53.08高剂量组 10 243.52±46.31照射对照组 10 136.98±30.73*低剂量照射组 10 169.33±35.01*高剂量照射组 10 192.13±59.22*Δ
2.2 葛花多糖对X射线照射小鼠肝组织中GSHPx活力的影响
由表2可见,与正常对照组比较,照射对照组的GSH-Px活力明显降低(P<0.05),与照射对照组比较,高剂量照射组的GSH-Px活力明显升高(P<0.05),低剂量照射组的GSH-Px活力也高于照射对照组,但差异无显著性。

表2 葛花多糖对X射线照射小鼠肝组织中GSH-Px活力的影响(x-±s)
2.3 葛花多糖对X射线照射小鼠肝组织中CAT活力的影响
从表3可以看出照射对照组CAT活力明显低于正常对照组(P<0.05),高剂量照射组的CAT活力明显高于照射对照组(P<0.05),低剂量照射组的CAT活力虽然高于照射对照组,但差异无显著性。

表3 葛花多糖对X射线照射小鼠肝组织中CAT活力的影响(x-±s)
2.4 葛花多糖对X射线照射小鼠肝组织中MDA含量的影响
表4数据显示照射对照组MDA含量明显高于正常对照组(P<0.05),高剂量照射组的 MDA明显低于照射对照组(P<0.05),低剂量照射组的MDA也低于照射对照组,但差异无显著性。
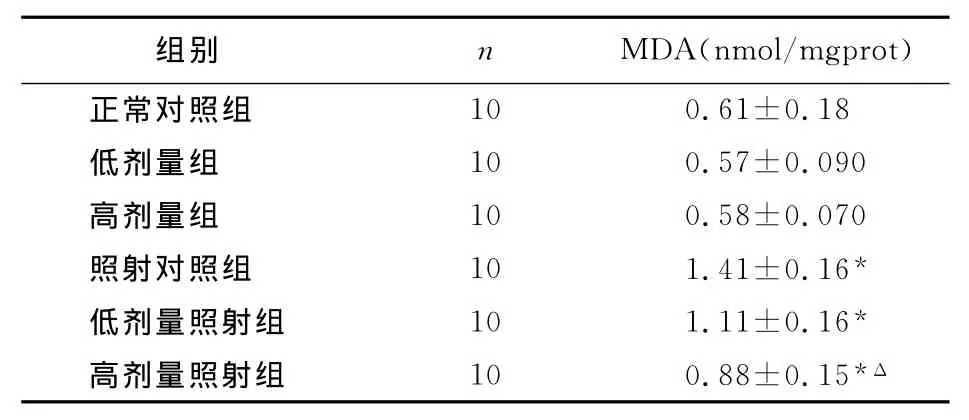
表4 葛花多糖对X射线照射小鼠肝组织中MDA含量的影响(x-±s,n=10)
3 讨论
从本实验结果看,与正常对照组比较,照射对照组小鼠肝组织中的SOD、GSH-Px和CAT的活力显著降低,说明X射线照射后小鼠的抗氧化酶的水平显著下降,各种自由基对正常组织细胞的损伤随之增多,而丙二醛含量的升高也证实了这结论,此结果也说明X射线损伤小鼠模型的建立是成功的。与正常对照组比较,葛花多糖的高剂量和低剂量给药组小鼠的各项氧化指标没有显著差别,提示本实验选择的两个剂量未对小鼠产生毒性。葛花多糖高剂量照射给药组小鼠肝组织中的SOD、GSH-Px和CAT活力显著升高,MDA显著下降,提示葛花多糖能逆转X射线照射损伤小鼠的SOD、GSH-Px、CAT活性的降低,清除辐射产生的自由基从而降低丙二醛(MDA)的含量提高机体的防御能力,提示葛花多糖可能是通过提高抗氧化酶体系活力、减轻自由基对组织细胞的损伤来发挥作用的。由于本实验是在对小鼠给药14天后才进行照射的,因此实验结果提示高剂量葛花多糖增强X射线照射小鼠抗氧化应激能力,对小鼠x射线损伤具有一定的预防保护作用,葛花资源丰富可作为辐射防护剂进一步研究开发。
[1]苌凤锦,彭代银 .中药抗辐射作用的研究进展[J].安徽医药,2011,15(7):902-905.
[2]张宪党,马 驰,张 群.植物多糖抗辐射损伤作用研究进展[J].中国辐射卫生,2003,12(2):122.
[3]江幼岷.辐射防护剂研究的进展与现状[J].中国反射医学与防护杂志,1995,15(3):197.
[4]吴显劲,孟庆勇,欧超伟.琼枝麒麟菜多糖对辐射损伤小鼠细胞因子分泌的影响[J].解放军预防医学杂志,2009,27(6):398.
[5]梁 莉,李新芳.苦豆子总碱对辐射损伤小鼠脂质过氧化作用的影响[J].中华放射医学与防护杂志,2002,22(5):319.
[6]宋 洁,韩彦龙,董 凯.黄芪对辐射损伤小鼠保护作用的研究[J].牡丹江医学院学报,2004,25(2):17.
[7]江苏新医学院.中药大辞典[M].第1版.上海:上海科学技术出版社,1986.
[8]吴德昌主编.放射医学[M].第1版.北京:军事医学科学出版社,2001.
[9]姚美村,廖祎婷,袁月梅,等.不同葛花提取物对乙醇致小鼠肝损伤保护作用的比较研究[J].时珍国医国药,2011,22(4):883.
[10]罗 鹏,张爱华,汪希兰,等.竹荪提取液对抗砷致小鼠肝脏氧化损伤的影响[J].中国地方病学杂志,200221(1):11.
[11]曾诗媛,甘耀坤,陈晓白,等.红菇提取液对大龄小鼠丙二醛含量的影响[J].玉林师范学院学报,2009,30(3):78.
