五个紫花苜蓿品种耐盐性的研究
2012-10-08贾纳提杨淑君祖日古丽
李 莉,贾纳提,热 娜,刘 梦,杨淑君,祖日古丽
(新疆畜牧科学院草业研究所,新疆 乌鲁木齐 830000)
据统计,世界约有9.6×108ha盐碱地,有100多个国家存在不同程度的盐碱化问题,而且每年还有很多农田发生次生盐渍化。我国盐渍化土地2.7×107ha其中7.0×106ha分布于农田,如何充分开发和利用这些盐碱地,对于增加我国农业生产有着重要的意义[1]。治理盐碱土主要有三种方法:第一,通过农业灌溉、土壤施肥,作物轮作倒茬等相关的农业技术进行改良,但费用较大;第二,种植一些野生植物,但其植物种质资源非常有限;第三,培育种植耐盐碱作物,这是一种耗资少且见效快的方法并且可以长期使用,在很大程度上降低了改良盐碱土地所需的高昂成本,在众多牧草中,紫花苜蓿(Medicago sativa L.)是我国栽培历史最悠久的优良牧草,也是豆科牧草中比较耐盐的,在中性或轻度盐碱土壤中生长良好。苜蓿作为发展畜牧业的首选牧草,如果进一步提高其耐盐性,不但可以增加饲草产量,减缓我国蛋白质饲料的不足,为发展畜牧业奠定物质基础。同时将会大大提高盐碱地的利用率。近年来,紫花苜蓿的耐盐生理生化的研究已经成为苜蓿耐盐育种的基础性工作[2]。本研究旨在探讨新疆主要种植的5个紫花苜蓿品种耐盐性范围和耐盐性反应机制,为充分利用紫花苜蓿资源改良盐碱地提供参考和依据[3]。
1 材料与方法
1.1 实验材料
新疆大叶,原产新疆和田县;新牧1号,新牧2号,新疆农业大学自育品种;三得利,原产新西兰;阿尔冈金,原产加拿大。
1.2 实验方法
1.2.1 苜蓿幼苗的胁迫处理
幼苗hoagland营养液水培法培育至30 d后,用将NaCl浓度设定为100 mmol/L处理苜蓿幼苗6 d后取样。以未加NaCl Hoagland营养液培养的幼苗为对照。
1.3 生理生化指标及其测定方法
1.3.1 相对电导率
采用电导法测定[10],称取各材料幼苗0.1 g,用蒸馏水洗涤3次,置洁净的具塞试管中,加10 mL蒸馏水充分振荡后静置3 h,测定其电导率初值,于沸水浴中加热15~30 h,测定其电导率终值,3次重复。
相对电导率=电导率初值/电导率终值×100
1.3.2 叶绿素含量的测定
叶绿素的提取:精密称取叶片剪碎放入研钵中,取0.1~0.5 g放入研钵中加少量细石英砂,研磨成糊状,用80%丙酮水溶液分批提取叶绿素,直到残渣无色为止,将丙酮提取液过滤后定容,并经适当稀释后在黑暗中放置数小时后比色,分别测定470 nm、665 nm、649 nm处的光密度值。
1.3.3 丙二醛含量的测定
MDA的提取:称取植物叶片1 g,重复三次,剪碎,加入4 mL 10%TCA和少量细石英砂,研磨成糊状,再加6 mL TCA继续研磨,充分研磨后在5000 r/min离心15 min,上清液为样品提取液。
显色反应和测定:吸取离心的上清液4 mL(对照加2 mL蒸馏水)放入20 mL刻度试管中,分别加入4 mL 0.6%TBA溶液,摇匀。将混匀物于沸水浴上反应20 min,迅速冷却后再离心,于5 000 r/min离心10 min。以对照管为空白测定450 nm、532 nm和600 nm波长下的消光度。
1.3.4 可溶性糖含量的测定
可溶性糖的提取:称取不同处理的新鲜干净植物叶片0.10 g左右,剪碎混匀,分别放入10 mL具塞刻度试管中,加入5 mL蒸馏水,于沸水中提取30 min,提取2次,提取液于10 mL离心管中4 000 r/min离心10 min。上清液即为样品提取液。
显色测定:吸取样品提取液0.5 mL于20 mL刻度试管中(重复2次),加蒸馏水1.5 mL(空白为加2 mL蒸馏水)。然后按顺序向试管中加入0.5 mL蒽酮乙酸乙酯试剂和 5 mL浓硫酸(易沸,缓慢加入),充分振荡,立即将试管放入沸水浴中,逐管准确保温1 min,取出后自然冷却至室温,以标准曲线空白作参比,在630 nm波长下测其光密度。
1.3.5 脯氨酸含量的测定
脯氨酸提取:取不同处理的叶片0.30 g左右,两次重复,分别置于具塞刻度试管中,加入5 mL 3%磺基水杨酸溶液,于沸水浴中浸提10 min,水浴过程中摇晃几次。迅速冷却后于4 000 r/min离心10 min。取出试管待冷却至室温后,吸取上清液2 mL,加2 mL冰乙酸和3 mL酸性茚三酮显色液,于沸水浴中加热40 min。迅速冷却后加入4 mL甲苯,振荡30 s,静置片刻,吸取上层甲苯液至比色杯中,以甲苯溶液为空白对照,于520 nm波长处进行比色。
2 结果与分析
2.1 相对电导率变化(见图1)
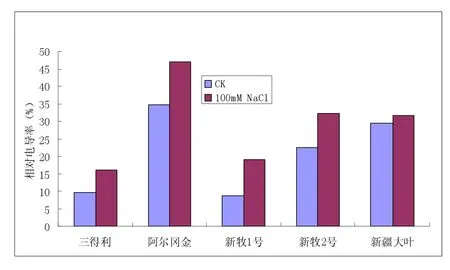
图1 逆境胁迫下相对电导率的变化(%)
在盐胁迫的条件下,叶片细胞膜受到伤害,相对电导率增大,细胞膜透性增大,相对电导率呈现上升的趋势。五种紫花苜蓿品种中新牧1号、新牧2号、阿尔冈金的相对电导率显著增大表明其在盐胁迫下细胞膜和细胞造成一定的伤害,显著的增加说明其耐盐性较弱,相比之下三得利和新疆大叶的耐盐性稍强一些。
2.2 叶绿素含量变化(见图2)
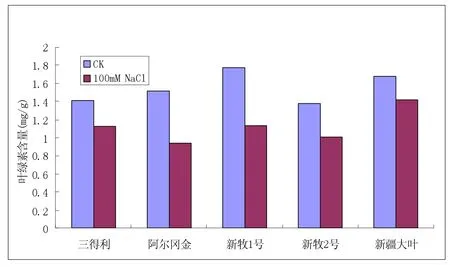
图2 逆境胁迫下叶绿素含量的变化(mg/g)
在盐胁迫的条件下,光合作用受到抑制叶绿素含量会呈下降趋势。五种紫花苜蓿品种中阿尔冈金、新牧1号、新牧2号的叶绿素含量相显著下降说明其在盐胁迫下光合作用受到严重抑制,表明其耐盐性较弱,相比之下三得利和新疆大叶的耐盐性稍强一些。
2.3 丙二醛含量变化(见图3)
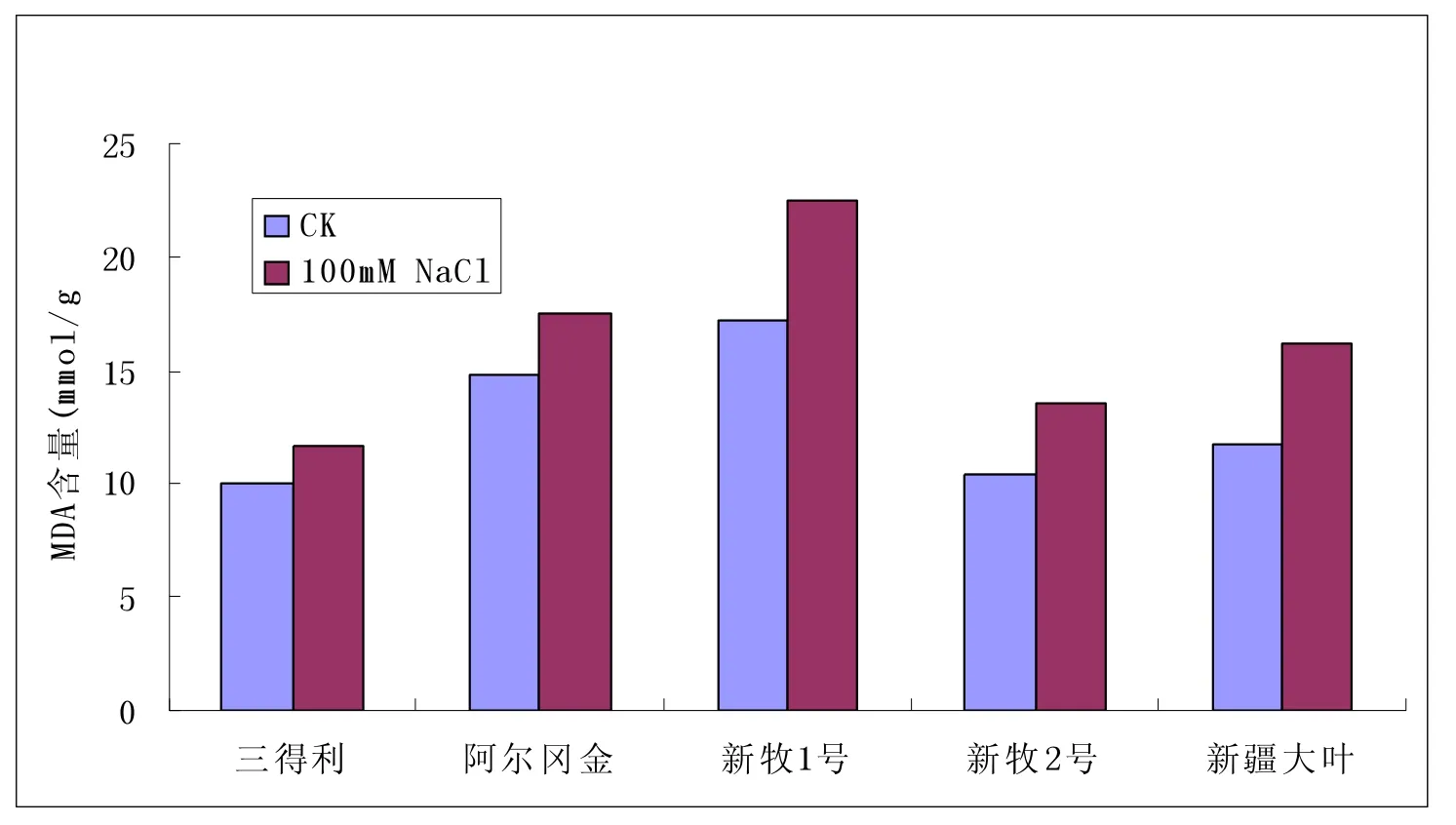
图3 逆境胁迫下丙二醛含量变化(mmol/g)
植物器官衰老或在逆境下遭受伤害,往往发生膜脂过氧化作用,丙二醛是膜脂过氧化的最终产物,它的积累对膜和细胞造成一定的伤害,所以其含量可以反映植物遭受逆境伤害的程度。五种紫花苜蓿品种中新牧1号、新牧2号、新疆大叶的丙二醛含量增加显著,表明其在盐胁迫下细胞膜和细胞造成一定的伤害,显著的增加说明其耐盐性较弱,相比之下三得利和阿尔冈金的耐盐性稍强一些。
2.4 可溶性糖含量变化(见图4)
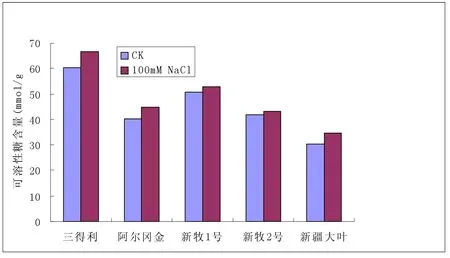
图4 逆境胁迫下可溶性糖含量变化(mmol/g)
可溶性糖是植物体内的重要渗透调节物质之一,主要有蔗糖、葡萄糖、果糖、半乳糖等,随盐胁迫程度增加而增加,有利于维持植物体细胞膨压,抑制由于胞内水分过度损失而造成的被动脱水。五种紫花苜蓿品种中三得利、阿尔冈金、新疆大叶的可溶性糖含量增加显著表明其耐盐性较强,相比之下新牧1号和新牧2号耐盐性稍弱一些。
2.5 脯氨酸含量变化(见图5)

图5 逆境胁迫下叶片脯氨酸含量的变化(ug/ml)
植物体内游离脯氨酸积累既取决于植物体内的水分变化,同时也与植物体内存在的耐盐机制有关。五种紫花苜蓿品种中三得利、阿尔冈金、新疆大叶的脯氨酸含量增加显著表明其耐盐性较强,相比之下新牧1号和新牧2号耐盐性稍弱一些。
3 讨 论
钠盐是影响植物生长和产量的主要环境因子之一,在盐胁迫下,细胞膜系统是植物易受盐害的主要部位,盐胁迫直接影响膜的正常生理生化功能,研究发现苜蓿的膜透性随盐浓度的增加而增大,膜透性增加多的苜蓿品种其细胞膜的破坏程度严重。在诸多植物耐盐性鉴定指标中,叶片质膜透性可以作为苜蓿耐盐性鉴定的可靠指标[4-5]。高等植物中,盐胁迫能诱导植物体内游离脯氨酸大量累积,这是一个比较普遍的现象。在正常生长条件下,植物体内的游离脯氨酸含量较低,但遇到干旱、盐碱、低温等逆境时,游离脯氨酸的含量明显增加。游离脯氨酸可以保持细胞与环境之间渗透平衡,防止植物体内水分散失,并可能直接影响植物体内蛋白质的稳定性,随胁迫强度的增加而增加。关于盐胁迫下植物积累脯氨酸的生理意义,有学者认为,盐胁迫下苜蓿脯氨酸量积累越多,说明植物体耐盐性越强,可以调动内源物质来抵御盐胁迫,因此可作为苜蓿的抗盐指标之一[6]。
本实验研究表明,五种紫花苜蓿品种在所分析的几项生理指标中均存在差异,说明五种紫花苜蓿品种在耐盐性上存在差异性。综合五种紫花苜蓿品种苗期测定的各项生理指标分析,五种紫花苜蓿品种的耐盐性强弱为:三得利、阿尔冈金、新疆大叶耐盐性较强,新牧1号和新牧2号耐盐性稍弱一些。对紫花苜蓿耐盐生理特性的综合分析和耐盐生理机制的初步探讨,旨在为紫花苜蓿材料耐盐性的鉴定提供可靠的生理生化指标,也为引种驯化、杂交育种以及紫花苜蓿种群的遗传分化等提供基础性的理论依据[7]。
[1] 杨晓慧,蒋卫杰,魏珉,等.植物对盐胁迫的反应及其抗盐机理研究进展[J].山东农业大学学报(自然科学版),2006,37(2):302-305.
[2] 孟林,尚春燕,毛培春,等.偃麦草属植物种质材料苗期耐盐性综合评价[J].草业学报,2009,18(4):67-74
[3] 陈托兄,陈小兵,郝文军,等.盐分对紫花苜蓿品种萌发的影响[J].北方园艺,2008,(12):38-40
[4] 张永峰,殷波.混合盐碱胁迫对苗期紫花苜蓿抗氧化酶活性及丙二醛含量的影响[J].草业学报,2009,18(1):46-50.
[5] 孙伟泽,韩博,胡晓宁,等.不同浓度盐胁迫下苜蓿丙二醛含量变化[J].安徽农业科学,2009,37(5):1905-1906.
[6] 王玉祥,张博,王涛.盐胁迫对苜蓿叶绿素、甜菜碱含量和细胞膜透性的影响[J].草业科学,2009,26(3):53-56.
[7] 吕林有,何跃,赵立仁.不同苜蓿品种生产性能研究[J].草地学报,2010,18(3):365-371.
