RNA干扰HIF-2α基因对人肺腺癌A549细胞株侵袭转移的影响
2012-10-05袁凯王勇童继春袁卫东陈栋
袁凯 王勇 童继春 袁卫东 陈栋
(南京医科大学附属常州第二人民医院胸心外科,江苏 常州 213003)
缺氧微环境在肺癌发生发展中起着重要作用,缺氧诱导因子(hypoxia-inducible factors,HIFs)是缺氧微环境中的关键分子[1]。研究认为,HIFs的功能主要是由α亚基决定的[2]。HIF-1α和 HIF-2α是其中两种亚型,两者虽然结构相似但功能存在差异。我们先前的研究显示,HIF-1α和 HIF-2α在非小细胞肺癌(non-small cell lung cancer,NSCLC)组织中广泛表达,其中 HIF-2α表达与肿瘤大小、TNM分期以及患者预后关系密切,相反HIF-1α则无明显相关[3-4]。在另 一项研 究中,我 们对人肺 腺癌A549细胞株成功进行了缺氧培养,并在多个缺氧时点进行了 HIF-α的检测。结果显示,HIF-1α对于急性缺氧环境极为敏感,其表达在4 h即至高峰,而HIF-2α在慢性缺氧环境有持续较强表达[5]。通过该项研究我们认识到,HIF-1α和 HIF-2α在缺氧过程调节中可能各有侧重,即HIF-1α是急性缺氧期的主要反应因子,而HIF-2α则主导慢性缺氧调节。NSCLC等实体肿瘤所在的慢性缺氧环境中,HIF-2α可能发挥更大的作用。本研究利用小干扰RNA(small interfering RNA,siRNA)技术抑制人肺腺癌细胞株A549中HIF-2α基因的表达,观察A549侵袭转移能力的变化,进一步探讨 HIF-2α在NSCLC中的生物作用机制。
1 资料与方法
1.1 材料 A549细胞株购自中科院上海细胞生物学研究所,pGPU6/GFP/Neo质粒购于上海GeneP-harma制药技术有限公司,实验所需各种酶购自Takara公司,鼠抗人HIF-2α单克隆抗体购自Abcam公司,Lipofectamin 2000购自Invitrogen公司,Transwells小室购自美国Corning公司,Matrigel基质胶购自美国BD Biosciences公司。
1.2 主要仪器 CY-12C便携式氧浓度监测仪(建德市梅城电化分析仪器厂);CO2培养箱(美国Thermo公司);Esco垂直流/水平流超净工作台(新加坡Esco公司);5415D小型高速离心机、5702R台式冷冻离心机(德国Eppendorf公司);Roto-Gene 3000荧光定量PCR仪(澳大利亚Corbett Research公司);台式超声细胞破碎仪(英国SANYO公司);酶标仪、电泳仪及电转仪(美国Bio-Rad公司);KHY100空气恒温摇床(上海苏豪智能系统有限公司);IX51倒置显微镜、BX51荧光显微镜(日本OLYMPUS公司)。
1.3 实验方法
1.3.1 细胞培养及分组 A549细胞在DMEM培养基中常规培养传代。实验分组:空白对照组(仅用转染试剂处理),阴性对照组(转染siRNA阴性质粒),HIF-2α-siRNA 组 (转 染 HIF-2α-siRNA 质粒)。每组设3复孔。各实验组细胞瞬时转染24 h后铺板并缺氧培养1~2 d。
1.3.2 靶向抑制HIF-2α的siRNA的设计与合成参考siRNA设计原则[6],设计4条针对 HIF-2α的siRNA,另设计1条无关序列作为阴性对照。对于每条选定的siRNA序列,设计2条编码该序列的单链寡核苷酸(single-strand oligonucleotide,ss oligo)模板,并交由上海生工生物工程技术服务有限公司合成。
1.3.3 siRNA表达载体的构建 将合成的ss oligo退火,与经过Bbs I、BamH I双酶切的质粒pGPU6/GFP/Neo连接,热转化至大肠杆菌JM109中,37℃过夜培养,碱裂解法快速抽提质粒。
1.3.4 细胞转染 胰酶消化培养A549细胞并铺板。转染前将质粒DNA及10μL脂质体分别加入250μL无血清DMEM培养基中并轻轻混匀,静置混合。然后将上述混合液加入1.5 mL无血清培养基中,混匀后将其加入漂洗过的细胞中,轻柔晃动平板使之与细胞充分接触。37℃下培养6 h后将其中的培养基吸出弃去,更换新鲜培养基并置于缺氧环境下继续培养24、48 h。
1.3.5 转染效果检测 pGPU6/GFP/Neo载体可表达GFP绿色荧光蛋白,转染后24 h和48 h分别在荧光显微镜下观察5个视野,计数100个细胞,计算转染效率。
1.3.6 qRT-PCR 按常规方法提取样品总RNA,进行实时定量 PCR 检测。HIF-2α 正义链:5′-GAAAACGAGTCCGAAGCC-3′; 反 义 链:5′-CCCAAAACCAGAGCCATT-3′。β-actin 正 义 链:5′-CTCTTCCAGCCTTCCTTCCTG-3′;反义链:5′-CAGCACTGTGTTGGCGTACAG-3′。扩 增 反 应条件为95℃90 s;95℃5 s,58℃30 s,共40个循环,计算采用2-ΔΔCT法。实验重复3次。
1.3.7 Western-blot及酶联免疫吸附法(ELISA)检测蛋白表达 按常规方法进行。
1.3.8 Transwell检测法 取100μL Matrigel稀释后铺于Transwell小室,4℃风干。胰酶消化贴壁细胞,重悬细胞并调整至密度为1×105个/mL。取200μL细胞悬液加入Transwell小室,在下室内加入含胎牛血清的完全培养基,分别缺氧培养24 h和48 h。培养结束后,取出小室并洗膜,将滤膜用甲醛固定并染色。镜下计数上、下、左、右、中5个随机视野细胞数,取均值。
1.4 统计学处理 采用SPSS 13.0统计软件进行数据处理。计量资料以均数±标准差()表示。对于多组数据比较,采用单因素方差分析(ANOVA)检验。组间两两比较时,用Levene法进行方差齐性检验。若方差齐,采用LSD检验;若方差不齐,则用Games-Howell法进行分析。P<0.05为差异有统计学意义。
2 结 果
2.1 转染 HIF-2α-siRNA 后 HIF-2αmRNA 表达水平的变化 各组细胞HIF-2αmRNA的表达水平见表1。单因素方差分析显示,各组间HIF-2αmRNA表达水平存在显著差异(转染后24 h:F=26.13,P<0.01;转染后 48 h:F=46.32,P<0.01)。与空白对照组相比,转染后缺氧培养24 h和48 h,HIF-2α-siRNA 组 HIF-2αmRNA 表达水平均下降。在转染后24 h,4条 HIF-2α-siRNA对HIF-2αmRNA的抑制率差异有统计学意义(P<0.01)。在 HIF-2α-siRNA 各组间两两比较显示,HIF-2α-siRNA-4组在转染后两个时点HIF-2α mRNA表达水平低于其他3组(P<0.01)。阴性对照组HIF-2αmRNA虽略有下降,但与空白对照组间差异无统计学意义(P>0.05)。

表1 A549细胞中 HIF-2α-siRNA对 HIF-2αmRNA表达的抑制作用
2.2 转染 HIF-2α-siRNA后 HIF-2α蛋白表达水平的变化 Western blot法检测HIF-2α蛋白表达,结果见表2及图1。单因素方差分析显示,各组蛋白表达差异有统计学意义(转染后24 h:F=16.80,P<0.01;转染后48 h:F=223.69,P<0.01)。组间两两比较显示,与空白对照组相比,HIF-2α-siRNA-1组在两个时点蛋白表达均无显著改变(P>0.05);HIF-2α-siRNA-2组在转染后48h与空白对照组相比,蛋白表达下调(P<0.01);HIF-2α-siRNA-3、4组细胞在转染后两个时点与空白对照组的HIF-2α蛋白表达水平相比均有显著下调(P<0.01),而 HIF-2αsiRNA-4相较于 HIF-2α-siRNA-3组,在转染后48 h其HIF-2α蛋白水平更低(P<0.01)。阴性对照组与空白对照组相比,在两个时点其HIF-2α蛋白表达差异无统计学意义(P>0.05)。转染 HIF-2α-siRNA-4重组质粒的A549细胞中HIF-2α蛋白下调最为显著,且在转染后48h抑制效果最好。

表2 A549细胞中HIF-2α-siRNA对HIF-2α蛋白表达的抑制作用
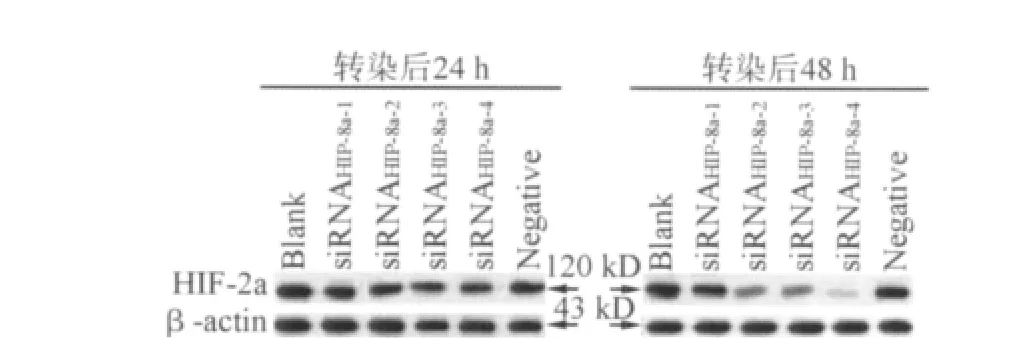
图1 各组细胞中HIF-2α蛋白的Western blot分析
2.3 HIF-2α-siRNA对 A549细胞侵袭转移的影响Transwell小室法结果如表3及图2所示。方差分析显示,各组穿膜细胞数存在显著差异(24 h:F=2471.37,P<0.01;48 h:F=191.24,P<0.01)。两两比较显示,与空白对照组相比,实验组在缺氧培养两个时点其穿膜细胞数均显著下降,差异有统计学意义(P<0.01)。阴性对照组与空白对照组相比,穿膜细胞数差异无统计学意义(P>0.05)。
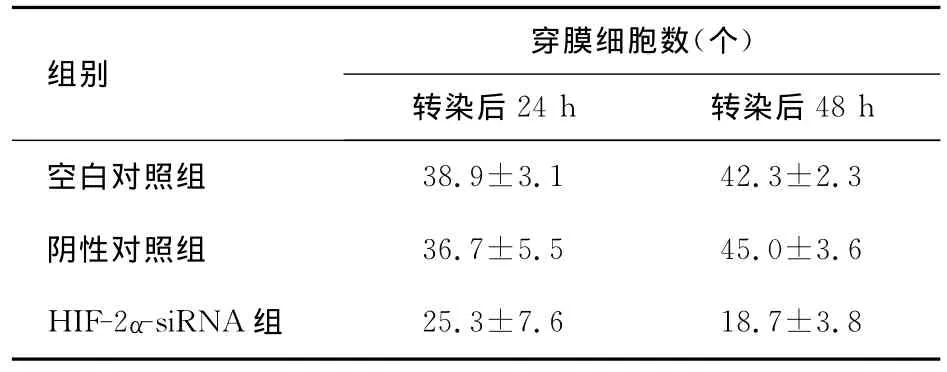
表3 各组的穿膜细胞数
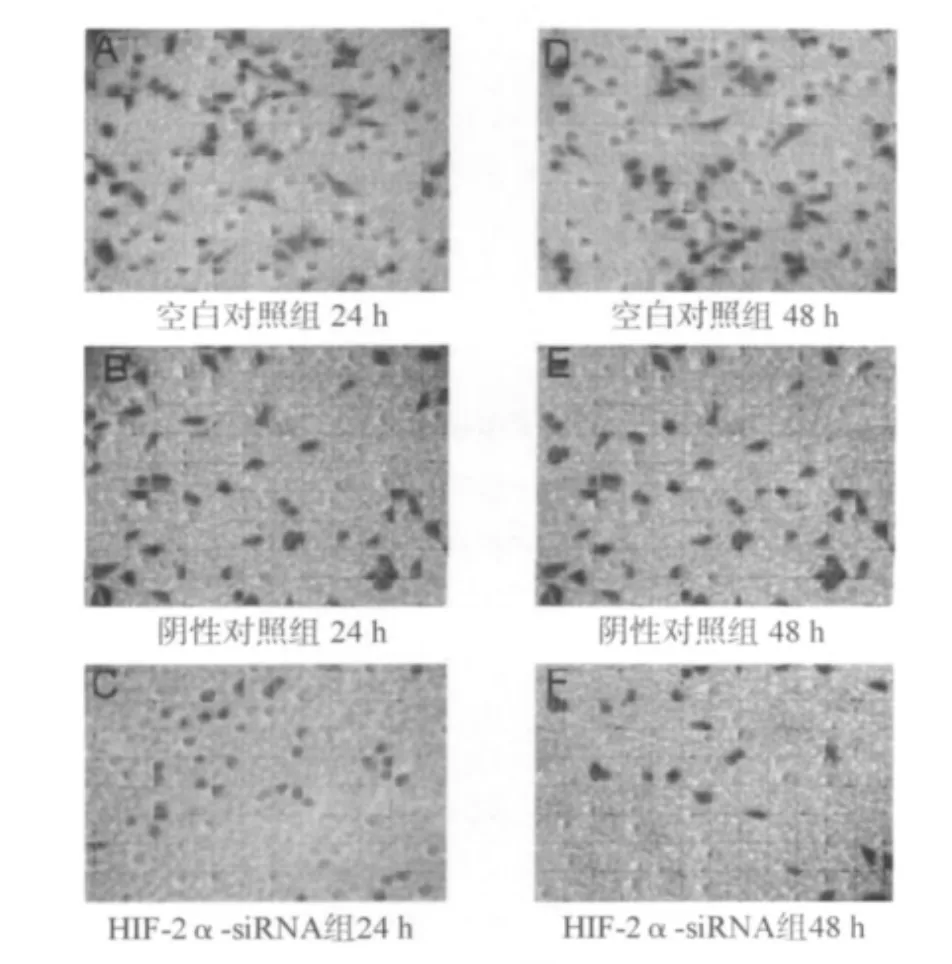
图2 Transwell法测定各组细胞的侵袭力
2.4 ELISA法检测各组细胞VEGF表达水平 本研究采用ELISA法检测各组细胞在缺氧培养24 h和48 h后血管内皮生长因子(vascular endothelial growth factor,VEGF)蛋白的表达水平,结果如表4所示。方差分析显示,各组间VEGF蛋白表达水平有显著差异(24 h:F=26.37,P<0.01;48 h:F=203.30,P<0.01)。两两比较显示,与空白对照组相比,HIF-2α-siRNA组VEGF蛋白水平在转染后两个时点均显著降低,差异有统计学意义(P<0.01)。空白对照组与阴性对照组之间VEGF蛋白表达水平差异无统计学意义(P>0.05)。

表4 各组VEGF蛋白的表达情况
3 讨 论
RNA干扰(RNA interference,RNAi)是一种进化过程中高度保守的抵御外来基因或病毒侵犯的防御机制。siRNA是RNA干扰作用赖以发生的重要中间效应分子。siRNA是一类长21~25个核苷酸的特殊dsRNA分子,siRNA的序列与所作用的靶mRNA序列具有同源性;siRNA两条单链末端为5′端磷酸和3′端羟基;每条单链的3′端均有2~3个突出的非配对的碱基。研究表明,RNAi的作用机制包括起始阶段、效应阶段及反应扩大阶段。RNAi作为基因阻断技术,具有特异性强、高效性的优点。用RNAi技术来抑制目标基因的异常表达,为治疗癌症、遗传病等疾病开辟了新的途径。
本研究构建了4条针对HIF-2α的siRNA序列发现 HIF-2α-siRNA-4对 HIF-2α的抑制效果最为明显,在转染后24 h和48 h HIF-2αmRNA表达相较于空白组下调了(60.63±5.10)%和(80.00±3.55)%;相应在蛋白水平分别下调了(31.69±11.56)%和(82.87±4.09)%。Transwell试验结果发现,HIF-2αsiRNA组穿膜细胞数显著少于两对照组(P<0.01),提示HIF-2α与A549细胞侵袭力有密切关系。
目前,关于HIF-1α和VEGF的关系研究较多且较深入,而对HIF-2α与VEGF的关系则研究较少。在 Wu等[3]的研究中,发现 VEGF的表达与 HIF-2α的蛋白表达密切相关。本研究采用siRNA技术抑制HIF-2α表达后,同样观察到在转染后24h和48h,VEGF表达较对照组显著降低,差异有统计学意义(P<0.01)。综上所述,HIF-2α有望作为靶点应用于NSCLC的治疗。
[1]Bertout J A,Patel S A,Simon M C.The impact of O2 availability on human cancer[J].Nat Rev Cancer,2008,8(12):967-975.
[2]Loboda A,Jozkowicz A,Dulak J.HIF-1 and HIF-2transcription factors-similar but not identical[J].Mol Cells,2010,29(5):435-442.
[3]Wu X H,Qian C,Yuan K.Correlations of hypoxia-inducible factor-1alpha/hypoxia-inducible factor-2alpha expression with angiogenesis factors expression and prognosis in non-small cell lung cancer[J].Chin Med J(Engl),2011,124(1):11-18.
[4]袁凯,郑如恒.HIF-2α与人非小细胞肺癌增殖及预后的关系[J].中国临床医学,2009,16(2):194-197.
[5]袁凯,钱成.缺氧诱导因子-1α和缺氧诱导因子-2α在人非小细胞肺癌表达的比较[J].中华实验外科杂志,2010,27(5):614-616.
[6]Elbashir S M,Harborth J,Weber K,et al.Analysis of gene function in somatic mammalian cells using small interfering RNAs[J].Methods,2002,26(2):199-213.
