胃癌组织中HERG的表达及其临床意义
2012-10-05邵晓冬张永国陈江林浩郭晓钟
邵晓冬 张永国 陈江 林浩 郭晓钟
(沈阳军区总医院消化内科,辽宁 沈阳 110016)
新近的研究[1]提示,某些钾离子通道(voltagegated potassium channels,KV)与恶性肿瘤的发生发展有关,其中电压门控钾离子通道与肿瘤的关系已成为研究的热点。人类eag相关基因(human ether-a-go-go-related gene,HERG)编 码 的 HERG蛋白是延迟整流型钾离子通道的α亚单位。国外已有研究[2]发现,HERG蛋白在多种肿瘤细胞中呈高表达。本研究旨在探讨HERG蛋白在胃癌组织中的表达水平及其临床意义。
1 资料与方法
1.1 一般资料 收集沈阳军区总医院2000年—2002年经手术切除的45例原发性胃癌的组织标本及相应的癌旁正常胃组织(距离胃癌组织手术切缘>5 cm的胃组织)。45例患者中,男性26例,女性19例;年龄42~75岁;其中高分化腺癌13例,中分化腺癌14例,低分化腺癌18例;根据胃癌Borrmann大体分型:0型1例,Ⅰ型7例,Ⅱ型16例,Ⅲ型15例,Ⅳ型6例;26例患者有局部淋巴结浸润,所有患者的肿瘤均无远处器官的转移;根据国际抗癌联盟TNM标准分期:Ⅰ期4例,Ⅱ期14例,Ⅲ期20例,Ⅳ期7例。
1.2 免疫组化染色(SP染色法) 所有标本在10%多聚甲醛溶液中固定,脱水后以石蜡包埋、切片备用。组织切片经二甲苯脱蜡及梯度乙醇脱水;然后将切片置于3%过氧化氢室温放置20 min;切片表面加10%正常兔血清封闭液后将其置于湿盒中,37°C放置20min;按1∶200在切片表面滴加羊抗人HERG多克隆抗体,然后置于湿盒中,4℃过夜;加生物素标记的兔抗羊IgG,置于湿盒中,37℃放置30 min;滴加SP工作液,置于湿盒中,37℃放置30 min;3,3-四盐酸二氨基联苯胺(DAB)显色,用自来水反复冲洗终止反应;苏木精衬染;梯度乙醇及二甲苯透明并封片。
1.3 组织染色结果判定 显微镜下观察组织染色结果,分别根据染色强度和阳性细胞数比率对组织染色赋值。染色强度:细胞膜、细胞质或(和)细胞核呈淡棕色为弱阳性(+),呈棕色为阳性(++),呈深棕色为强阳性(+++),无信号为阴性(-)。阳性细胞数比率得分:无阳性细胞为0分;阳性细胞数比率<33%为0.33分;阳性细胞数比率33%~67%为0.67分;阳性细胞数比率67%~100%(1分)。然后根据染色强度和阳性细胞数比率得分的乘积判定各标本的染色指数。
1.4 统计学处理 采用SPSS 13.0统计软件进行数据处理,所有数据均以均数±标准差表示,组间比较采用方差分析,两两比较采用最小显著差法。以P<0.05为差异有统计学意义。
2 结 果
免疫组化结果显示,HERG蛋白在胃癌细胞的细胞质和细胞膜中有表达,而在正常的胃上皮细胞中不表达,见图1。对胃癌组织中HERG蛋白的表达水平与胃癌患者的临床病理资料进行统计学分析,结果显示,HERG蛋白的表达水平与患者的年龄、性别和胃癌的Borrmann大体分型无显著相关(P>0.05);HERG蛋白在低分化胃癌组织中的表达水平显著高于在高分化和中分化胃癌组织的表达水平(P<0.05);III、IV 期(按国际抗癌联盟 TNM分期)胃癌组织中HERG蛋白的染色强度显著高于I、II期胃癌组织(P<0.05);伴有淋巴结转移的胃癌组织中HERG蛋白的表达水平显著高于不伴有淋巴结转移的胃癌组织(P<0.05),见表1。
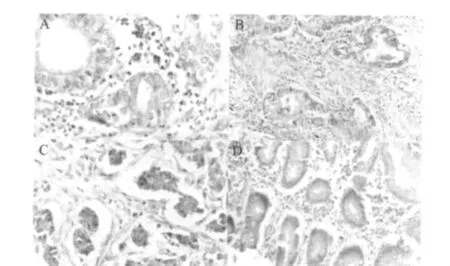
图1 HERG蛋白在胃癌组织及癌旁正常胃组织中的表达

表1 45例胃癌患者组织中HERG蛋白与胃癌临床、病理学特征之间关系
3 讨 论
HERG基因筛选自人的海马cDNA文库,该基因定位于人的7号染色体长臂,含16个外显子,编码含1159个氨基酸的多肽,分子量约127000。HERG通道非常特殊,其具有外向钾离子通道家族的结构特点(六次跨膜片段),但却表现为内向整流和细胞外钾浓度依赖性等内向整流钾离子通道的特点[3]。HERG电流的特点:(1)依赖去极化的活化门控开放,快速使超极化依赖的通道失活,导致电导降低,产生内向整流;(2)对III型抗心律失常药物敏感;(3)增大电导的细胞外钾浓度依赖性。
研究[4]发现,在包括小鼠和人的不同种系的神经母细胞瘤细胞系中都有HERG样电流,这种电流的电压门控特点为内在的失活和活化,此特点使得该类通道能在神经母细胞瘤静息膜电位的中心范围内(约-40 mV)发挥功能。这种通道的门控特点与细胞周期的控制机制相关,即在非同步化的细胞中HERG样电流的激活曲线变化很大,而在同步化处于G1期的细胞中这种变化则较小。
有研究[5]表明,HERG基因和 HERG蛋白在原发子宫内膜癌中高度表达,而在正常和增生的子宫内膜中不表达。在肿瘤细胞中,HERG样电流有助于维持细胞去极化的静息电位,这是肿瘤细胞的常见特征之一。在嗜铬细胞瘤、小细胞肺癌、垂体瘤和胰腺β-细胞瘤细胞中都可检测到 HERG样电流[6]。
Smith等[7]在3种白血病细胞中[T细胞淋巴母细胞白血病(CEM),慢性骨髓性白血病(K562)和组织细胞性白血病(U937)]均检测到HERG电流,且发现电流强度与蛋白丰度相关;HERG电流在这些白血病细胞系的增殖中发挥作用;Smith等的研究还显示,HERG基因在增殖的非癌性细胞(激活的扁桃体细胞、EB病毒转化的细胞和干燥综合征患者的细胞)中的表达并不高于正常细胞。Pillozzi等[8]的研究发现,在正常的外周血单核细胞和循环中的CD34+细胞中HERG基因无表达,然而当CD34+细胞被细胞因子或生长因子激活进入有丝分裂时,会出现HERG基因的快速表达。HERG样电流在小鼠心脏中的表达呈现出一种明显的动态变化趋势,在胎心细胞中HERG样电流占绝对优势,而在成熟的心肌细胞则丧失了优势;但是,当成熟的心肌细胞去分化或癌变时,HERG样电流则重新获得其在钾离子通道电流中的表达优势。同样,在神经嵴神经元的发育过程中,HERG电流仅在神经元发育的极早阶段有瞬时的表达,而后即被内向整流性钾电流所取代[9]。上述现象与临床常用的肿瘤标志物(如甲胎蛋白和癌胚抗原)具有相似性,HERG蛋白具有成为诊断恶性肿瘤的标志物的潜力。
本研究结果显示,HERG蛋白定位于胃癌细胞的细胞膜和细胞质,HERG蛋白的表达水平与胃癌的组织分化程度、TNM分期和淋巴结转移相关,说明HERG有望成为可以预测胃癌患者预后的标志物。Lastraioli等[10]发现,HERG通道的活性与多种结肠癌细胞系的侵袭能力有关,HERG蛋白的表达量与结肠癌细胞的侵袭表型相关。该报告与本研究结果均提示,HERG蛋白与胃肠道恶性肿瘤的发生有关,其具体机制尚有待进一步研究。
[1]Inglis V,Karpinski E,Benishin C.Gamma-dendrotoxin blocks large conductance Ca2+-activated K+channels in neuroblastoma cells[J].Life Sci,2003,73(18):2291-2305.
[2 ]Crociani O,Guasti L,Balzi M.Cell cycle-dependent expression of HERG1 and HERG1B isoforms in tumor cells[J].J Biol Chem,2003,278(5):2947-2955.
[3]Trudeau MC,Warmke JW,Ganetzky B,et al.HERG,a human inward rectifier in the voltage-gated potassium channel family[J].Science,1995,269(5220):92-95.
[4]Chiesa N,Rosati B,Arcangeli A,et al.A novel role for HERG potassium channels:spike frequency adaptation[J].J Physiol,1997,501(Pt 2):313-318.
[5]Cherubini A,Taddei GL,Crociani O,et al.HERG potassium channels are more frequently expressed in human endometrial cancer as compared to non-cancerous endometrium[J].Br J Cancer,2000,83(12):1722-1729.
[6]Bianchi L,Wible B,Arcangeli A,et al.herg encodes a K+current highly conserved in tumors of different histogenesis:a selective advantage for cancer cells[J]?Cancer Res,1998,58(4):815-822.
[7]Smith GA,Tsui HW,Newell EW.Functional up-regu lation of HERG K channels in neoplastic hematopoietic cells[J].J Biol Chem,2002,277(21):18528-18534.
[8]Pillozzi S,Brizzi MF,Balzi M,et al.HERG potassium channels are constitutively expressed in primary human acute myeloid leukemias and regulate cell proliferation of normal and leukemic hemopoietic progenitors[J].Leukemia,2002,16(9):1791-1798.
[9]Wang H,Zhang Y,Cao L,et al.HERG K+ channel,a regulator of tumor cell apoptosis and proliferation[J].Cancer Res,2002,62(17):4843-4848.
[10]Lastraioli E,Guasti L,Crociani O,et al.herg1 gene and HERG1 protein are overexpressed in colorectal cancers and regulate cell invasion of tumor cells[J].Cancer Res,2004,64(2):606-611.
