铁基生物絮凝剂去除废水中的氟和铅
2012-09-29闵小波柴立元尹一男
苗 雨,闵小波,柴立元,尹一男
(1. 中南大学 冶金科学与工程学院,长沙 410083;2. 中南大学 国家重金属污染防治工程技术中心,长沙 410083)
铁基生物絮凝剂去除废水中的氟和铅
苗 雨1,2,闵小波1,2,柴立元1,2,尹一男1,2
(1. 中南大学 冶金科学与工程学院,长沙 410083;2. 中南大学 国家重金属污染防治工程技术中心,长沙 410083)
采用自制的铁基生物絮凝剂对废水中氟、铅进行脱除。考察铁基生物絮凝剂投加量、pH、反应时间对F−、Pb2+去除效果的影响。结果表明:随铁基生物絮凝剂投加量的增加,F−、Pb2+去除率上升;酸性条件有利于F−去除率的提高,碱性条件有利于 Pb2+去除率的提高;随反应时间的延长,F−、Pb2+去除率先上升后下降。在铁基生物絮凝剂投加量为7.5%(体积分数),pH值为6,反应时间为20 min的条件下,F−、Pb2+去除率分别为69.75%和99.89%,水中残余F−、Pb2+浓度分别为6.05 mg/L和0.226 mg/L,均低于国家《铅、锌工业污染物排放标准》(GB25466—2010)规定的限值。
铁基生物絮凝剂;氟去除;铅去除;废水
Abstract:Fluoride and lead in the wastewater were removed with self-prepared iron-bioflocculant. The effects of the iron-bioflocculant dosage, pH, reaction time on the removal rate of fluoride and lead were also studied. The results show that the removal rates of F−and Pb2+increase with the increase of dosage of iron- bioflocculant. F−can be removed more effectively under acidic condition, while alkaline iron solution is good for removing Pb2+. When the reaction time increases, the removal efficiency of F−and Pb2+rise at the beginning then declines. In addition, the optimum treatment efficiency of the F−and Pb2+is obtained when dosage is 7.5% (volume fraction), pH value is 6 and reaction time is 20 min. Under these conditions, the removal rates of F−and Pb2+are 69.75% and 99.89%, respectively, and the residual concentrations of F−and Pb2+are 6.05 mg/L and 0.226 mg/L, respectively, which are both lower than the emission standards of pollutants for lead and zinc industry at the same time.
Key words:iron-bioflocculant; fluroide removal; lead removal; wastewater
近年来,氟、铅污染事件频发,对环境及社会造成严重危害。工业上,含氟矿石开采、金属冶炼、半导体制造、电镀等都会排放大量含氟废水。长期饮用高氟水会危害人的健康,严重的会引起氟斑牙和氟骨病。铅是工业中常用的金属之一,铅污染物质是当今对人类健康威胁最大的十大类污染物质之一[1]。因此,去除水体中的F−、Pb2+具有重要意义。
含氟废水的处理方法主要如下[2−4]:化学沉淀法、絮凝沉淀法、吸附法、反渗透法、电渗析法和液膜法等,前3种方法应用较多。对于高浓度含氟废水常用钙盐沉淀法处理,但很难达标。用石灰处理后的废水中氟含量一般不会低于20~30 mg/L[5]。絮凝沉淀法适用于含氟较低的废水处理。吸附法适用于水量较小、低浓度含氟废水的处理。含铅废水的处理方法主要如下[6−8]:化学沉淀法、絮凝沉淀法、离子交换法、吸附法和电解法等。絮凝沉淀法是目前国内外普遍使用的一种水质处理的前置单元操作技术,是一种既经济又简便的水处理技术,絮凝剂种类繁多,其中无机絮凝剂按金属盐可分为铝盐系及铁盐系[9]。
在本研究中,所用铁基生物絮凝剂是采用生物法自制的无污染、低成本的环境友好型水处理剂,其中含有部分微生物生物体,不同于传统的铁盐水处理剂。目前,对处理含单一 F−或是单一 Pb2+的废水研究较多[10−14],而同时处理F−、Pb2+混合废水的研究较少。工业废水中含有多种离子,虽然可以通过分步法逐一去除各种离子,但是相应地增加了工序,从而增加了成本。因此,研究一种药剂同一过程去除废水中多种离子是很有意义的。同时,对于絮凝剂除铅机理的研究较多,但是对除氟机理的研究较少,尤其是不同pH对除氟效果影响的机理研究甚少。本文作者采用絮凝沉淀法,先对铁基生物絮凝剂处理含氟和含铅废水分别进行了研究,考察铁基生物絮凝剂投加量、pH、反应时间对F−、Pb2+去除效果的影响,确定基本工艺参数。然后研究铁基生物絮凝剂处理F−、Pb2+混合废水的最佳条件,旨在为废水处理过程同时除氟除铅提供依据,也为去除废水中多种离子提供参考。同时,通过分析不同pH下铁基生物絮凝剂本身絮体及含氟絮体的红外光谱图,研究除氟机理。
1 实验
1.1 实验试剂与仪器
(1) 实验试剂
铁基生物絮凝剂(自制):以FeSO4·7H2O为原料,选用氧化亚铁硫杆菌,经过一系列氧化、水解、聚合反应得到液态铁基生物絮凝剂,Fe3+浓度为40 g/L[15]。
总离子强度缓冲调节剂(TISAB自配):称取58 g氯化钠,10 g柠檬酸钠溶于500 mL蒸馏水中,加入57 mL冰醋酸,搅拌溶解,再用6 mol/L NaOH溶液调节pH值到5.0~5.5之间,引入1 L容量瓶,加蒸馏水稀释至刻度,盖上玻璃塞,摇匀。
含氟废水:采用NaF与蒸馏水配制F-浓度为20 mg/L的废水。
含铅废水:用Pb(NO3)2与蒸馏水配制Pb2+浓度为200 mg/L的废水。
含F−、Pb2+废水:用NaF、Pb(NO3)2与蒸馏水配制F-浓度为20 mg/L,Pb2+浓度为200 mg/L的混合废水。
所用试剂均为分析纯。
(2) 实验仪器
F−选择性电极,饱和甘汞电极,PHS−3E酸度计,电磁力搅拌器,TAS−990型原子吸收分光光度光度计,Nicolet IS10傅立叶红外光谱仪。
1.2 实验过程
取200 mL配制好的模拟废水置于500 mL烧杯中,在磁力搅拌下,加入一定量的铁基生物絮凝剂,用5 mol/L NaOH溶液调节废水pH到一定值,待读数稳定后开始计时,反应一定时间后,关闭电磁力搅拌器,静置沉降 10 min后,取上清液测定溶液中残余F−、Pb2+浓度。
1.3 分析方法
(1) 氟含量的测定:采用直接电位法,由标准曲线确定废水中F−浓度[16]。
(2) 铅含量的测定:采用原子吸收分光光度法测定废水中Pb2+浓度[17]。
(3) 红外光谱分析:将液体样品置于烘箱中,于50 ℃左右烘干并研磨成粉末状,以KBr做本底,采用压片法用傅立叶红外光谱仪测其谱图。
2 结果与讨论
2.1 各因素对含氟废水处理的影响
2.1.1 投加量对F−去除率的影响
在原水为200 mL、pH值为5、反应时间为30 min的条件下,考察了铁基生物絮凝剂投加量对F−去除率的影响,结果如图1所示。由图1可知,F−去除率随铁基生物絮凝剂投加量的增加而升高。这是因为随着投加量的增加,铁基生物絮凝剂水解得到的带正电荷的多核离子增加,这些离子对F−的静电吸引以及产生的吸附架桥作用增强,从而提高了F−去除率。当投加量为4%(体积分数)时,F−去除率达到66.65%,水中残余F−浓度为6.67 mg/L,低于国家《铅、锌工业污染物排放标准》(GB25466—2010)规定的8 mg/L限值。
2.1.2 pH对F−去除率的影响
在铁基生物絮凝剂投加量为4%(体积分数)、反应时间为30 min的条件下,pH对F−去除率的影响如图2所示。由图2可知,pH是影响F−去除率的一个重要因素,弱酸性条件有利于 F−的去除,pH越高,除氟效果越差。pH值在4~6之间,F−浓度低于国家《铅、锌工业污染物排放标准》(GB25466—2010)规定的限值,当pH值从6上升到7时,F−去除率下降很明显,从65.25%下降到35.95%,当pH值为10时,F−去除率降至11. 45%,再升高pH值,F−去除率不再降低。考虑到pH值为4时,处理水略显黄色,因此,选取最佳pH值为5。
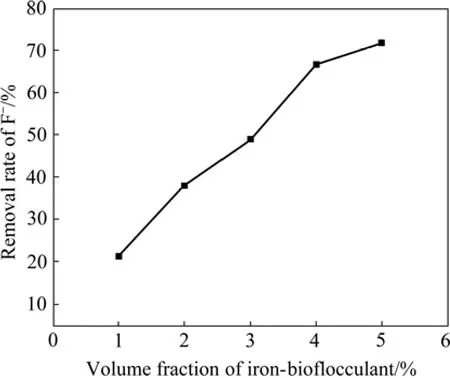
图1 铁基生物絮凝剂投加量对F−去除率的影响Fig.1 Effect of iron-based water treatment agent dosage on removal of F−
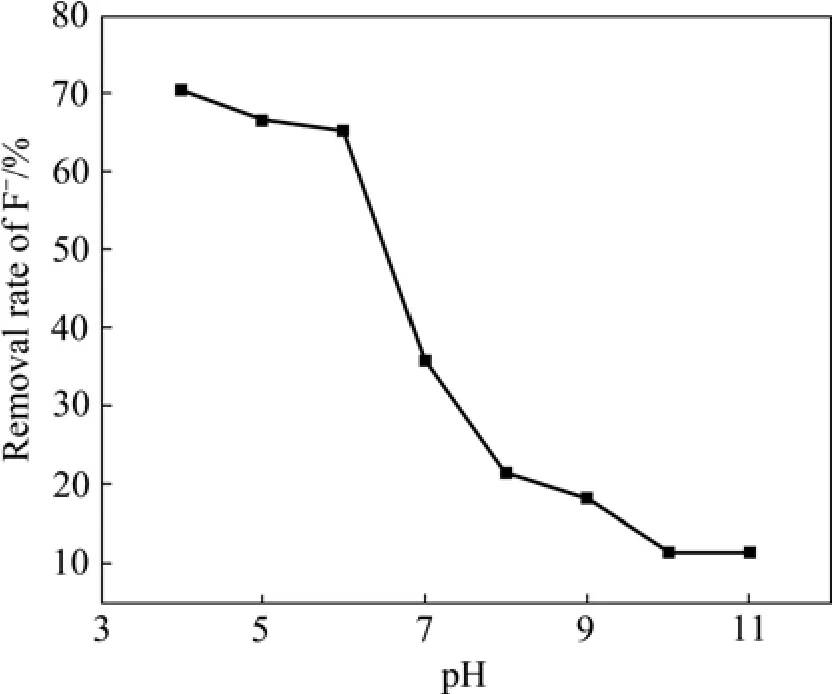
图2 pH对F−去除率的影响Fig.2 Effect of pH on removal of F−
2.1.3 反应时间对F−去除率的影响
在铁基生物絮凝剂投加量为4%、pH值为5的条件下,反应时间对F−去除率的影响如图3所示。由图3可知,F−去除率随反应时间增加先升高后降低。这是因为刚开始随着反应时间增加,絮体逐渐增大,通过絮凝吸附、架桥等作用可以很好地去除F−,但是反应时间过长,絮体在剪切力作用下被破坏,使F−重新回到水中。在30~60 min之间,去除率在63.80%以上,水中残余F−浓度小于7.24 mg/L,低于国家《铅、锌工业污染物排放标准》(GB25466—2010)规定的限值。因此,选定反应时间为30 min。
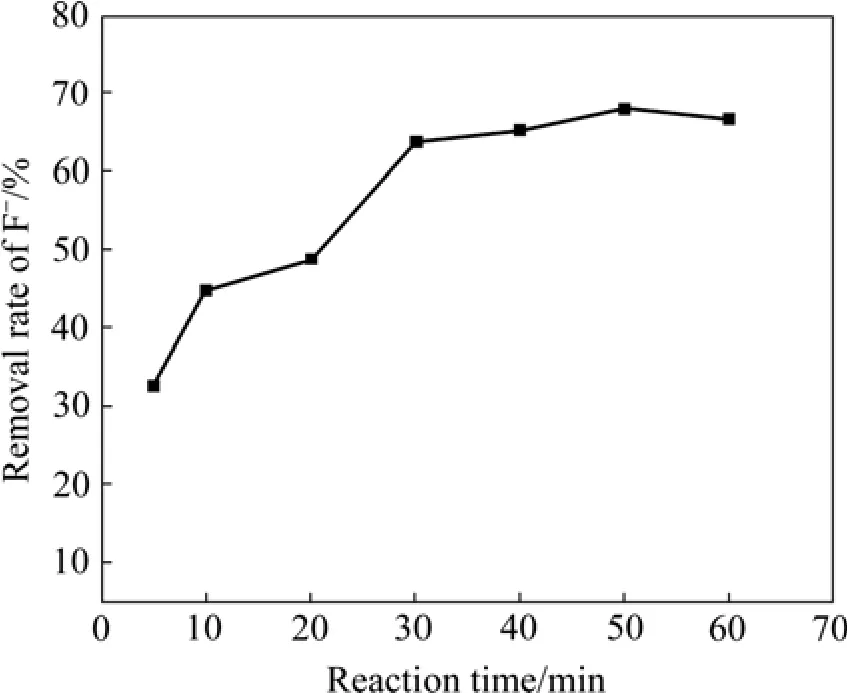
图3 反应时间对F−去除率的影响Fig.3 Effect of reaction time on removal of F−
2.2 各因素对含铅废水处理的影响
2.2.1 投加量对Pb2+去除率的影响
在原水为200 mL,pH值为8,反应时间为30 min的条件下,考察了铁基生物絮凝剂投加量对Pb2+去除率的影响,结果如图4所示。由图4可知,Pb2+去除率随铁基生物絮凝剂投加量的增加而升高。当投加量为2%时,Pb2+去除率为99.82%,水中残余Pb2+浓度为0.354 mg/L,低于国家《铅、锌工业污染物排放标准》(GB25466—2010)规定的0.5 mg/L限值。
2.2.2 pH对Pb2+去除率的影响
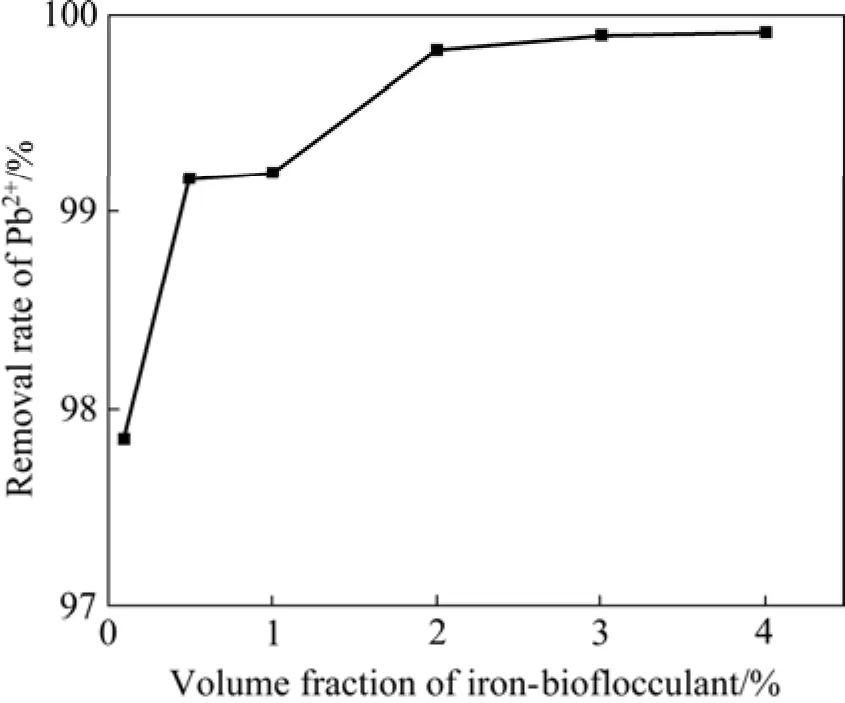
图4 铁基生物絮凝剂投加量对Pb2+去除率的影响Fig.4 Effect of iron-based water treatment agent dosage on removal rate of Pb2+
在铁基生物絮凝剂投加量为 2%,反应时间为30 min的条件下,pH对Pb2+去除率的影响如图5所示。由图5中1号曲线可知,不加铁基生物絮凝剂,只用氢氧化钠调节体系的pH,Pb2+去除率随pH升高而升高,当pH从7升高至8时,Pb2+去除率有显著提高,从33.4%提高至79.8%,当pH值为11时,Pb2+去除率达到最高,为 79.8%,水中残余 Pb2+浓度为 3.77 mg/L,但仍不能达到国家《铅、锌工业污染物排放标准》(GB25466—2010)规定的标准。这可能与 Pb2+的形态分布有关,pH小于7时,主要以游离Pb2+以及少量PbOH+和Pb4(OH)44+存在;当pH在8~11时,主要以Pb6(OH)84+以及少量的PbOH+和Pb(OH)2等存在;当pH大于12.0时,主要以Pb(OH)3−以及少量Pb(OH)2和Pb6(OH)84+形态存在[18]。由图5中曲线2可知,pH对铁基生物絮凝剂除铅效果有重要的影响。当pH值较低时,溶液中的H+会与Pb2+竞争,导致Pb2+去除率较低。随着pH升高,Pb2+去除率升高,当pH值大于7后,水中残余Pb2+浓度即可低于国家《铅、锌工业污染物排放标准》(GB25466—2010)规定的限值,说明铁基生物絮凝剂对Pb2+絮凝较好。比较两条曲线可得,在相同的pH值下,加入铁基生物絮凝剂,会使Pb2+去除率大大提高,而且可以使水中残余 Pb2+浓度低于国家《铅、锌工业污染物排放标准》(GB25466—2010)规定的限值。
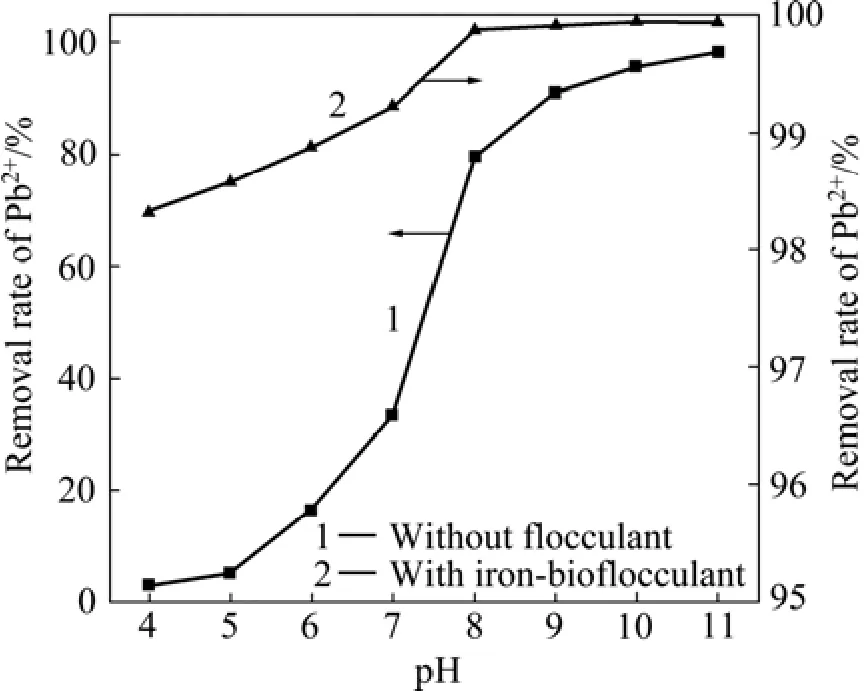
图5 pH对Pb2+去除率的影响Fig.5 Effect of pH on removal of lead
2.2.3 反应时间对Pb2+去除率的影响
在铁基生物絮凝剂投加量为2 mL/100 mL,pH值为8的条件下,反应时间对Pb2+去除率的影响如图6所示。由图6可知,Pb2+去除率随反应时间增加而先升高后降低。这是因为适当的搅拌可以增加颗粒间的碰撞几率,从而使絮凝体增大,絮凝效果提高。但搅拌时间过长会导致絮凝体磨蚀和碎裂,重新分散于溶液中,从而使水中残余Pb2+浓度升高。在30 min时达到最大值,Pb2+去除率为99.86%。考虑到在20 min时,水中残余Pb2+浓度为0.407 mg/L,已低于国家《铅、锌工业污染物排放标准》(GB25466—2010)规定的限值。因此,控制反应时间为20 min即可。
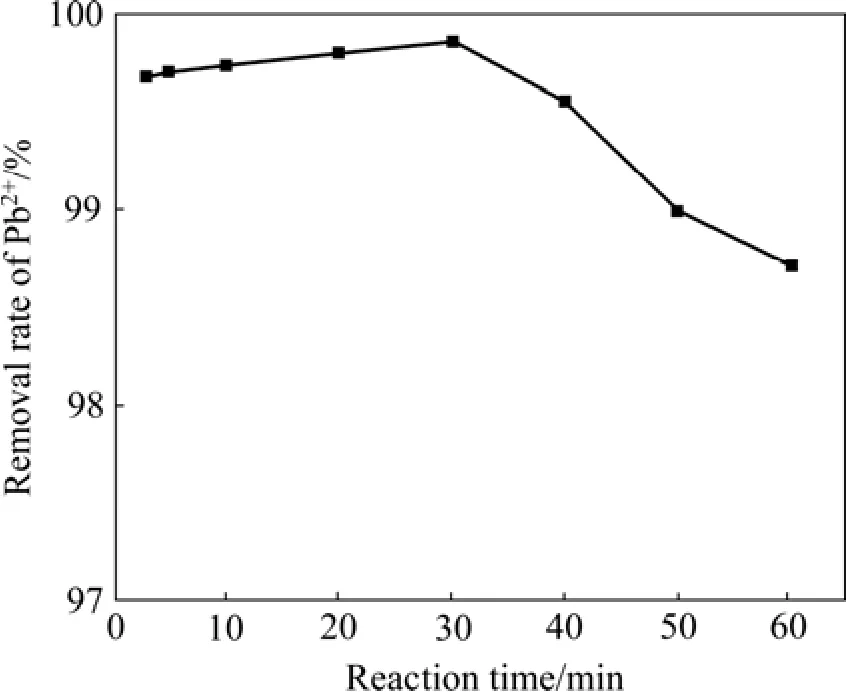
图6 反应时间对Pb2+去除率的影响Fig.6 Effect of reaction time on removal rate of Pb2+
2.3 各因素对含F−、Pb2+废水处理的影响
2.3.1 投加量对F−、Pb2+去除率的影响
在原水为200 mL,pH值为6,反应时间为30 min的条件下,考察了铁基生物絮凝剂的投加量对 F−和Pb2+去除率的影响,结果如图7所示。由图7可知,当投加量为7.5%时,F−去除率达68.00%,Pb2+去除率达99.79%,废水中残余F−浓度为6.4 mg/L,Pb2+浓度为0.42 mg/L,均达到国家《铅、锌工业污染物排放标准》(GB25466—2010)规定的要求。因此,选取最佳投加量为7.5%。
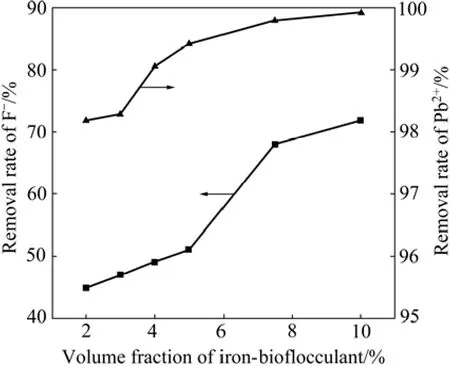
图7 铁基生物絮凝剂投加量对F−和Pb2+去除率的影响Fig.7 Effect of iron-based water treatment agent dosage on removal rates of F−and Pb2+
2.3.2 pH对F−、Pb2+去除率的影响
在铁基生物絮凝剂投加量为 7.5%、反应时间为30 min的条件下,考察了pH对F−和Pb2+去除率的影响,结果如图8所示。由图8可知,当pH值为4时,F−去除率最大,水中残余F−浓度低至3.75 mg/L,而当pH值为11时,Pb2+去除率最大,水中残余Pb2+浓度降至0.140 mg/L。pH在4~6之间,水中残余F−浓度可低于国家《铅、锌工业污染物排放标准》(GB25466—2010)规定的限值。当pH值在6~11时,废水中残余Pb2+浓度可达到国家《铅、锌工业污染物排放标准》(GB25466—2010)规定的限制。因此,在pH值为6时,废水中残余F−、Pb2+浓度可以同时达标。
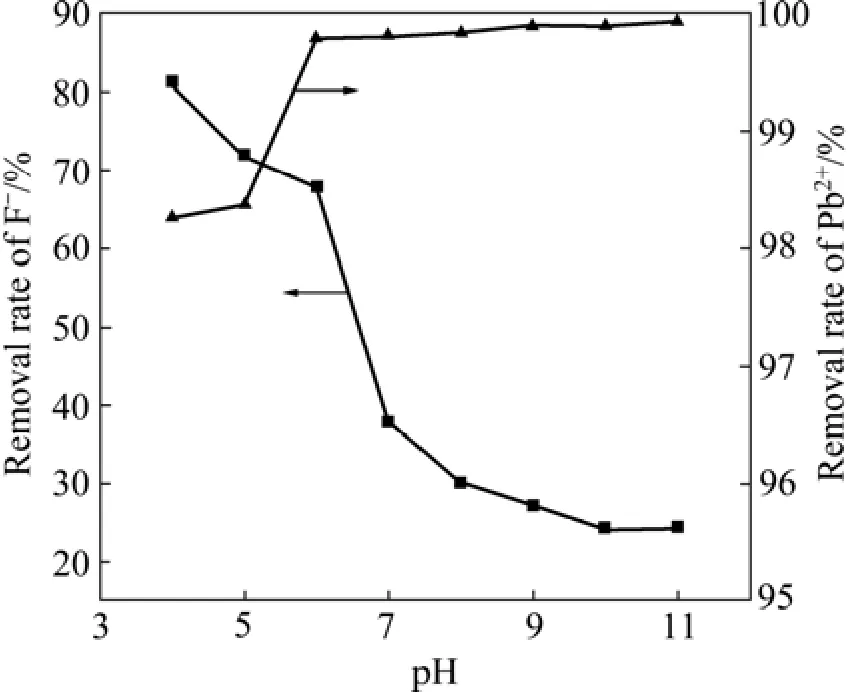
图8 pH对F−和Pb2+去除率的影响Fig.8 Effect of pH value on removal rate of F−and Pb2+
2.3.3 反应时间对F−、Pb2+去除率的影响
在铁基生物絮凝剂投加量为7.5%、pH值为6的条件下,考察了反应时间对F−和Pb2+去除率的影响,结果如图9所示。由图9可知,当反应时间在20~60 min之间,F−去除率达69.75%以上;当反应时间为20 min时,Pb2+去除率达到最大,为99.89%,水中残余Pb2+浓度为0.226 mg/L,此时F−去除率为69.75%,水中残余F−浓度为6.05 mg/L。因此,最优反应时间为20 min。
2.3 铁基生物絮凝剂除氟、铅机理研究
pH对 F−去除率有重要影响。因此,通过比较不同pH值下,铁基生物絮凝剂本身絮体及含氟絮体的红外光谱图对除氟机理进行研究。图10所示为pH对铁基生物絮凝剂本身絮体与含氟絮体红外图的影响。由图10(a)可知,铁基生物絮凝剂本身絮体的红外光谱的基本图形不随 pH 变化而变化,只是在波数为1 100~1 200 cm−1范围内的吸收峰强发生变化。由图10(b)可知,pH为4~6,含氟絮体的红外光谱的基本图形与pH为7~11的光谱图有差异,pH为4~6时,在波数为1 100~1 200 cm−1范围内出现两个吸收峰。由实验部分可知,在此pH范围内,除氟效果最佳。因此,研究红外谱图中出现的这两个吸收峰是解释前述实验结果的关键。
陈绪钰认为[19],当pH值偏高时,水中高凝聚力的高正价多核络合离子如[Fe(H2O)6]3+、[Fe2(H2O)8(OH)2]4+、[Fe3(H2O)5(OH)4]5+的量相应减少,而最终形成Fe(OH)3沉淀,减少了对F−的静电吸引以及产生的吸附、架桥交联等作用;絮体表面的正电荷减少,对F−的吸附减少;溶液中的OH−浓度增大,与F−发生竞争吸附,会使F−去除率降低。兴虹[20]认为,改性聚铁除氟机理有以下几种方式。
(1) Fe3+与F−发生如下络合反应:
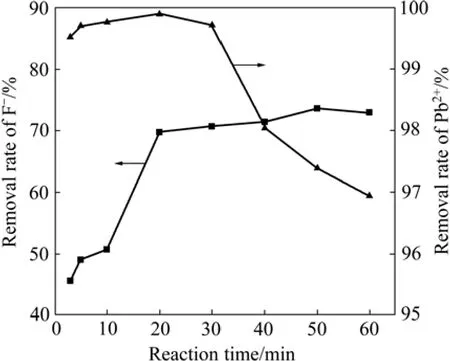
图9 反应时间对F−和Pb2+去除率的影响Fig.9 Effect of reaction time on removal of fluoride and lead

(2) 废水呈碱性状态时,一部分Fe3+与OH−生成氢氧化铁沉淀,反应式如下:

氢氧化铁沉淀在形成时,以水中其他细微悬浮物为晶核逐渐长大,氢氧化铁沉淀颗粒的增大有利于沉降,其中作为晶核的物质也随之去除。另外,氢氧化铁本身也是吸附剂,可以吸附水中的F−,进一步降低废水中的氟含量。
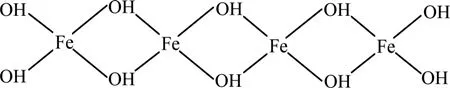
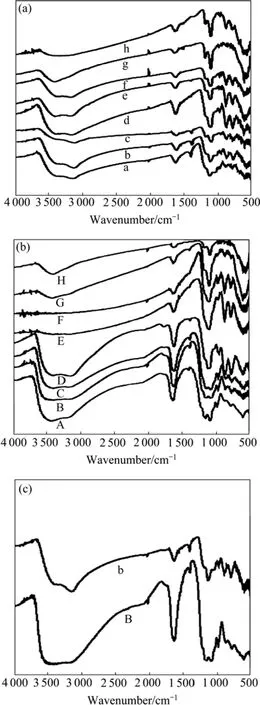
图10 pH对铁基生物絮凝剂本身絮体与含氟絮体红外图的影响Fig.10 Effects of pH on IR spectra of F−free and F−containing flocs of iron-bioflocculant: (a) IR spectra of F−free containing flocs of iron-bioflocculant at different pH; (b) IR spectra of F−containing flocs of iron-bioflocculant at different pH; (c) IR spectra of F−free and F−containing flocs of iron-bioflocculant at pH of 5
(3) 当反应体系的pH值达到8以上时,铁系絮凝剂发生水解,形成以下的结构:吸收峰,在含氟絮体红外谱图中出现1 160 cm−1和1 100 cm−1的两个峰,可能是由絮体中的铁氟络离
其中,
(4) 改性聚铁除氟的另一种方式:
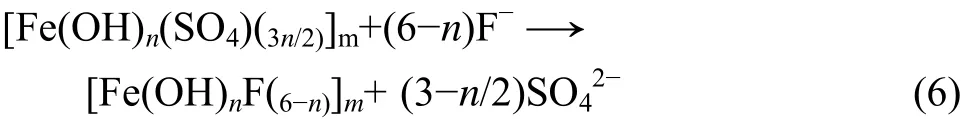
由此可见,聚铁的加入是利用了络合原理和吸附共沉淀两种方式除氟。
另外,卢建杭[21]在研究铝盐混凝去除F−的机理时指出,铝盐含氟絮体的红外谱图于铝盐絮体谱图相比,在400~1 200内的谱峰,位置和形状都有很大的改变,原先的谱峰基本消失,在965 cm−1和590 cm−1处出现两个吸收峰,认为是由絮体中的铝氟络离子的振动引起的。
因此,对于本实验,在 pH为 4~6时,波数为1 100~1 200 cm−1范围内出现的两个吸收峰,可能是由絮体中的铁氟络离子的振动引起的。结合实验结果,pH为 4~6时,铁基生物絮凝剂除氟效果较好;而当pH值从6上升到7时,F−去除率下降很明显,从65.25%下降到 35.95%;pH为 7~11时,对 F−去除率在11.45%~35.95%。因此,图10(b)表明,pH为4~6时,铁基生物絮凝剂除氟机理可能主要是Fe3+与F−发生络合反应,且这种络合作用可以大大提高F−去除率;pH为7~11时,铁基生物絮凝剂对氟有一定的去除,这可能是废水呈碱性状态时,主要是铁基生物絮凝剂水解形成的系列产物通过吸附共沉淀等作用将F−去除。
在实验最佳pH为5的条件下,将含氟絮体与铁基生物絮凝剂本身絮体的红外光谱图进行比较,由图10(c)所示。在3 000~3 600 cm−1范围内,含氟絮体红外谱图出现较宽强吸收峰,表明在这个波数范围内,含氟絮体中存在大量由O—H、F—H形成的链内、链间氢键,因氢键的长短和强弱不同,使得其伸缩峰出现在一较宽的频率范围内。在铁基生物絮凝剂本身絮体红外谱图中出现的1 630 cm−1处的吸附水、配位水和结晶水的弯曲振动吸收峰,在含氟絮体红外谱图中位置发生偏移,移向高频处,且峰强增加,这表明F−与铁基生物絮凝剂中的—OH可能发生氢键作用。铁基生物絮凝剂本身絮体红外谱图中 1 131 cm−1处的子引起的。因此,由图10(c)可知,pH为5的条件下,铁基生物絮凝剂除氟作用机理包括铁氟络合作用,以及F−以氢键或其他作用方式吸附在絮体上,通过吸附共沉淀作用将氟去除。
铁基生物絮凝剂是富含羟基的高分子聚合物,羟基中氧原子的电子结构是,氧原子外层的电子为 sp3杂化状态,其中有两个未共用的电子对占据两个 sp3杂化轨道,可以与 Pb2+成键形成配位化合物。
同时,气质联用仪(GC—MS)分析表明,铁基生物絮凝剂的挥发性代谢产物组分较多,检出的化合物含有较多的酯类、酰胺类以及烷烃类化合物及少量的生物碱类、苯类[15]。在去除F−、Pb2+过程中,铁基生物絮凝剂含有的部分微生物体和微生物代谢产物可起到凝聚结晶核作用,其自身粘性又可增强絮凝效果,从而有助于F−、Pb2+的去除。
3 结论
1) 铁基生物絮凝剂处理含氟废水时,F−去除率随铁基生物絮凝剂投加量的增加而上升,随pH的升高而下降,随反应时间的增加而先升高后降低。铁基生物絮凝剂投加量为4%,pH值为5,反应时间为30 min,水中残余F−浓度为7.24 mg/L,低于国家《铅、锌工业污染物排放标准》(GB25466—2010)规定的限值。
2) 铁基生物絮凝剂处理含铅废水时,Pb2+去除率随铁基生物絮凝剂投加量的增加而上升,随pH的升高而升高,且加入铁基生物絮凝剂与不加相比,Pb2+去除率大大提高,随反应时间的增加而先升高后降低。铁基生物絮凝剂投加量为2%,pH值为8,反应时间为20 min,水中残余Pb2+浓度为0.407 mg/L,低于国家《铅、锌工业污染物排放标准》(GB25466—2010)规定的限值。
3) 铁基生物絮凝剂处理含F−、Pb2+废水时最佳条件:铁基生物絮凝剂投加量为7.5%,pH值为6,反应时间为20 min,废水中残余F−、Pb2+浓度可以同时达到国家《铅、锌工业污染物排放标准》(GB25466—2010)规定的要求。
4) 铁基生物絮凝剂本身絮体及含氟絮体的红外光谱图表明pH为4~6的范围内,铁基生物絮凝剂除氟机理是铁氟络合作用和吸附共沉淀作用;在pH为7~11的范围内,铁基生物絮凝剂除氟机理主要是吸附共沉淀作用。结合实验数据,pH为4~6时有较高的氟去除率,因此,铁氟络合作用是提高氟去除率的关键。此外,铁基生物絮凝剂可以与Pb2+形成配位化合物,同时,其含有的部分微生物体和微生物代谢产物可起到凝聚结晶核作用,自身的粘性又可增强絮凝效果,从而提高F−、Pb2+的去除率。
REFERENCES
[1] CAPELO S, VILHENA M F, SIMÕES G M L S, SAMPAYO M A. Effect of lead on the uptake of nutrients by unicellular algae[J]. Water Research, 1993, 27(10): 1563−1568.
[2] 刘庆斌. 无机含氟废水处理的研究进展[J]. 黄石理工学院学报, 2009, 5(4): 7−10.LIU Qing-bin. Research progress of inorganic fluoride wastewater treatment[J]. Journal of Huangshi Institute of Technology, 2009, 5(4): 7−10.
[3] TOYODA A, TAIRA T. A new method for treating fluorine waste water to reduce sludge and running costs[J]. IEEE transaction on semiconductor manufacturing 2000, 13(3):305−309.
[4] SAHA S. Treatment of aqueous effluent for fluoride removal[J].Water Research, 1993, 27(8): 1347−1350.
[5] PARTHASARATHY N, BUFFLE J, HAERDI W. Combined use of calcium salts and polymeric aluminium hydroxide for defluoridation of wastewaters[J]. Water Research, 1986,20(4): 443−448.
[6] 沈 黎, 孙 勇, 熊大民. 含铅废水处理技术研究进展[J]. 南方金属, 2010, 1: 9−12.SHEN Li, SUN Yong, XIONG Da-min. Advances in treatment technique for Pb-containing wastewater[J]. Southern Metals,2010, 1: 9−12.
[7] 许先国. 含铅废水絮凝处理的试验研究[J]. 能源环境保护,2008, 2(2): 19−21.XU Xian-guo. Experimental coagulation for lead wastewater[J].Energy Environmental Protection, 2008, 22(2): 19−21.
[8] WIDNER R C, SOUSA M F B, BERTAZZOLI R. Electrolytic removal of lead using a flow-through cell with a reticulated vitreous carbon cathode[J]. Journal of Applied Eletrochemistry,1997, 28(2): 201−207.
[9] 房秀福, 李浩然, 王玉兰. 水处理中絮凝剂的研究进展[J]. 黑龙江水利科技, 2005, 33(3): 36−37.FANG Xiu-fu, LI Hao-ran, WANG Yu-lan. Research progress of flocculants for wastewater treatment[J]. Heilongjiang Science and Technology of Water Conservancy, 2005, 33(3): 36−37.
[10] 崔佳丽, 王增长. 含氟废水处理试验研究[J]. 太原理工大学学报, 2006, 37(6): 634−636.CUI Jia-li, WANG Zeng-zhang. Treatment study of fluoric wastewater in an aluminum magnesium alloy plant[J]. Journal of Taiyuan University of Technology, 2006, 37(6): 634−636.
[11] 程秀绵. 含氟废水处理工艺的技术改进[J]. 工业水处理, 2007,27(6): 84−86.CHENG Xiu-mian. Technical reform in the fluorine-containing wastewater treatment[J]. Industrial Water Treatment, 2007, 27(6):84−86.
[12] YU Xia, CHAI Li-yuan, MIN Xiao-bo. Removal of lead in wastewater by immobilized inactivated cells of Rhizopus oligosporus[J]. Journal of Central South University of Technology, 2003, 10(4): 313−317.
[13] 李青竹, 王庆伟, 柴立元, 杨志辉, 王云燕. 基于吸附处理废水中 Pb2+的麦糟改性研究[J].环境科学学报, 2008, 28(6):1101−1106.LI Qing-zhu, WANG Qing-wei, CHAI Li-yuan, YANG Zhi-hui,WANG Yun-yan. Modification of spent grains to improve Pb2+adsorption from wastewater[J]. Acta Scientiae Circumstantiae,2008, 28(6): 1101−1106.
[14] MA Qi-ying, TRAINA S J, LOGAN T J, RYAN J A. In situ lead immobilization by apatite[J]. Environmental Science and Technology, 1993, 27(9): 1803−1810.
[15] 王慧敏. 铁基生物絮凝剂的制备与应用研究[D]. 长沙: 中南大学, 2011: 48−50.WANG Hui-min. Preparation and application of iron-bioflocculant[D]. Changsha: Central South University, 2011:48−50.
[16] GB-T7484—1987. 水质 氟化物的测定 离子选择电极法[S].GB-T7484—1987. Water quality-determination of fluoride-ion selective electrode method[S].
[17] 《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002.Editorial Board of Monitoring and Analysis Method of Water and Waste Water. Monitoring and analysis method of water and waste water[M]. 4th ed. Beijing: China Environmental Science Press, 2002.
[18] WANG Yun-yan, CHAI Li-yuan, CHANG Hao, PENG Xiao-yu,SHU Yu-de. Equilibrium of hydroxyl complex ions in pb2+-H2O system[J]. Transactions of Nonferrous Metals Society of China,2009, 19(2): 458−462.
[19] 陈绪钰. 聚合硫酸铁去除水中氟的试验研究[J]. 中国农村水利水电, 2009, 11: 95−97.CHEN Xu-yu. An experimental research on fluoride removal from high fluoride-bearing water by polyferric sulfate[J]. China Rural Water and Hydropower, 2009, 11: 95−97.
[20] 兴 虹. 钙盐沉淀法处理含氟废水的研究[J]. 本溪冶金高等专科学校学报, 2003, 5(2): 1−3.XING Hong. Research into fluoric waste treatment with sedimentation of calcium salts[J]. Journal of Benxi College of Metallurgy, 2003, 5(2): 1−3.
[21] 卢建杭, 刘维屏, 郑 巍. 铝盐混凝去除氟离子的作用机理探讨[J]. 环境科学学报, 2000, 20(6): 709−713.LU Jian-hang, LIU Wei-ping, ZHENG Wei. The removal mechanisms of fluoride ion by aluminum salt coagulant[J]. Acta Scientiae Circumstantiae, 2000, 20(6): 709−713.
(编辑 龙怀中)
Removal of fluoride and lead in wastewater with iron-bioflocculant
MIAO Yu1,2, MIN Xiao-bo1,2, CHAI Li-yuan1,2, YIN Yi-nan1,2
(1. School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China;2. Chinese National Engineering Research Center to Control and Treatment of Heavy Metal Pollution,Central South University, Changsha 410083, China)
X703.1
A
1004-0609(2012)08-2366-08
国家水体污染控制与治理科技重大专项(2009ZX07212-001-01);国家杰出青年科学基金资助项目(50925417);国家高技术研究发展计划重点项目(2010AA065203);新世纪人才计划资助项目(NCET -10-0840)
2011-07-19;
2011-12-12
闵小波,教授,博士;电话:0731-88830875;E-mail: mxb@csu.edu.cn
