亚硝酸钠对大鼠心肺复苏脑保护的影响
2012-09-28谢!王弋陈寿权许国根
谢! 王弋 陈寿权 许国根


心肺复苏患者心跳骤停后脑组织经历了严重的全脑缺血-再灌注损伤,既往流行病学资料表明,即使患者恢复自主循环,仍有高达55%~71%的院内病死率[1]。亚硝酸盐既往被认为是一氧化氮的代谢产物,但目前研究发现,在组织缺氧时亚硝酸盐可作为底物被还原为一氧化氮,从而起到保护脑组织缺氧的作用。本试验采用窒息型大鼠心肺复苏模型,用亚硝酸钠进行干预,观察大鼠心肺复苏后大脑皮层枕叶一氧化氮的含量以及细胞凋亡的发生,用以进一步探讨亚硝酸钠在心肺复苏后脑保护中的作用。
1 材料与方法
1.1 实验动物及分组
实验共使用清洁级健康成年雄性SD大鼠45只(由上海斯莱克实验动物有限责任公司提供),日龄70~90 d,体质量300~400 g,(357.5±20.8 )g。随机(随机数字法)分为手术对照组、复苏组、亚硝酸钠组,每组各15只。术前禁食12 h,自由饮水。
1.2 仪器与试剂
南京美易科技有限公Med-lab-U/4CS生物信号采集处理系统;成都泰盟科技有限公司HX-300动物呼吸机;德国Hettich公司低温高速离心机(univerval-32R);上海棱光技术有限公司722S分光光度计;上海贺德实验设备厂DK-600电热恒温水浴箱;南京建成生物科技有限公司亚硝酸盐还原酶试剂盒;德国罗氏原位细胞凋亡检测试剂盒;广州白云山明兴制药有限公司亚硝酸钠注射液。
1.3 动物模型制作
采用窒息法建立大鼠心肺复苏模型[2]。实验参数设计和记录均参照复苏实验研究Utstein模式。大鼠以5%水合氯醛0.35 g/kg腹腔注射麻醉后固定于大鼠手术台,将皮下针接心电导联予以心电监护,经口气管插管接动物呼吸机供气(空气),分离右侧腹股沟,暴露股动脉、股静脉后予以分别置管用于监测血压及给药。呼吸机供气10 min待其基线达到平稳状态,大鼠于呼气末夹闭气管插管,窒息7 min后开始CPR,当出现自主心律、脉搏波,MAP>60 mm Hg(1 mm Hg=0.133 kPa)并持续10 min以上判断为自主循环恢复(ROSC)。亚硝酸钠组大鼠在复苏前经股静脉推注亚硝酸钠针0.13 mg/kg[3](亚硝酸钠溶液质量浓度为30 μg/ml,取药后不足1 ml用生理盐水稀释至1 ml静注)和肾上腺素20 μg/kg(肾上腺素溶液质量浓度为10 μg/ml,取药后不足1 ml用生理盐水稀释至1 ml静注)。复苏组肾上腺素稀释至2 ml推注。对照组动物仅进行麻醉和气管插管、血管穿刺,推注2 ml生理盐水,不进行夹管窒息及CPR。大鼠于ROSC后3 h开始逐步脱机,并于角膜反射和疼痛反射均出现后拔除右侧股动脉、静脉插管,结扎血管,缝合右股动脉处创口,撤离气管插管,放入鼠笼内,自由饮食饮水,室温控制在23~26℃。各组于ROSC后24 h快速断头处死,在冰盘上完整取出大脑。
1.4 大脑皮层组织匀浆NO含量测定
采用亚硝酸盐还原酶法。亚硝酸盐还原酶试剂盒购自南京建成生物科技有限公司。大鼠在ROSC后24 h用5%水合氯醛(7 ml/kg)麻醉,剪开右心房,用100 ml生理盐水经颈动脉注入灌洗。断头取出大鼠大脑,完整分离出左侧大脑皮层,取枕叶约100 mg剪碎放入玻璃匀浆器内,加1 ml 4 ℃生理盐水,制成匀浆,离心(4 ℃,3000 r/ min)取上清液,放入-20 ℃冰箱保存待测。检测的操作过程均按说明书要求进行。
1.5 大脑皮层细胞凋亡检测
采用原位细胞凋亡检测试剂盒,试剂盒购自罗氏公司。将右侧枕叶皮层组织置于10%福尔马林中固定24 h后,常规石蜡包埋切片,片厚4 μm,免疫组织化学染色。按照说明书要求,部分切片以试剂2代替TUNEL反应混合物做阴性对照。具体操作步骤按说明书要求进行。
1.6 统计学方法
采用SPSS 13.0软件包处理数据,计量资料以均数±标准差(x±s )表示。多组比较采用方差分析。方差齐性检验采用levene s法,方差齐性时采用LSD-t法,方差不齐时采用Tamhane s检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组参数比较
各组存活24h大鼠体质量(P=0.391),基线平均动脉压(P=0.671)差异均无统计学意义。
2.2 大鼠大脑皮层枕叶匀浆NO含量
与假手术对照组比较,复苏组和亚硝酸钠组大鼠脑组织NO含量显著升高;与复苏组比较,亚硝酸钠组大鼠脑组织NO含量显著升高;与复苏组比较,亚硝酸钠组大鼠复苏后24 h存活率显著升高。见表2。
2.3 大鼠大脑皮层枕叶细胞凋亡表达
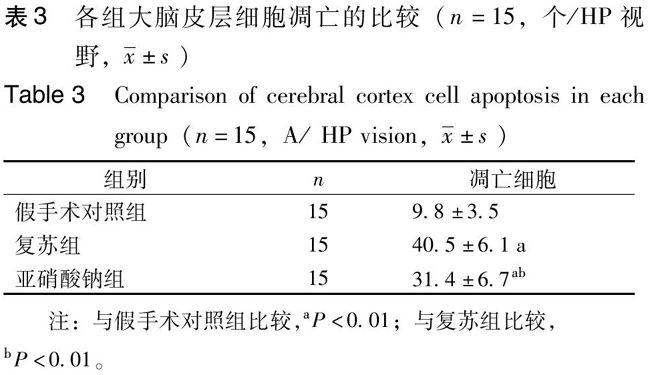
与假手术对照组比较,复苏组和亚硝酸钠组大鼠皮层凋亡细胞高度表达,与复苏组比较,亚硝酸钠组皮层凋亡细胞表达明显降低,差异具有统计学意义。见表3,图1。
3 讨论
2010年心肺复苏指南心跳骤停复苏后高级生命支持的新进展仍乏善可陈,对脑保护仅提及亚低温疗法。心跳骤停后心肺复苏患者脑组织主要病理生理改变为缺血再灌注损伤,因此积极防治脑缺血再灌注损伤是改善患者预后的重要因素。
A:假手术对照组;B复苏组;C:亚硝酸钠组。TUNEL阳性表达显示为深棕色胞核
一氧化氮是在活体组织内由L-精氨酸与氧反应,生成胍氨酸时其胍基被羟化而成的一种血管活性物质。近10余年的研究已证实,在心、脑、肝、肾等脏器发生缺血再灌注损伤后,一氧化氮可在缺氧部位起到血管舒张[4],调节蛋白表达[5],血管再生[6]以及调节线粒体呼吸[7]的作用。一氧化氮可通过降低血管平滑肌细胞内Ca2+浓度,阻止血小板聚集以及中性粒细胞粘附起到舒张血管,防止中性粒细胞趋化导致呼吸爆发产生大量氧自由基的作用[8]。一氧化氮还可以通过促分裂原活化蛋白激酶途径激活钾通道,起到脑保护作用[9]。一氧化氮通过在缺血再灌注阶段抑制线粒体呼吸链,减少活性氧簇生成,减少钙超载和细胞色素C的释放,可减轻细胞凋亡的发生[10-13]。蒋雷等[14]在脑细胞体外培养缺血再灌注实验中也证实一氧化氮能减轻细胞死亡与凋亡。
亞硝酸盐既往只被认为是一氧化氮的代谢产物,无活性。但近年来的研究发现,在发生缺氧,酸中毒时它可以转化为一氧化氮[15],起到保护作用。在铜蓝蛋白基因敲除小鼠[16]和缺乏亚硝酸盐喂养动物实验[17]中发现会增加肝和心脏的缺血-再灌注损伤范围。在大鼠的脑卒中模型中也证实亚硝酸盐能减轻脑损伤,防止神经功能受损[18]。Dezfulian[3]等在小鼠心肺复苏模型中也发现亚硝酸盐能改善自主循环恢复后心脏和神经系统功能。
本研究发现,大鼠心肺复苏后大脑皮层组织一氧化氮含量复苏组和亚硝酸盐组均较假手术对照组显著升高,亚硝酸盐组较复苏组一氧化氮含量显著升高;大鼠心肺复苏后大脑皮层细胞凋亡的发生亚硝酸盐组较复苏组显著降低。说明经亚硝酸盐干预,可增加心跳骤停后脑组织内一氧化氮的产生,从而起到脑保护作用。
参考文献
[1]Nadkarni VM, Larkin GL, Peberdy MA, et al. First documented rhythm and clinical outcome from in-hospital cardiac arrest among children and adults[J]. JAMA, 2006,295(1):50 -57.
[2] 陈寿权,李章平,王姗姗,等.窒息法致大鼠心脏停搏模型复苏的影响因素[J].中华急诊医学杂志,2005 ,14(10):814-817.
[3] Dezfulian C, Shiva S, Alekseyenko A, et al. Nitrite therapy after cardiac arrest reduces reactive oxygen species generation, improves cardiac and neurological function, and enhances survival via reversible inhibition of mitochondrial complex I[J]. Circulation,2009 ,120 (10):897-905.
[4] Cosby K, Partovi KS, Crawford JH, et al. Nitrite reduction to nitric oxide by deoxyhemoglobin vasodilates the human circulation[J]. Nat Med, 2003 ,9(12):1498-1505.
[5] Bryan NS, Fernandez BO, Bauer SM, et al. Nitrite is a signaling molecule and regulator of gene expression in mammalian tissues[J]. Nat Chem Biol, 2005,1(5):290-297.
[6] Kumar D, Branch BG, Pattillo CB, et al. Chronic sodium nitrite therapy augments ischemia-induced angiogenesis and arteriogenesis[J]. Proc Natl Acad Sci U S A,2008,105(21):7540-7545.
[7] Shiva S, Huang Z, Grubina R, et al. Deoxymyoglobin is a nitrite reductase that generates nitric oxide and regulates mitochondrial respiration[J].Circ Res,2007,100(5):654-661.
[8] Ruiz-Stewart I, Tiyyagura SR, Lin JE,et al. Guanylyl cyclase is an ATP sensor coupling nitric oxide signaling to cell metabolism[J].Proc Natl Acad Sci USA,2004,101(1):37-42.
[9] Lin YF, Raab-Graham K, Jan YN, et al. NO stimulation of ATP-sensitive potassium channals: Involvement of Ras/mitogen-activated protein kinase pathway and contribution to neuroprotection [J].Proc Natl Acad Sci USA,2004,101(20):7799-7804.
[10]Honda HM, Korge P, Weiss JN. Mitochondria and ischemia/reperfusion injury[J]. Ann N Y Acad Sci,2005,1047:248-258.
[11] Rouslin W. Mitochondrial complexes Ⅰ,Ⅱ,Ⅲ,Ⅳ, and Ⅴ in myocardial ischemia and autolysis[J]. Am J Physiol,1983,244(6):H743-748.
[12] Sack MN. Mitochondrial depolarization and the role of uncoupling proteins in ischemia tolerance[J]. Cardiovasc Res,2006,72(2):210-219.
[13] 高好考,王海昌,张荣庆,等.一氧化氮对缺氧/复氧乳鼠心肌细胞内游离钙的影响[J].中华急诊医学杂志,2005,14(12):1007-1009.
[14] 蒋雷,王军,何斌,等.PC12细胞缺血预处理模型的建立及一氧化氮的保护作用[J].中华急诊医学杂志,2009,18(5):475-478.
[15] Lundberg JO, Weitzberg E, Gladwin MT. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics[J]. Nat Rev Drug Discov,2008,7(2): 156-167.
[16] Shiva S, Wang X, Ringwood LA, et al. Ceruloplasmin is a NO oxidase and nitrite synthase that determines endocrine NO homeostasis[J]. Nat Chem Biol, 2006,2(9):486-493.
[17] Bryan NS, Calvert JW, Elrod JW, et al. Dietary Nitrite supplementation protects against myocardial ischemia-reperfusion injury[J]. Proc Natl Acad Sci USA, 2007,104(48):19144 -19149.
[18] Jung KH, Chu K, Ko SY, et al. Early intravenous infusion of sodium nitrite protects brain against in vivo ischemia-reperfusion injury[J]. Stroke,2006,37(11):2744-2750.
(收稿日期:2012-01-04)
(本文编辑:沈惠云)
DOI:10.3760/cma.j.issn.1671-0282.2012.08.013
作者单位:310006 杭州,杭州市第一人民医院急诊科(谢赟、王弋、许国根);温州医学院附属第二医院急诊科(陈寿权)
通信作者:许国根,Email:xugg1899@sina.com
中华急诊医学杂志2012年8月第21卷第8期Chin J Emerg Med,August 2012,Vol.21,No.8
P855-857
