孔雀石绿脱色菌的分离鉴定及降解特性研究
2012-09-28曾庆龙周元祥叶红曼
曾庆龙, 周元祥, 刘 秀, 叶红曼
(合肥工业大学 资源与环境工程学院,安徽 合肥 230009)
随着染料工业的迅速发展,染料品种和数量日益增加,它们不仅具有特定的颜色,而且结构复杂,生物可降解性较低,大多具有潜毒性特征[1]。在染料家族中,三苯甲烷染料是仅次于偶氮染料的一个大类,被广泛地应用于纺织印染、医药、造纸和制革等工业[2]。孔雀石绿是一种有毒的三苯甲烷类人工合成有机化合物,既可用作生物染色剂及丝绸、皮革和纸张等的染料,也可用来治理鱼类或鱼卵的寄生虫、真菌或细菌感染等,但是孔雀石绿具有高毒素、高残留和致癌、致畸、致突变等副作用[3-4],已被列为水产养殖禁用药物。因此,寻找对这类染料的特定降解菌成为人们争相关注的焦点问题[5-9]。本文研究实验室分离鉴定的3种菌株对孔雀石绿的降解特性,以进一步丰富孔雀石绿染料废水脱色处理的微生物资源,为孔雀石绿染料废水生物脱色问题提供理论资料。
1 材料与方法
1.1 菌种来源及染料
(1)菌种:从实验室ABR反应器中的活性污泥混合液中分离。
(2)染料:孔雀石绿,分析纯,λmax=616nm。
1.2 培养基
(1)LB培养基:蛋白胨10g,NaCl 5g,酵母膏5g,蒸馏水1L,pH 7.0~7.2。
(2)选择培养基:C6H12O61.5g,(NH4)2SO40.5g,NaCl 1g,KH2PO42.65g,Na2HPO4·12H2O 4.26g,MgSO4·7H2O 0.2g,FeSO4·7H2O 0.01g,CaCl20.02g,MnSO4·7H2O 0.002g,孔雀石绿60mg,蒸馏水1L,pH 7.0~7.2。
1.3 菌株分离与鉴定
将ABR反应器中采集的活性污泥混合液,在固体基础培养基平板上进行稀释涂布,再反复进行划线分离,获得纯菌株,将纯化后的菌株接入液体培养基中(染料质量浓度60mg/L,每支试管装10mL脱色培养基,每株菌株接3管做3次平行试验),30℃培养一定时间,筛选出能对孔雀石绿脱色的菌株。根据细菌分类鉴定标准[10],从菌株个体形态特征、菌落特征等方面进行初步鉴定。菌株通过16SrDNA基因序列比对,对分离菌株进行系统分类鉴定。
1.4 脱色效果测定
从脱色培养液中取出5mL样液,以6000r/min的转速离心15min,缓缓倾倒出上清液,以未加染料的液体培养基为参比,测量上清液在染料最大吸收波长(λ=616nm)处吸光度值,计算染料去除率[11]。
染料去除率=(A0-Ae)/A0×100%,其中,A0为未接种微生物的空白对照样品的染料溶液吸光度;Ae为离心去除菌体后的上清液中残留染料的吸光度。
2 结果与分析
2.1 脱色菌的分离鉴定
用富集培养基进行5代的驯化培养,然后在固体培养基上经过多次划线分离,得到对孔雀石绿染料有脱色能力的菌株。将菌株接种于LB培养基、30℃恒温培养24h活化,活化后细菌悬液调整至吸光度A600=0.6±0.05,取5mL菌液,将其加入50mL含60mg/L孔雀石绿染料的无机盐培养基中,30℃的恒温培养箱里静置培养,测定其脱色能力。
不同菌株对孔雀石绿染料的脱色率如图1所示,可以看出菌株 MG-2、MG-6和 MG-7对孔雀石绿脱色非常明显,脱色率均在94%以上。
3株菌对孔雀石绿染料的脱色过程如图2所示。结果表明,经过64h脱色,3株菌对孔雀石绿脱色非常明显,脱色率在94%以上,而菌株MG-2和菌株MG-7在24h内对孔雀石绿的脱色率超过82%,36h的去除率超过94%。菌株MG-6在36h内对孔雀石绿的脱色效率也能达到80%,48h的去除率达到91.71%。
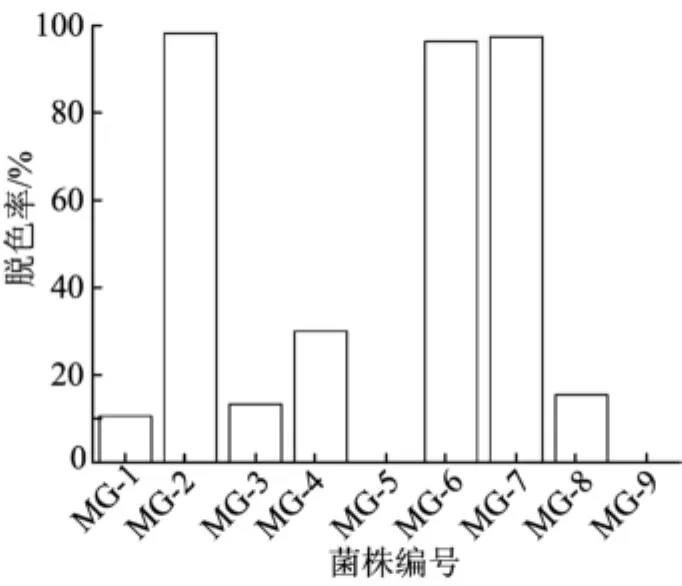
图1 不同菌株对孔雀石绿的脱色率
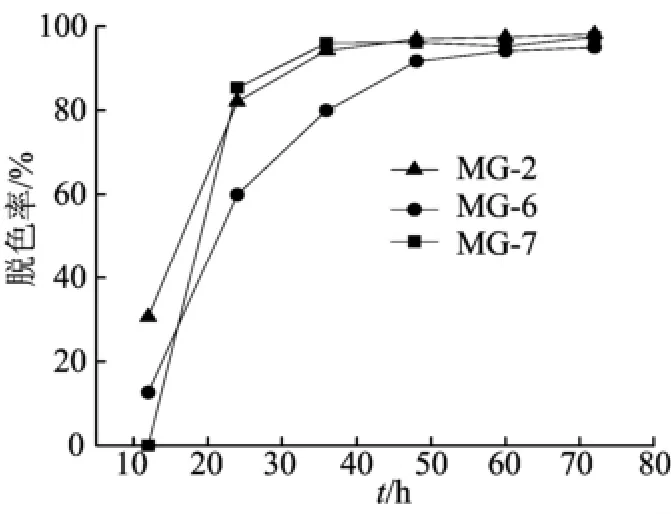
图2 单菌株对孔雀石绿染料的脱色过程
观察菌株 MG-2、MG-6和 MG-7在营养琼脂培养基上的菌落形态特征,其结果见表1所列。将各菌株进行PCR扩增,扩增产物送交测序公司进行基因测序,获得各菌株分别从8F和1492R两端的测序结果,使用DNAStar软件包中的SeqMan软件将两侧序列进行拼接,并舍去两端可信度不高的片段,将可信度较高的片段(约1300bp)提交至NCBI网站进行序列比对,根据比对结果确定这3株菌的菌属,结果见表2所列。

表1 菌株形态观察结果
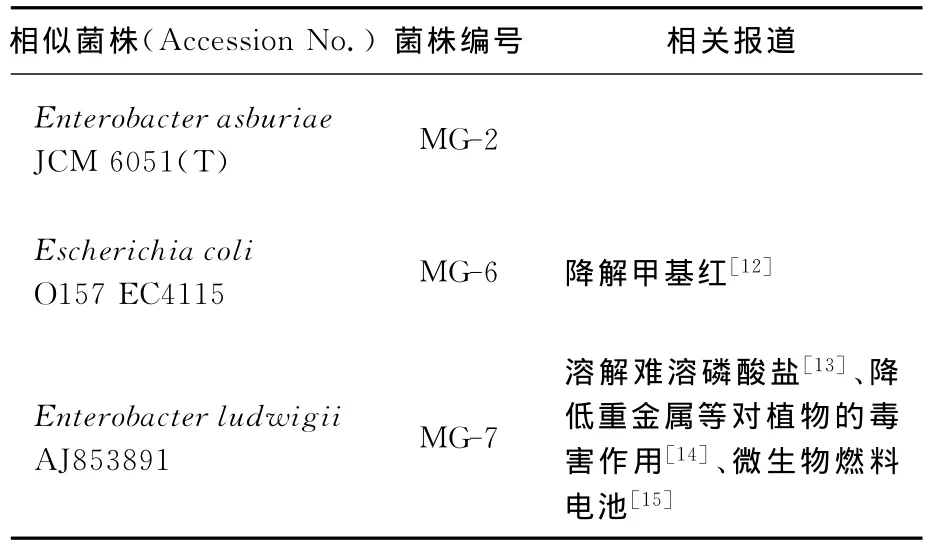
表2 16SrDNA基因测序结果(相似率均在98%以上)
2.2 菌株脱色性能研究
工业实际废水成分复杂,治理过程中存在许多限制因素,研究选用最显著的影响因子pH值、盐度、温度及氧气,观察染料孔雀石绿脱色率。
2.2.1 pH值对菌株脱色的影响
实验设计环境pH 值为5、6、7、8、9下,3株菌对60mg/L染料孔雀石绿的脱色效果。首先,配置无机盐培养基分装50mL三角瓶,灭菌后用5mol/L盐酸和2mol/L氢氧化钠溶液调节pH值分别为5、6、7、8、9。活化培养3株菌24h,以10%接种量接种于灭菌无机盐培养基中,30℃恒温培养,从12h起每6h取样测定离心后上清液在616nm处吸光度值,实验结果如图3所示。
由图3可知,3株单菌在中性条件下脱色效果最好,在偏碱性(pH>7)条件下具有较高的脱色率,在偏酸性(pH≤6)条件下脱色率较低。菌株MG-7对pH值的适应范围较广,但其脱色过程存在较为明显的停滞现象,0~24h的脱色效果均不明显,24h后脱色效果明显上升。菌株MG-6和MG-2在处理孔雀石绿染料时停滞期相对较短,pH值在5~6时,基本无脱色效果;在pH=7时,24h染料的脱色率达到95%;pH值在8~9时,菌株MG-2初始脱色率较高,但48h后,菌株 MG-6的脱色率高于菌株 MG-2,pH=8时菌株MG-6的脱色率达到89.5%。
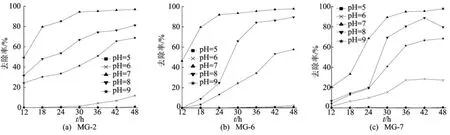
图3 pH值对脱色率的影响
2.2.2 温度对菌株脱色的影响
不同的环境温度影响菌体酶的活性而影响菌株对染料的脱色效果。本研究考察菌株在10、20、30、37、45、55℃条件下对60mg/L染料孔雀石绿的脱色效果的影响。活化培养3株菌24h,以10%接种量接种于含60mg/L孔雀石绿的灭菌无机盐培养基中,分别置于实验所需温度的恒温培养箱静置培养,从12h起每6h取样测定离心后上清液在616nm处吸光度值,实验结果如图4所示。
从图4可以看出,温度对菌株对染料孔雀石绿的脱色有明显的影响,在低温条件下(θ≤10℃)3,株菌对孔雀石绿均无明显脱色作用,随着温度升高,3株菌对孔雀石绿的脱色率先增大后减小,3株菌的最适脱色温度均为30℃。菌株MG-2和菌株 MG-6对温度的适应能力较好,在20~37℃范围内都有较高的脱色效率,菌株MG-2的脱色要快于菌株MG-6;菌株MG-7对温度的适应能力相对较差,只在温度为30℃时具有较高的脱色效率,在温度较低或较高时脱色效率都较差,其脱色过程中存在一个明显的停滞期(0~24h),24h后细菌将染料迅速降解。
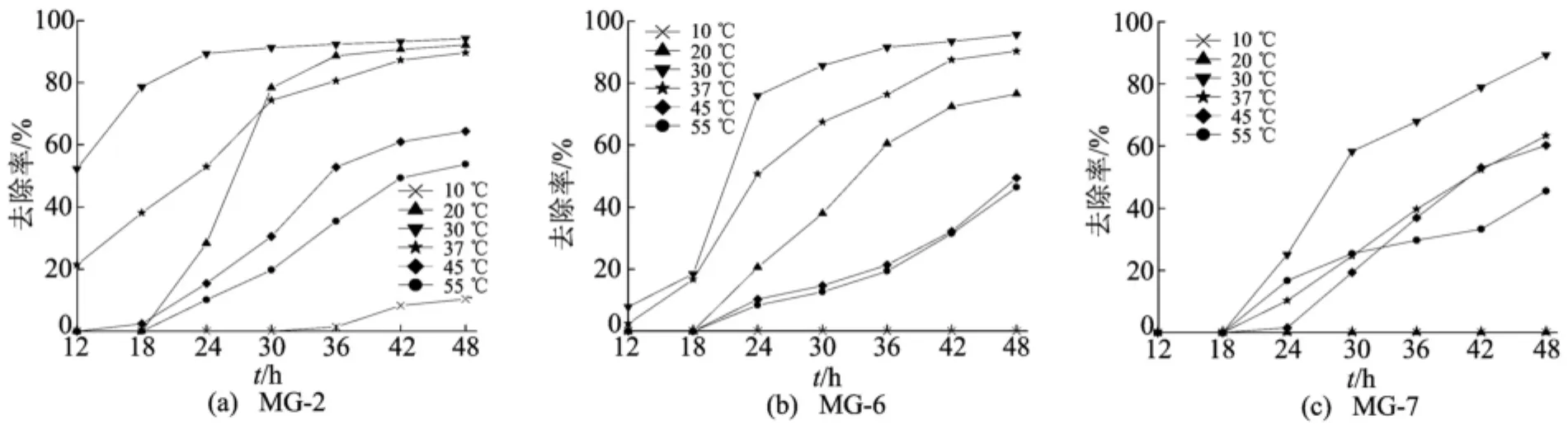
图4 温度对脱色率的影响
2.2.3 氧气条件对菌株脱色的影响
本研究考察菌株在好氧、厌氧及兼氧条件下对60mg/L染料孔雀石绿的脱色效果的影响。活化培养3株菌24h,以10%接种量接种于灭菌无机盐培养基中,提供不同氧气条件,于30℃恒温静置培养48h,从12h起每6h取样测定离心后上清液在616nm处吸光度值,结果如图5所示。

图5 氧气对脱色率的影响
从图5可见,3株菌在好氧条件下对孔雀石绿的脱色率均较低,在厌氧和兼氧条件下的脱色率明显高于好氧条件。菌株MG-6在3种氧气条件下都有较高的脱色率,在厌氧和兼氧条件下的脱色过程相似,脱色效率超过95%,在好氧条件的脱色率也超过70%;菌株MG-2在厌氧和兼氧条件的脱色过程基本相同,脱色效率都超过96%,而在好氧条件下脱色率只有51%;菌株MG-7最适宜在兼氧条件下对孔雀石绿进行脱色降解,在厌氧条件下的脱色效果明显下降,在好氧条件下基本无脱色。同时,还可以发现菌株对染料的脱色速率存在差异:菌株 MG-2>菌株MG-6>菌株 MG-7。菌株 MG-2经活化后能立即对孔雀石绿进行降解脱色,而菌株MG-7经活化后接种到染料废水中,需要24h的停滞期才开始对染料进行降解脱色,菌株MG-6的停滞期介于两者之间。
2.2.4 盐度对菌株脱色的影响
盐度对微生物的生长繁殖和污染物的降解有着重要影响,耐盐菌具有特殊结构及理化性质,在高盐污染料废水的处理方面发挥着重要作用。以NaCl作为盐度表征,考察NaCl质量浓度为5、10、20、30、40、50g/L的条件下,对60mg/L孔雀石绿染料的脱色效果。活化培养3株菌24h,以10%接种量接种于灭菌无机盐培养基中,30℃恒温静置培养48h,从12h起每6h取样测定离心后上清液在616nm处吸光度值,实验结果如图6所示。
从图6中可以看出,菌株MG-7具有较好的耐盐性,菌株 MG-2和菌株 MG-6对盐度的适应性比菌株 MG-7差,随着ρ(NaCL)的增加,菌株对染料的脱色率出现一定程度的下降。ρ(NaCL)在10g/L以下时,盐度对菌株MG-2的脱色效果基本无影响,12h的脱色率已达到53.6%,18h后基本保持在90%以上的脱色率;ρ(NaCL)在30g/L以下时,盐度对菌株 MG-2脱色有一定程度的影响,起始脱色率降低,经过48h的处理最终脱色率趋于平稳,为82.4%;ρ(NaCL)在40~50g/L时,盐度对菌株MG-2脱色有明显的抑制作用,初始基本无脱色作用,随着时间的延长,最高脱色率为56.4%。ρ(NaCL)在10g/L以下时,菌株MG-6对染料的脱色延迟于菌株MG-2,30h后对孔雀石绿的脱色率也在90%以上;ρ(NaCL)在30g/L以下时,盐度对菌株 MG-6脱色的影响基本上与菌株 MG-2类似;ρ(NaCL)为40g/L时,虽然脱色比较缓慢,但保持上升态势;ρ(NaCL)为50g/L时,菌株 MG-6对孔雀石绿的脱色有较明显的抑制作用,起始脱色速率较快,但24h后脱色率稳定在50%左右。ρ(NaCL)为5~50g/L时,盐度对菌株MG-7的脱色没有明显影响,初始脱色率有一定差异,但30h后脱色率都保持在90%以上。上述结果说明3株菌都有一定的耐盐能力,其中菌株MG-7对盐度的适应性最强。根据文献[16]对耐盐菌的划分,3株菌都属于耐盐菌类型,这对实际污染废水处理有重要意义。
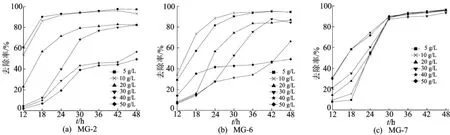
图6 盐度对脱色率的影响
2.3 脱色降解酶初步分析
将3株菌接种于无机盐培养基中培养,待48h完全脱色后,进行3组实验。第1组实验为取20mL含孔雀石绿无机盐培养基直接加入此培养液20mL;第2组实验为将此培养液离心,取上清液20mL,加入等体积含孔雀石绿无机盐培养基;第3组实验为将离心后沉淀的菌体用不含孔雀石绿的pH=7磷酸缓冲液洗3次,再加入20 mL含孔雀石绿无机盐培养基以及20mL不含孔雀石绿无机盐培养基。3组实验均在30℃条件下,重复3次,其脱色率见表3所列。
实验结果表明:在第1组和第2组实验中,菌株对于孔雀石绿染料的脱色绿均超过90%,第3组实验菌株对染料无脱色。这说明孔雀石绿降解酶主要存在于培养液中,属于胞外酶。
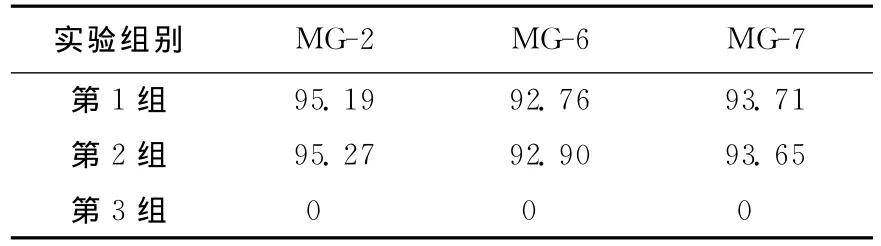
表3 菌体或上清液对脱色率的影响 %
3 结 论
(1)通过驯化培养和多次划线分离,得到对孔雀石绿染料有高效脱色能力的菌株,16SrDNA基因序列比对结果表明3株高效脱色菌分属En-terobacter asburiae(MG-2)、Escherichia coli(MG-6)和Enterobacter ludwigii(MG-7)。3株菌都能有效降解孔雀石绿染料,48h对60mg/L孔雀石绿的脱色率达到97%。
(2)3株菌对孔雀石绿的最适脱色条件为:pH=7.0,温度为30℃,兼性厌氧,且对盐度都有一定的耐适性,属于耐盐菌。
(3)在脱色过程中,菌株 MG-2基本不出现停滞期,菌株 MG-7存在24h的停滞期,菌株MG-6的停滞期时间介于两者之间。
(4)通过对孔雀石绿染料降解过程的研究,发现孔雀石绿降解酶主要存在于培养液中,属于胞外酶。
[1]徐成勇,郭 波,周 莲,等.白腐菌对染料脱色和降解作用的研究进展[J].生物工程进展,2002,22(01):57-60.
[2]李慧蓉,陈 武,陈和谦.黄孢原毛平革菌对三苯甲烷染料的生物脱色降解[J].上海环境科学,2003,22(11):738-742,749.
[3]仇国苏,张旭东,陈仕功.认识孔雀石绿[J].化学教育,2007(5):2,23.
[4]徐淑霞,冯航标,张世敏,等.黄孢原毛平革菌对孔雀石绿生物脱色条件的研究[J].河南农业大学学报,2009,43(4):437-440.
[5]成 文,曾宝强.孔雀绿染料的微生物脱色研究[J].应用与环境生物学报,2000,6(4):370-373.
[6]董新姣,谢荣敏.固定化青霉X5对孔雀石绿的脱色研究[J].环境污染治理技术与设备,2006,7(1):45-49.
[7]李 怡,何 珊,曹海鹏,等.孔雀石绿脱色菌恶臭假单胞菌菌株M6的分离、鉴定及其生长特性研究[J].微生物学通报,2009,36(1):57-63.
[8]任 倩,蒋丽娟,宋 炜,等.孔雀石绿降解菌M3的分离鉴定及降解特性研究[J].生态与农村环境学报,2007,23(3):65-69.
[9]林少芳,余 萍,林玉满.一株绿脓假单胞菌对碱性孔雀绿脱色的初步研究[J].福建师范大学学报:自然科学版,2004,20(4):72-75.
[10]Holt J G,Krineg N R,Sneath P H A.Bergey’s manual of determinative bacteriology[M].9th ed.Baltimore,Maryland:Williams &Wilkins,1994:385-452.
[11]周元祥,石倩倩,叶红曼.高效溴氨酸脱色菌的分离鉴定及其特性研究[J].合肥工业大学学报:自然科学版,2010,33(7):1057-1061.
[12]Nakanishi M,Yatome C,Ishida N.Putative ACP phosphodiesterase gene(acpD)encodes an azoreductase[J].The Journal of Biological Chemistry,2001,276(49):46394-46399.
[13]Tripura C,Reddy P S,Reddy M K,et al.Glucose dehydrogenase of a rhizobacterial strain of Enterobacter asburiae involved in mineral phosphate solubilization shares properties and sequence homology with other members of enterobacteriaceae [J].Indian Journal of Microbiology,2007,47(2):126-131.
[14]Kavita B,Shukla S,Kumar G N,et al.Amelioration of phytotoxic effects of Cd on mung bean seedlings by gluconic acid secreting rhizobacterium Enterobacter asburiae PSI3and implication of role of organic acid[J].World J Microbiol Biotechnol,2008,24(12):2965-2972.
[15]Park H,Sanchez D,Cho S K.Bacterial communities on electron-ream Pt-deposited electrodes in a mediator-less microbial fuel cell[J].Environmental Science & Technology,2008,42(16):6243-6249.
[16]Kushner D J.Life in high salt and solute concentrations:halophilic bacteria[M]//Microbial Life in Extreme Environments.London:Academic Press,Ltd,1978:317-368.
