培美曲塞二钠治疗非小细胞肺癌的研究
2012-09-27综述艾春红王顺金审校
万 琴 综述,艾春红,王顺金 审校
(南昌大学第二附属医院肿瘤科,南昌 330006)
肺癌是中国恶性肿瘤中最常见的肿瘤之一。约有80%的肺癌属于非小细胞肺癌(NSCLC),后者主要分为:腺癌、鳞癌、大细胞癌,其中腺癌约占35%~40%。NSCLC的治疗主张采取以手术为主的综合治疗,但大部分肺癌确诊时已失去手术的机会,化疗就显得很重要。大量随机临床试验表明,以铂类为基础的一线治疗提高了患者的生活质量,降低了疾病相关症状也延长了生存期[1],并成为晚期NSCLC的标准一线治疗。但一线治疗后患者无进展生存期(PFS)仅4~5个月,大部分NSCLC患者接受一线治疗后又需要二线治疗。即使按照NCCN指南的治疗模式给予患者4~6个疗程一线治疗加上标准的二线治疗,患者的中位生存期仅10个月左右[2]。有随机研究表明,以多西紫杉醇作为二线药物治疗以铂类为基础联合化疗失败的NSCLC患者,有效率极低,中位生存期短于6个月[3]。很长一段时间,肺癌的治疗进入了平台期。人们不断地寻找着能获得更长的PFS的一线治疗、二线治疗或者是维持治疗的方法。培美曲塞二钠(pemetrexed disodium,PMD)的出现,不仅延长了PFS,更是延长了总生存期(OS),为NSCLC的化疗开创了一个新纪元。
1 培美曲塞二钠的介绍
1.1 化学结构 PMD商品名:力比泰(Alimta),化学名为:L-谷氨酸,N-[4-[2-(2-氨基-4,7-二氢-4-氧代-1H-吡咯[2,3-d]嘧啶-5-基)乙基]苯甲酸]。分子式:C20H19N5Na2O6·7H20,相对分子质量:597.49。化学结构式如图1[4]:
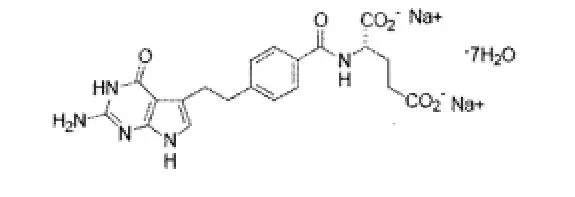
图1 PMD的化学结构式
1.2 PMD的作用机制 PMD属于抗代谢类药物,同时作用于胸腺嘧啶核苷酸合酶(TS)、甘氨酰胺核苷酸转甲基酶(GARFT)、二氢叶酸还原酶(DHFR)和5-氨基咪唑-4-氨甲基核糖核苷酸转甲基酶(AICARFT)[5]。它主要通过阻断以上四种叶酸酶,抑制嘌呤和嘧啶的合成,促进肿瘤细胞的凋亡而起到抗肿瘤的作用[6]。
1.3 PMD的适应证 PMD最早被使用于恶性胸膜间皮瘤的治疗中。2004年2月,美国食品药品管理局(FDA)批准PMD联合顺铂作为恶性胸膜间皮瘤的治疗。2004年8月19日,FDA批准PMD单药治疗曾接受过化疗的局部晚期或转移性NSCLC,主要用于以铂类为基础的一线化疗后的二线治疗[7]。2008年,PMD被FDA批准为NSCLC的一线治疗。2009年7月2日,FDA批准培美曲塞作为局部晚期或者转移性非鳞癌NSCLC接受四周期以铂类为基础的一线化疗后的维持治疗。
2 PMD在NSCLC中的一线治疗
随着PMD在NSCLC二线化疗中疗效的肯定,不断有Ⅱ期、Ⅲ期临床试验研究PMD单药或者与其他药联合用于NSCLC一线治疗的价值。Scagliotti等[8]进行了一项前瞻性、多中心、随机、对照、Ⅲ期临床试验,即JMDB研究。1 725例初次化疗的ⅢB或Ⅳ期NSCLC患者随机分成两组,对照组给予顺铂 75mg/m2,D1+吉西他滨1 250mg/m2,D1-8(n=863);实验组给予顺铂75mg/m2,D1+PMD500mg/m2,D1。每3周为一周期,共完成六周期。结果显示:试验组的总生存并不差于对照组(中位生存:都为10.3个月;危害比=0.94;95%可信区间为:0.84~1.05);试验组中腺癌和大细胞癌患者OS与对照组比有提高,试验组腺癌患者(n=847)OS为12.6个月,对照组为10.9个月;试验组大细胞癌患者(n=153)OS为10.4个月,对照组为6.7个月;对照组较试验组鳞癌患者OS高(n=473),分别为:10.8个月和9.4个月;与对照组相比,试验组3/4度中性粒细胞减少、贫血、血小板减少(P=0.001)、中性粒细胞减少性发热(P=0.002)和秃头(P<0.001)发生率都更低,但3/4度恶心实验组更多见。基于该研究,2009年NCCN提出:PMD联合顺铂一线治疗非鳞癌NSCLC患者的疗效优于吉西他滨联合顺铂,且毒性更低。
3 PMD在NSCLC中的二线治疗
PMD被FDA批准用于NSCLC二线治疗主要是基于一项大规模的随机、对照、Ⅲ期临床研究(JMEI)。Hanna等[9]将571例既往接受过不含PMD或多西紫杉醇的一线治疗失败后、ECOG评分0~2的晚期NSCLC患者随机分两组。分别接受PMD500mg/m2(静脉给药,D1)同时补充维生素B12、叶酸、地塞米松或者接受多西紫杉醇75mg/m2(静脉给药,D1)并补充地塞米松,21d为一周期。主要研究终点是总生存率。结果显示:PMD组和多西紫杉醇组的总有效率ORR分别为:9.1%、8.8%(P=0.105);中位生存时间分别为:8.3个月、7.9个月;中位无病进展时间皆为2.9个月;两组的1年生存率皆为29.7%。多西紫杉醇组出现更多的3/4级毒副反应:中性粒细胞减少(40.2%∶5.3% ,P<0.001)、中性粒细胞减少性发热(12.7%∶1.9% ,P<0.001)、中性粒细胞减少性感染(3.3%∶0.0%,P=0.004)。分析结果发现两组的总生存率、PFS、疾病进展时间都没有统计学差异,而PMD组的3/4级毒副反应少于多西紫杉醇组。在晚期NSCLC二线治疗中,PMD临床疗效与多西紫杉醇相似,但毒副反应明显降低,应当作为NSCLC二线标准治疗的选择。
4 PMD在NSCLC中的维持治疗
维持治疗成为近年来肿瘤学界关注度日益增高的治疗模式,是在一线治疗结束后,对无疾病进展的患者进行维持巩固治疗。JMEN研究2008年公布的PFS数据及在2009年ASCO年会上公布的OS数据显示:PMD在NSCLC维持治疗中显著延长了OS,取得历史性的突破。
JMEN是一项前瞻性、多中心、随机、对照、双盲、Ⅲ期临床实验[10]。本研究将663例ⅢB/Ⅳ期一线化疗后未进展的NSCLC患者随机分两组,分别接受最佳支持治疗加PMD维持治疗(500mg/m2,d1,q21d)或BSC加安慰剂治疗。PMD组441例、安慰剂组222例。首要终点为PFS,次要终点包括OS、ORR、疾病控制率和安全性指标。其中Ⅳ期患者占81%,非鳞癌约占73%,两组患者的一线治疗方案、人口学和临床特征均匹配平衡。结果显示:(1)总PFS,PMD组达4.0个月,而安慰剂组仅2.0个月,PMD使疾病进展风险显著减低40%(PFS风险比 HR=0.60,95%可信区间:0.49~0.73,P<0.000 01)。非鳞癌患者,PMD组和安慰剂组PFS分别为:4.4个月和1.8个月,HR=0.47(95%可信区间:0.37~0.60);鳞癌患者PFS分别为:2.4个月和2.5个月,HR=1.03(95%可信区间:0.71~1.49)。(2)OS,PMD组长达13.4个月,安慰剂组10.6个月,死亡风险显著下降21%(OS风险比HR=0.79,95%可信区间:0.65~0.95,P=0.012)。非鳞癌患者PMD组和安慰剂组OS分别为:15.5个月和10.3个月(HR=0.70,95%可信区间:0.56~0.88);鳞癌患者PMD组和安慰剂组OS分别为:9.9和10.8(HR=1.07,95%可信区间:0.77~1.50)。JMEN研究也显示了PMD维持治疗NSCLC患者的安全性较高,接近一半的患者接受了≥6周期的PMD,因不良反应发生减量或停药者仅为5%,所有3/4级不良反应发生率均小于5%,3/4级非血液学毒性反应发生率均低于3%。基于此,2009年7月2日,FDA批准PMD作为局部晚期或者转移性非鳞癌NSCLC患者接受四周期以铂类为基础的一线化疗后的维持治疗。
5 PMD与贝伐单抗的联合使用
Patel等[11]进行一项PMD、卡铂和贝伐单抗联用,序贯PMD和贝伐单抗维持治疗非鳞癌NSCLC的II期研究。50例患者接受PMD 500mg/m2、卡铂(药-时曲线下面积AUC=6)和贝伐单抗15mg/m2联合治疗,每3周为1周期,共6个周期。获得疾病缓解或稳定的患者给予PMD和贝伐单抗维持治疗,直到疾病进展或出现不可耐受的毒性反应。在可评价疗效的49例患者中,有效率为55%(95%可信区间:41%~69%),中位无进展生存期为7.8个月(95%可信区间:5.2~11.5个月),中位OS为14.1个月(95%可信区间:10.8~19.6个月)。3级和4级血液学毒性反应发生率较低,分别为:贫血(6%,0)、中性粒细胞减少(4%,0)及血小板减少(0,8%);3级和4级非血液学毒性反应为:蛋白尿(2%,0)、静脉血栓形成(4%,2%)、动脉血栓形成(2%,0)、乏力(8%,0)、感染(8%,2%)、肾毒性(2%,0)及憩室炎(6%,2%)。该方案用于晚期非鳞癌NSCLC患者安全有效,毒性反应可以接受,生存期相对较长。
Alex等[12]进行了一项Ⅱ期临床试验,将48例复治的NSCLC患者使用PMD联合贝伐单抗治疗。结果显示:有效率为10.4%、中位无进展生存4.1个月、中位生存期8.6个月;非血液学毒性反应3/4乏力(13%)、呼吸困难(10%)、血栓(10%);3/4级血液学毒性反应包括中性粒细胞减少(19%)、白细胞减少(17%)、淋巴细胞减少(13%)。
6 展 望
PMD和贝伐单抗的联合使用的研究很多[13-14],但大都为Ⅱ期试验,病例数较少,缺乏大样本Ⅲ期临床试验的支持,还需要更进一步的研究。有一些临床试验正在进行,期待着更新的研究结果给予更多的临床指导[15-16]。
PMD在NSCLC的治疗中具有显效性和普遍耐受,更低的毒副反应使其更容易被医生和患者接受。在NSCLC的二线治疗中,PMD的临床疗效与多西紫杉醇相似,但以其更低的毒副反应而受重视。在一线治疗,联合顺铂一线治疗非鳞癌NSCLC患者的疗效优于吉西他滨联合顺铂,且毒性更低。在维持治疗中,PMD更是显著延长了OS,取得了历史性突破。从近年来的一些研究中可以看出[17-18],肿瘤组织学类型对PMD的疗效具有重要影响,“按照组织学治疗”这样的新名词的出现,将指引基于组织学的思路进行个体化治疗。在PMD的研究中还有一些值得我们思考的问题,比如有研究发现PMD与其他药物联用时[19-20],给药时间顺序很重要,这也是必须慎重考虑的地方。再者,PMD用于维持治疗与二线治疗相比,应该做何选择,也是未来需要进一步研究的问题。
[1] Stinchcombe TE,Socinski MA.Considerations for secondline therapy of non-small cell lung cancer[J].Oncologist,2008,13(Suppl 1):28-36.
[2] 陈丽昆,张力.晚期NSCLC维持治疗如何选择药物,对生存期有什么影响[J].临床肿瘤学进展,2010,7(1):30-31.
[3] Postmus PE.Activity of pemetrexed(alimta),a new antifolate,against non-small-cell lung cancer[J].Lung cancer,2002,38(suppl 2):S3-S7.
[4] 曹国颖,徐巧玲,傅得兴.多靶点抗肿瘤药物-培美曲塞二钠[J].药物不良反应杂志,2006,8(2):148-151.
[5] Rollins KD,Lindley C.Pemetrexed:A multitargeted antifolate[J].Clinical Therapeutics,2005,27(9):1343-1382.
[6] Manegold C,Schmid-Bindert G,Pilz LR.Pemetrexed for the treatment of non-small-cell lung cancer[J].Drug Profile,2009,9(9):1195-1209.
[7] Cohen MH,Johnson JR,Wang YC,et al.FDA drug approval summary:pemetrexed for injection (Alimta)for the treatment of non-small cell lung cancer[J].Oncologist,2005,10(6):363-368.
[8] Scagliotti GV,Parikh P,Pawel JV,et al.PhaseⅢ study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer[J].J Clin Oncol,2008,26(21):3545-3557.
[9] Hanna N,Shepherd FA,Fossella FV,et al.Randomized phaseⅢtrial of pemetrxed versus docetaxel in patients with non-small-cell lung cancer previously treated with chemotherapy[J].J Clin Oncol,2004,22(9):1589-1597.
[10]Ciuleanu T,Brodowicz T,Zielinski C,et al.Maintenance pemetrexed plus best supportive care versus placebo plus best supportive care for non-cell lung cancer:a randomised,double-blind,phase 3study[J].Lancet,2009,374(9699):1432-1440.
[11]Patel JD,Hensing TA,Rademaker A,et al.Phase Ⅱstudy of pemetrexed and carboplatin plus bevacizumab with maintenance pemetrexed and bevacizumab as first-line therapy for nonsquamous non-small-cell lung cancer[J].J Clin Oncol,2009,27(20):3285-3298.
[12]Alex AA,Mandrekar SJ,Dy Gk,et al.PhaseⅡ secondline study of pemetrexed(pem)in combination with bevacizumab(bev)in patients with advanced non-small cell lung cancer (NSCLC):an NCCTG and SWOG study N0426[J].J Clin Oncol,2010,28(4):614-619.
[13]Spigel DR,Hainsworth JD,Shipley DL,et al.A randomized phaseⅡtrial of pemetrexed/gemcitabine/bevacizumab or pemetrexed/carboplatin/bevacizumab in the firstline treatment of elderly patients with advanced nonsmall cell lung cancer[J].J Thorac Oncol,2012,7(1):196-202.
[14]Argiris A,Karamouzis MV,Gooding WE,et al.PhaseⅡtrial of pemetrexed and bevacizumab in patients with recurrent or metastatic head and neck cancer[J].J Clin Oncol,2011,29(9):1140-1145.
[15]Zinner RG,Saxman SB,Peng G,et al.Treatment rationale and study desing for a randomized trial of pemetrexed/carboplatin fpllowed by maintenance pemetrexed versus paclitaxel/carboplatin/bevacizumab followed by maintenance bevacizumab in patients with advanced non-smallcell lung cancer of nonsquamous histology[J].Clin Lung Cancer,2010,11(5):352-357.
[16]Govindan R,Bogart J,Stinchcombe T,et al.Randomized phaseⅡ study of pemetrexed,carboplatin,and thoracic radiation with or without cetuximab in patients with locally advanced unresectable non-small cell lung cancer:Cancer and Leukemia Group B trial 30407[J].J Clin Oncol,2011,29(23):3120-3125.
[17]Gronberg BH,Bremnes RM,Flqtten Y,et al.Phase Ⅲstudy by the norwegian lung cancer study group:pemetrexed plus carboplatin compared with gemcitabine plus carboplatin as first-line chemotherapy in advanced nonsmall-cell lung cancer[J].J Clin Oncol,2009,27(19):3217-3224.
[18]Scagliotti G,Hanna N,Fossella F,et al.The differential efficacy of pemetrexed according to NSCLC histology:a review of two phaseⅢ studies[J].Oncologist,2009,14(3):253-263.
[19]Li T,Ling YH,Goldman ID,et al.Schedule-dependent cytotoxic synergism of pemetrexed and erlotinib in human non-small cell lung cancer cells[J].Clin Cancer Res,2007,13(11):3413-3422.
[20]Kano Y,Tanaka M,Akutsu M,et al.Schedule-dependent synergism and antagonism between pemetrexed and docetaxel in human lung cancer cell lines in vitro[J].Cancer Chemother Pharmacol,2009,64(6):1129-1137.
