316L医用不锈钢材料加载低浓度三氯生抑菌效果评价
2012-09-27余海亮李可洲刘恒全姚豫桐
余海亮,李可洲,刘恒全,黄 楠,蒲 克,骆 乐,姚豫桐
随着影像技术及生物工程的发展,胆管内支架植入逐渐成为治疗胆道良、恶性狭窄非外科手术的主要方法,但支架植入后的胆道损伤、胆道反复感染、细菌生物膜形成、胆泥淤积、胆石形成、肿瘤生长、组织反应增生等[1-2]导致置入支架的胆管再次梗阻,这一直是胆道外科介入治疗的难点,其中胆道感染对支架植入后胆道再梗阻的发生和发展呈正相关[3-4],为了防止支架植入后胆道感染及胆道再狭窄,胆道支架中逐渐改良为药物涂层支架。
本研究是观察并评价三氯生在体外低浓度下及加载于胆道支架材料胆汁环境下的抑菌效果,及评价联合紫杉醇后其抑菌效果,并与临床常用药物盐酸左氧氟沙星相比较,现报告如下。
材料与方法
1 抑菌环实验
实验步骤按NCCLS M2-A7(2000年)纸片扩散法[5]标准操作。三氯生-聚乳酸-羟基乙酸共聚物(PLGA)-丙酮溶液配制:分别取三氯生0.01g和PLGA 0.02g溶解于99%的化学纯丙酮溶液10ml中,三氯生药物浓度为1mg/ml,再用倍比稀释法进行稀释,分别配制成浓度为 A:1mg/ml,B:0.5mg/ml,C:0.25mg/ml,D:0.125mg/ml,E:0.0625mg/ml,F:0.03125mg/ml的三氯生-PLGA-丙酮溶液;盐酸左氧氟沙星溶液浓度相同;紫杉醇丙酮溶液浓度为0.01mg/ml。试验重复3次,数据用SPSS 10.0软件进行方差分析,P<0.05认为有统计学意义。
2 药物材料表面涂层体外胆汁浸泡实验
2.1 灭菌胆汁制备 取新鲜人“T”管引流胆汁100ml,将人胆汁用60Co放射性同位素γ射线辐照灭菌,剂量为8kGy。
2.2 三氯生涂层材料的制备 取316L医用不锈钢材料切割成直径5mm,厚度为2mm的圆形小片,共计12片,再用依次用200目、400目、600目、800目、1000目、1200目砂纸及抛光布机械抛光材料致镜面;将经蒸馏水、超声波震荡洗涤后,高温消毒,三氯生-PLGA-丙酮溶液(0.25mg/ml)旋转喷涂于316L医用不锈钢材料表面,喷涂旋转8周,置入真空环境中干燥1h。
2.3 方法 材料表面药物涂层体外胆汁浸泡实验 取预先消毒的6×4孔平板,取消毒胆汁4ml分别注入孔内,再滴入两种配置好的菌悬液0.5ml,振荡3min后分别加入制备好316L医用不锈钢裸材料(A组)、316L医用不锈钢+PLGA+三氯生(B组)的材料片,置入37℃振荡温箱培养24h后取出观察结果。
2.4 药物材料表面涂层体外胆汁浸泡实验检测用间接免疫荧光染色标定层黏连蛋白及细菌,用BI-2000医学图像分析系统对各组切片单位面积阳性细胞所占百分比进行半定量分析,并用扫描电镜观察、拍照浸泡后材料的表面超微结构。所有步骤均严格按说明书操作。
2.5 图像处理和统计学处理 在100倍物镜下用荧光显微镜拍照,对荧光数量进行半定量分析。结果采用χ2检验、秩和检验,采用SPSS 10.0软件进行统计,P<0.05为差异有统计学意义。
结 果
1 抑菌环法检测结果
在测试的不同三氯生药物浓度下对大肠杆菌和粪肠球菌的抑菌环均明显,按规定标准判定有抑菌作用(表1)。与相同浓度的左氧氟沙星药物相比较,均优于同浓度的左氧氟沙星(P<0.005);但联合紫杉醇后,三氯生抑菌效果相对单用三氯生明显降低(P<0.005),与左氧氟沙星比较也无明显优势(P>0.005)。
2 免疫荧光染色结果
如图1、2所示,三氯生-PLGA涂层的316L医用不锈钢材料表面吸附的细菌为8.52%,而316L医用不锈钢裸材料表面吸附细菌69.48%,两者相比有显著性统计学差异(P<0.05),而如图3、4所示,三氯生-PLGA涂层的材料表面吸附的层黏连蛋白为75.54%,相比之下裸材料表面的为89.81%,两者之间也有显著性统计学差异(P<0.05)。
3 扫描电镜检测结果
扫描电镜可见316L医用不锈钢裸材料表面有较多球菌及杆菌呈团块样黏附,而三氯生-PLGA表面黏附明显减少(图5、6)。
表1 各试验样片的平均抑菌环直径(mm±s)

表1 各试验样片的平均抑菌环直径(mm±s)
两种阴性对照抑菌环直径为0mm。试验用各菌悬液的平均浓度:大肠杆菌:108 7000CFU/ml;粪肠球菌:14304000CFU/ml。与相同浓度的左氧氟沙星药物相比较:*P<0.005
浓度 三氯生组 左氧氟沙星组 三氯生+紫杉醇组大肠杆菌 粪肠球菌A 40.23±1.54* 38.55±1.83* 28.75±1.28 30.54±1.87 29.54±1.54 22.64±1.38大肠杆菌 粪肠球菌 大肠杆菌 粪肠球菌12.27±1.83 14.67±1.88 12.86±1.31 7.84±1.87 B 35.44±1.85* 36.64±1.32* 23.63±2.13 28.46±1.75 26.64±1.28 17.39±1.45 C 31.65±1.78* 32.86±1.52* 19.04±1.38 24.53±1.52 19.76±1.25 15.24±1.28 D 27.75±1.18* 28.27±2.18* 17.45±1.76 21.63±1.28 17.86±1.48 11.49±1.83 E 24.26±2.05* 23.69±1.86* 13.93±1.39 17.42±1.86 14.67±1.27 9.48±1.35 F 21.85±1.28* 22.06±1.88*

图1 三氯生-PLGA涂层表面黏附细菌的荧光标定( ×100)
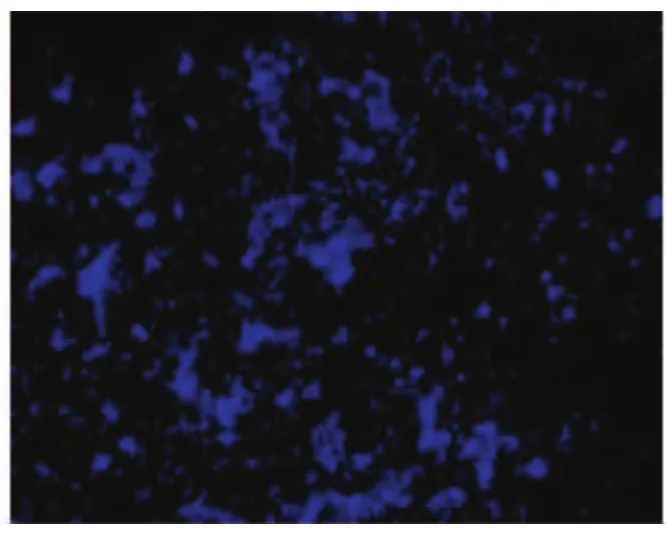
图2 316L医用不锈钢材料裸材料表面黏附细菌的荧光标定( ×100)

图3 三氯生-PLGA涂层表面吸附层黏连蛋白的荧光标定( ×100)
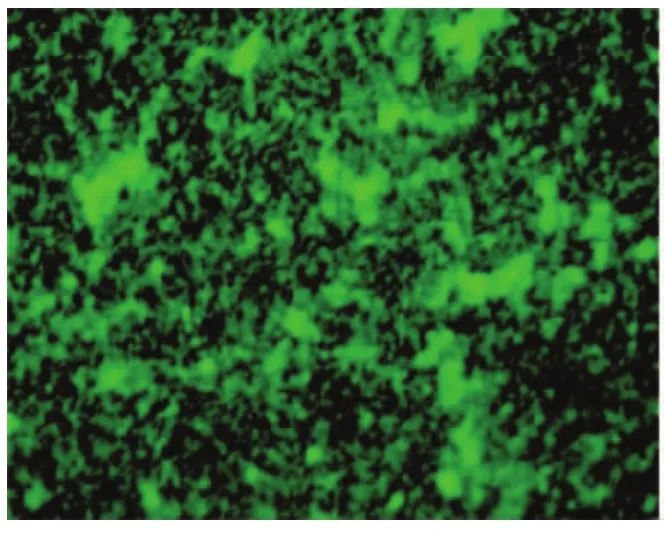
图4 316L医用不锈钢裸材料表面吸附层黏连蛋白荧光标定( ×100)
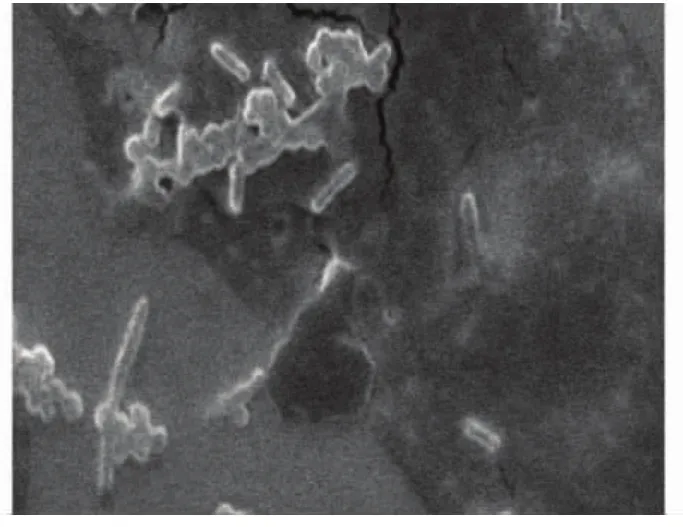
图5 三氯生-PLGA表面黏附细菌扫描电镜( ×3000)
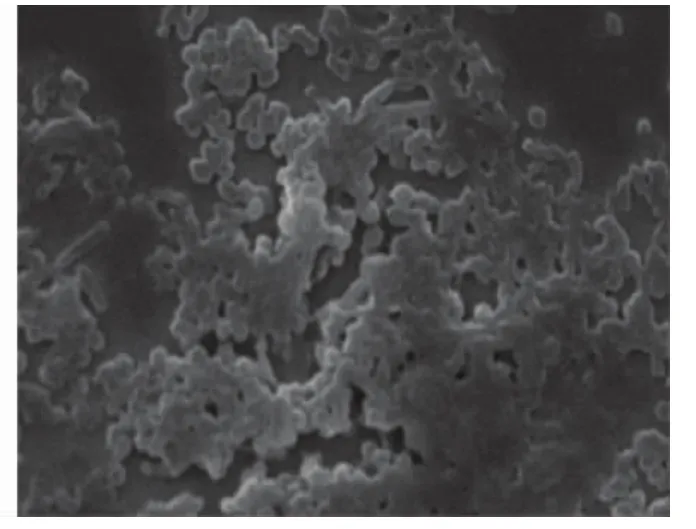
图6 316L医用不锈钢裸材料表面黏附细菌扫描电镜( ×3000)
讨 论
在支架置入早期,胆道感染就是加重患者原有胆道梗阻及胆管炎症状的根本原因,是导致支架置入后胆道再次阻塞的主要原因。
Neve等[6]报道了胆道梗阻后胆道中最常见的微生物是大肠杆菌(36.6%),肺炎克雷伯菌(18.3%),铜绿假单胞菌(8.3%),普通变形杆菌(8.3%)和凝固酶阴性葡萄球菌(8.3%)。Rerknimitr和 Fogel[7]对支架植入病人胆汁进行培养,并与无支架病员的胆汁进行比较:其中支架置入组的阳性率(98%)明显高于无支架组(55%),且易于出现菌血症(46%vs 21%,P<0.05),其中最常见的细菌为粪肠球菌(31%),而无支架组胆道梗阻感染中最常见的细菌为大肠埃希杆菌(17%)。
支架植入后,在这些植入物的表面快速的覆盖了1层宿主分泌的吸附蛋白,形成1层20~100A的蛋白吸附层,如纤维连接蛋白、层黏连蛋白、纤维素、胶原和免疫球蛋白[8];纤维连接蛋白和玻璃黏连蛋白(S-蛋白)被认为是吸附在支架内表面主要的胆汁蛋白[9];以这些物质表面为条件,使随之进入胆道的细菌很容易黏附在材料表面。细菌表面的一些结构特点,如荚膜、鞭毛、菌毛和黏液在细菌的黏附中起着关键的作用;纤维蛋白、玻璃黏连蛋白和黏蛋白可促进细菌黏附于支架表面的过程,特别是细菌配体一旦遇到能与之结合的生物材料或吸附在材料表面上蛋白层中的受体上,则牢固地黏附在生物材料表面,完成黏附过程中受体与配体的结合,使黏附进一步加固,逐渐形成细菌生物膜,从而避免被人体吞噬细胞及大剂量抗生素的杀灭[10];粪肠球菌和厌氧的产气荚膜杆菌、梭状芽孢杆菌产生一种葡萄糖醛酸苷酶,分解胆红素加速胆汁沉渣的形成;同时细菌的磷脂酶C能水解胆汁中的卵磷脂,引起脂肪酸钙盐的沉积,从而导致了大量的不溶于水的物质形成并在胆管中沉淀,阻塞胆管[11]。
三氯生化学名称 2,4,4’-三氯-2’-羟基二苯醚,易溶于多种有机溶剂及表面活性剂,但对强酸强碱及热具有高度稳定性,且对常见致病性革兰氏阳性阴性细菌、真菌、酵母及病毒等都具有广泛的杀灭及抑制作用,从而日渐广泛应用于医疗卫生领域;但在内置导管、支架方面没有相关研究。三氯生主要通过抑制细菌脂肪酸合成系统中的一个关键酶-烯脂酰-酰基载体蛋白还原酶(ENR)的活性,阻止细菌合成脂肪酸[12],从而抑制细菌细胞膜的形成和细菌的繁殖,由于人类没有这个关键ENR酶,三氯生一直被认为对人体影响较小;本试验结果证实低浓度的三氯生对粪肠球菌和大肠杆菌均显示出有明显的抑菌效果;这两种细菌是胆道常见的致病菌,且分别代表了革兰氏阳性球菌、革兰氏阴性杆菌,说明该药物在体外对常见细菌繁殖体具有较好的抗菌应用价值,且呈剂量依赖性,随着剂量的降低,抑菌环逐渐减小;但与临床常用于胆道系统抗生素盐酸左氧氟沙星相比较,同等浓度下三氯生明显优于左氧氟沙星抗菌效果,但在紫杉醇应用后,不同浓度下的三氯生抗菌效果均有所减弱,考虑为三氯生羟基键与紫杉醇形成化学键结合,影响了三氯生与细菌酶的结合,从而影响了抗菌效果。在胆汁浸泡环境下,三氯生的抗菌效果仍较为明显,但材料表面的蛋白黏附仍较多,说明三氯生仅有抗菌效果,通过抑制细菌繁殖、减少黏附,使得胆汁中蛋白成分吸附于三氯生涂层的材料表面有所减少;但在体内胆道情况下三氯生效果需进一步研究,且课题组将进一步选用联合协同抗蛋白黏附的药物,延长胆道支架置入后通畅时间,逐步进行安全性实验和动物实验,以进一步减轻疾病症状、延长胆道再次梗阻时间。
[1] Catalano OA,Sahani DV,Forcione DG,et al.Biliary infections:spectrum of imaging findings and management[J].Radiographics,2009,29(7):2059-2080.
[2]谭志刚,郭奕彤.胆道金属支架再狭窄原因及支架置入的治疗展望[J].中国组织工程研究与临床康复,2010,14(9):1669-1672.
[3] Kiran MD,Giacometti A,Cirioni O,et al.Suppression of biofilm related,device-associated infections by staphylococcal quorum sensing inhibitors[J].Int J Artif Organs,2008,31(9):761-770.
[4] Donelli G,Guaglianone E,Rosa RD,et al.Plastic biliary stent occlusion:factors involved and possible preventive approaches[J].Clin Med Res,2007,5(1):53-60.
[5] NCCLS.Approved Standard NCCLS document M2-A7:National committee for clinical laboratory standards performance standards for antimicrobial disk susceptibility tests[S].Wayne:NCCLS,2000:20.
[6] Neve R,Biswas S,Dhir V,et al.Bile cultures and sensitivity patterns in malignant obstructive jaundice[J].Indian J Gastroenterol,2003,22(1):16-18.
[7] Rerknimitr R,Fogel EL.Microbiology of bile in patients with cholangitis or cholestasis with and without plastic biliary endoprosthesis[J].Gastrointest Endosc,2002,56(6):885-889.
[8] An YH,Friedman RJ.Concise review of mechanisms of bacterial adhesion to biomaterial surfaces[J].J Biomed Mater Res,1998,43(3):338-348.
[9] Zen Y,Harada K,Sasaki M,et al.Lipopolysaccharide induces overexpression of MUC2 and MUC5AC in cultured biliary epithelial cells[J].Am J Pathology,2002,161(4):1475-1484.
[10] Sung JY,Leung JW,Shaffer EA,et al.Bacterial biofilm,brown pigment stone and blockage of biliary stents[J].J Gastroenterol Hepatol,1993,8(1):28-34.
[11] Trotman BW.Pigment gallstone disease[J].Semin Liver Dis,1983,3(2):112-119.
[12] Heath RJ,Rubin JR,Holland DR,et al.Mechanism of triclosan inhibition of bacterial fatty acid synthesis[J].J Biol Chem,1999,274(16):11110-11114.
