传染性法氏囊病病毒VP2基因原核表达及抗原性分析
2012-09-26单学强李明义
单学强,李明义,高 轩*
(1.河北农业大学动物科技学院,河北保定071000;2.山东信得科技股份有限公司,山东青岛266061)
传染性法氏囊病(Infectious bursal disease,IBD)是由传染性法氏囊病病毒(Infectious bursal disease virus,IBDV)引起的鸡和火鸡的一种高度接触性传染病[1],给世界各国的养禽业带来了巨大经济损失。从IBDV发现至今,新的变异株和超强毒株不断出现,使得原有传统活疫苗和灭活疫苗无法阻止IBD的发生和流行。因此,迫切需要开发更加安全、有效的新型疫苗。VP2是IBDV主要的宿主保护性抗原[2],可以诱导宿主机体产生病毒中和性抗体,具有型特异性,已成为近年来是众多学者研究的热点。
本研究利用分离的IBDV LN株基因组核酸为模板,构建重组表达质粒p ET28a-VP2;使用大肠埃希菌进行原核表达,制备VP2蛋白并分析VP2蛋白的生物学活性,为鸡传染性法氏囊病基因工程亚单位疫苗的研制奠定基础。
1 材料与方法
1.1 材料
1.1.1 病料 采集发病鸡的法氏囊组织(病料来自辽宁省大连市发病鸡场),置-70℃冷冻保存;SPF鸡胚和SPF鸡购自济南昊泰实验动物繁育有限公司。
1.1.2 主要试剂 E.coli DH5α及E.coli BL21(DE3)为本实验室保存、p MD18-T 载体,购自Ta KaRa公司,p ET28a载体为本实验室保存;IBDV标准抗原及标准阳性血清,购自中国兽医药品监察所;Taq酶及限制性内切酶Eco RⅠ、Hin dⅢ,购自TaKaRa公司;MLV,购自Promega公司;TRIzol Reagent,购自Invitrogen公司;Gel Extraction Kit(50),购自OMEGA公司;HRP标记羊抗鸡IgG,购自索莱宝生物公司。
1.1.3 引物设计与合成 参照GenBank中登录的IBDV VP2序列(AB024076.1),利用生物学软件DNA Star对IBDV VP2基因进行同源性比较和限制性内切酶位点、开放阅读框(ORF)及模拟抗原表位分析,利用primer5,0软件设计两对引物进行套式PCR。扩增片段预计1 370 bp。
第一 套引物:上游引物 5′-GAC AAA CGA TCG CAG CG -3′,下游引物 5′-GGC AGG TGG GAA CAA TG-3;第二套引物:上游引物5′-GCG AAT TCA TGA CAA ACC TGC AAG ATC-3′(下划线处酶切位点为Eco RⅠ),下游引物5′-GGAAG CTTTCA CCT TAT GGC CCG GAT TAT G-3′(下划线处酶切位点为Hin dⅢ)。引物由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 病毒的分离 取法氏囊组织1.36 g,按1∶5的比例(质量比)加无菌PBS匀浆,反复冻融3次,6 000 r/min离心10 min,取上清液经0.22μm滤器过滤除菌后,经绒毛尿囊膜(CAM)途径接种9日龄SPF鸡胚10枚,每胚接种病毒液0.2 mL;另设5枚鸡胚接种生理盐水作为对照,每枚接种0.2 mL。接种后24 h内死亡的鸡胚弃去,每隔6 h照胚1次,收集120 h内死亡的鸡胚,观察鸡胚病变,收集病变明显的绒毛尿囊膜进行匀浆处理,反复冻融3次后,6 000 r/min离心10 min,取上清将分离到的病毒液,置-20℃保存备用。
1.2.2 动物回归试验 将15羽同一批次的4周龄SPF鸡随机分成两组,人工攻毒组10羽,每羽0.1 mL病毒液擦肛,正常对照组5羽,每羽0.1 mL生理盐水擦肛。在隔离器内相同条件下饲养,每日观察两组鸡的临床症状,96 h后处死全部鸡只,观察并比较病理变化。取病变典型鸡只的法氏囊组织按1∶3比例加入PBS匀浆后反复冻融3次,离心取上清进行琼脂免疫扩散试验,观察并记录结果。
1.2.3 IBDV VP2基因片段的扩增、克隆及原核表达质粒的构建 按照TRIzol说明书提取鸡胚尿囊膜中IBDV的总RNA,应用RT-PCR扩增IBDV VP2基因片段;PCR产物经过8 g/L琼脂糖凝胶电泳分析,将目的条带用凝胶回收试剂盒回收,连接到p MD18-T载体上,将阳性重组质粒命名为p MD-VP2,经过PCR及Eco RⅠ、Hin dⅢ双酶切鉴定后,送上海生工生物工程技术服务有限公司测序。测序正确后使用Eco RⅠ、Hin dⅢ分别双酶切p MD-VP2和pET28a,酶切产物用8 g/L的琼脂糖凝胶进行电泳,将目的条带分别用凝胶回收试剂盒回收后,在T4 DNA ligase的作用下16℃连接过夜。将构建好的重组表达质粒pET28a-VP2转化到E.coli DH5α感受态细胞中,送上海生工生物工程技术服务有限公司测序。测序正确后将阳性重组质粒转化至E.coli BL21(DE3)感受态细胞中,复苏后用于诱导表达。
1.2.4 诱导表达 在温度、时间、诱导物浓度3个单因素试验基础上,根据3个因素交互作用,对诱导表达的条件进行优化。表达产物应用SDS-PAGE和 Western blot进行分析[3]。
1.2.5 VP2蛋白的制备及免疫原性分析 取2 g诱导表达后的菌体加入20 mL含10 mL/L Triton X-100的p H8.0 PBS洗涤1次,在4℃以10 000 r/min离心2 min,弃上清。加入20 mL p H8.0的PBS,加 溶 菌 酶 至 100μg/mL,加 EDTA 至 2 mmol/L,37℃保温1 h。反复冻融3次,重悬置于冰上用超声波细胞破碎仪于功率200 W下破碎(工作4 s,间隔4 s,60次循环)后,在4℃以12 000 r/min离心20 min,收集上清加入2 mL/L的甲醛37℃恒温振荡24 h。将制备的含有VP2蛋白的上清液与白油佐剂按1∶2的比例乳化制成油乳剂疫苗。将3周龄15羽SPF鸡随机分成两组,第一组10羽每只鸡注射油乳剂疫苗0.3 mL,第二组5羽每只鸡注射0.2 mL白油佐剂作为对照组,免疫注射后3周翅下采血,分离血清,进行琼脂扩散试验。
2 结果
2.1 鸡胚接种试验
鸡胚在接种后72 h~120 h内全部死亡,死亡鸡胚尿囊膜增厚、水肿、出血。死亡胚体周身水肿,出血,以头和趾部出血较为严重,肝脏有斑驳状坏死,心脏灰白色呈熟肉样,对照组鸡胚健活。
2.2 动物回归试验
SPF鸡接种后36 h出现精神呆滞,食欲废绝,背部羽毛竖起整体呈球状,发病率达到100%;96 h处死后,可见胸肌、腿肌出血明显,法氏囊肿大,浆膜层呈现黄色胶冻样。琼脂免疫扩散试验结果表明,IBDV阳性血清与IBDV标准抗原和回归试验鸡的法氏囊组织匀浆之间均出现沉淀线,而与阴性对照之间无沉淀线出现(图1)。

图1 传染性法氏囊病病毒琼脂免疫扩散试验Fig.1 AGID analysis of IBDV
2.3 VP2基因的扩增与表达载体的构建
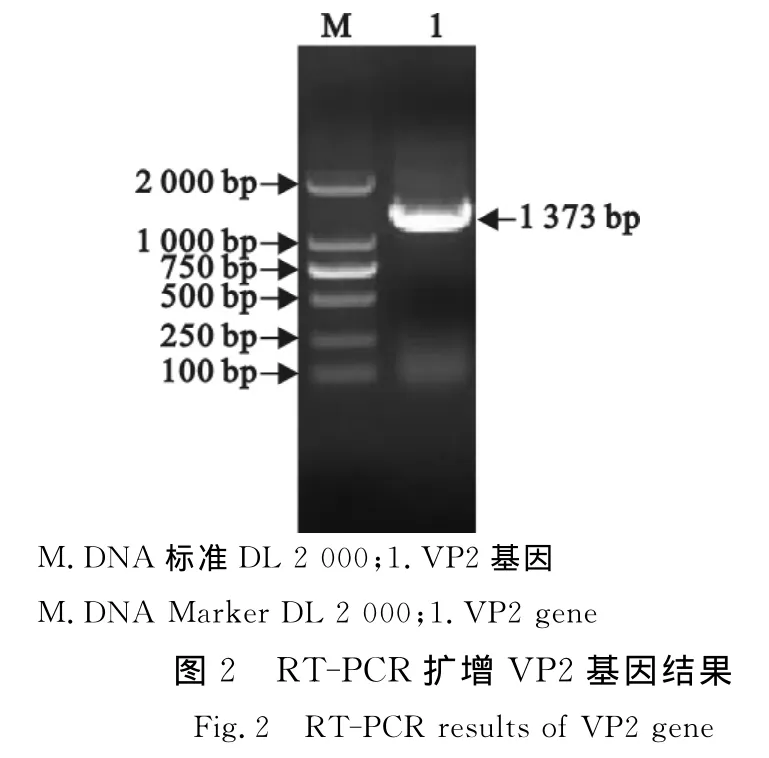
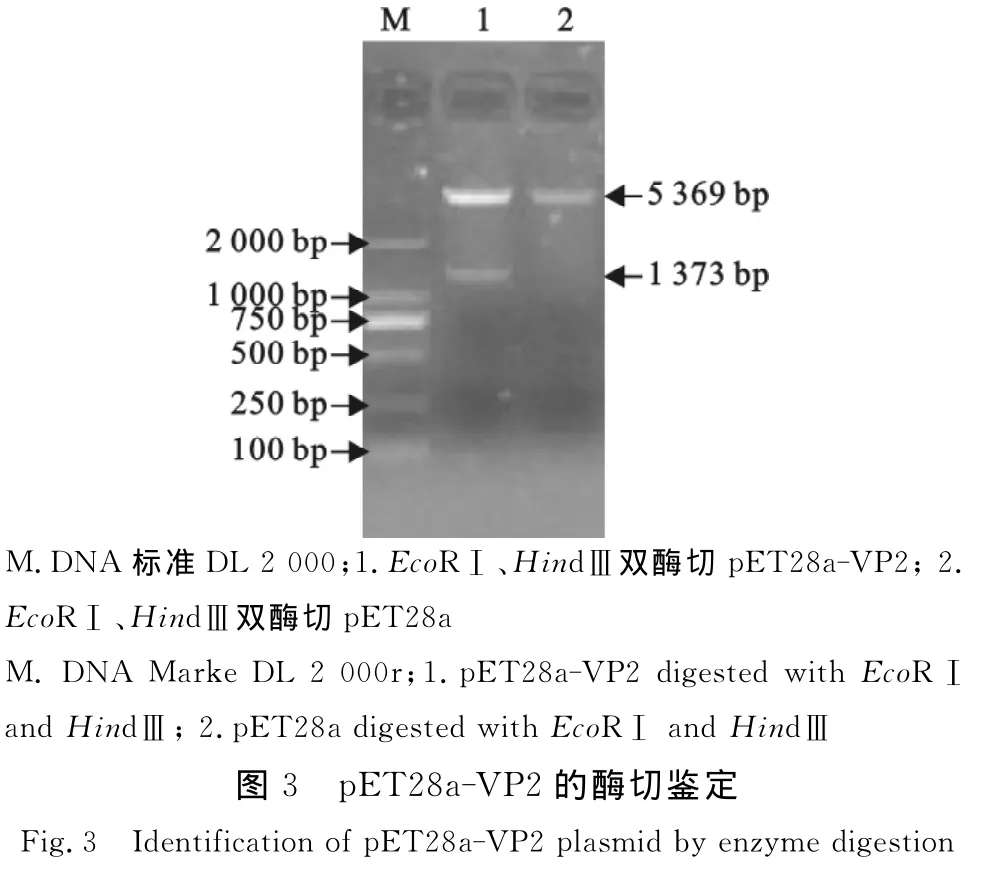
PCR产物经琼脂糖凝胶电泳后,出现1条约1 373 bp的目的条带(图2),与预期片段大小一致;将构建好的p ET28a-VP2用Eco RⅠ、Hin dⅢ双酶切可以切出约1 373 bp的条带(图3),说明VP2基因已经克隆到p ET28a载体上,阳性重组质粒测序后正确。
2.4 VP2基因原核表达及鉴定
将含有阳性质粒的宿主菌,在LB液体培养基中培养至OD600 nm为0.8时,IPTG诱导终浓度为0.5 mmol/L,温度30℃,诱导表达时间8 h;以未诱导的宿主菌及诱导的p ET28a空载体做为对照组。将菌体处理后进行SDS-PAGE,结果在48 ku处出现目的条带(图4),而且以可溶的形式存在;West-ern blot的结果表明VP2蛋白可与抗鸡IBDV阳性血清发生特异性反应(图5)。说明VP2基因被正确表达,且具有反应原性。

2.5 VP2蛋白的免疫原性分析
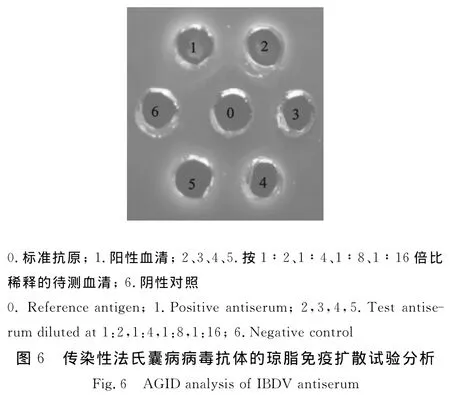
3周龄SPF鸡免疫接种后2周,翅下采血分离血清按对倍比稀释后进行琼脂免疫扩散试验,疫苗免疫组的效价可以达到23,对照组无效价(图6)。说明VP2蛋白免疫接种后可以引起机体产生针对IBDV的中和性抗体。

3 讨论
VP2蛋白占病毒衣壳蛋白总量的51% ,是IBDV的主要宿主保护性抗原,与病毒中和抗体的诱导与识别、病毒毒力的变异、病毒的抗原漂变、细胞凋亡的诱导等有关[4];因此利用VP2来开发基因工程疫苗成为近年来的研究热点。目前VP2基因在大肠埃希菌、酵母、昆虫细胞、禽痘病毒、腺病毒、火鸡疱疹病毒等表达系统中得到成功表达,利用其制备的 DNA 疫苗[5-6]、亚 单位疫 苗[7-8]、病毒活 载体疫苗免疫保护效果已经得到证实[9-10]。
本研究以大肠埃希菌表达系统表达的IBDV VP2蛋白作为抗原制备成油乳剂疫苗,免疫接种2周龄SPF鸡能诱导SPF鸡产生抗IBDV免疫力。说明通过原核表达系统表达的VP2蛋白具有生物学活性,只要以适宜水平、适当接种次数、适当途径(肌肉注射和皮下注射)刺激机体就可以产生较高的抗体水平。
[1]Berg T P,Gonze M,Meulemans G.Acute infectious bursal disease in poultry:isolation and characterization of a highly virulent strain[J].Avian Pathol,1991,20(1):133-143.
[2]Brandt M,Yao K,Liu M,et al.Molecular determinants of virulence,cell tropism,and pathogenic phenotype of infectious bursal disease virus[J].J Virol,2001,75(24):11974-11982.
[3]萨姆布鲁克,弗里奇,曼尼阿蒂斯.分子克隆实验指南[M].2版,金冬雁,黎孟枫,等,译.北京:科学出版社,2003.
[4]祁小乐,高玉龙,高宏雷,等.鸡传染性法氏囊病病毒VP2蛋白研究进展[J].中国预防兽医学报,2008,30(8):656-660.
[5]Sun J H,Yan Y X,Jiang J,et al.DNA immunization against very virulent infectious bursal disease virus with VP2-4-3 gene and chicken IL-6 gene[J].J Vet Med B Infect Dis Vet Public
Health,2005,52(1):1-7.
[6]Kim S J,Sung H W,Han J H,et al.Protection against very virulent infectious bursal disease virus in chickens immunized with DNA vaccines[J].Vet Microbiol,2004,101(1):39-51.
[7]Wu P C,Su H Y,Lee L H,et al.Secreted expression of the VP2 protein of very virulent infectious bursal disease virus in the methylotrophic yeast Pichia pastoris [J].J Viro Meth,2005.123(2):221-225.
[8]Rong J,Cheng T P,Liu X N,et al.Development of recombinant VP2 vaccine for the prevention of infectious bursal disease of chickens[J].Vaccine,2005,23(40):4844-4851.
[9]Butter C,Sturman T D M,Baaten B J G,et al.Protection frominfectious bursal disease virus (IBDV)-induced immunization with a fowlpox recombinant containing IBDV-VP2[J].Avian Pathol,2003,32(6):597-604.
[10]Huang Z H,Yunus AS,Samal SK,et al.A Recombinant Newcastle disease virus(NDV)expressing VP2 protein of infectious bursal disease virus(IBDV)protects against NDV and IBDV[J].J Virol,2004,78(18):10054-10063.
