杂化电子的离域和轨道杂化的起因*
2012-09-25周再春刘秋华
周再春 刘秋华
(湖南科技大学化学化工学院化学系 湖南湘潭 411201)
原子在成键时受到相邻原子的作用,原有的一些能量接近的原子轨道重新组合成新的原子轨道,使轨道发挥更高的成键效能,这叫做轨道杂化。该概念是美国化学家鲍林在1931年首先提出的,经过不断深化和完善,现已成为当今化学键理论的重要内容之一。杂化轨道的成键能力比原轨道的成键能力大大提高,因此由杂化轨道成键时给体系带来的稳定能远远超过杂化时需要的能量。那么为什么杂化后轨道的成键能力会大大提高呢?定域键的多原子分子可以看成是由相对独立的两个原子之间的化学键把原子连接起来形成的。价键理论(VBT)认为,分子中化学键之间的相互作用近似为零[1],即相邻化学键之间的影响可以忽略。但这种影响是否真的可以忽略呢?另外,为什么能量相近的轨道才可以参与杂化,不完全等价的轨道在杂化后能量还会平均化吗?基于这些疑问,我们推测,轨道的杂化远不是几个成键轨道的简单组合,而是涉及到杂化电子的强烈相互作用——电子离域。
1 轨道杂化起因的推测
一般将饱和共价键当作定域化学键来看待,忽略了相邻化学键之间的影响。但轨道杂化时给体系带来了明显的稳定化作用[1],这很难用定域键的观点来解释,也就是说相邻化学键之间的影响(主要是电子离域)是不能忽略的。共价键是原子间通过共用电子对(电子云重叠)而形成的相互作用,形成重叠电子云的电子在所有成键的原子周围运动,那么能量接近的电子在相邻成键轨道间互相交换应当完全可行。可以推测:原子轨道间电子的交换(即电子互相跃迁)导致了电子的离域化作用,相邻原子轨道间的电子离域是轨道杂化的直接原因,而轨道杂化的根本原因是电子在原子轨道间的频繁交换。这个推测能很好地解释轨道杂化时对轨道能级的要求,以及杂化后总能量的降低和键参数的平均化等。
轨道杂化要求参与杂化的轨道能级必须接近,以确保电子在杂化前的轨道间能顺利地互相跃迁,这是电子离域的前提;若轨道能级差过大,不利于电子在轨道间的跃迁,也就无从离域。轨道杂化(或电子离域)的根本原因是杂化电子在原子轨道间的交换(电子互相跃迁)。
轨道杂化引起体系能量的降低。杂化电子离域起源于电子在原子轨道间的交换,而电子的交换使其占据了比定域轨道更大的空间,电荷更分散,电子云重叠更充分,表现为电子离域的特征,从而引起整个体系能量降低。轨道杂化后键参数的平均化则是因为电子的交换,引起了能量的交换,键能平均化了,键长等参数也随之平均化。
2 杂化电子离域的证据

轨道杂化体系具有极其相似的表现。以CH4为例,它的4个C—H键的键参数(如键长、键能)完全相同,即键参数完全平均化;其C—H键的键长(1.11Å)比C和H原子共价半径之和的1.14Å(rC=0.77Å,rH=0.37Å)略短,意味着键更牢固;CH4分子的轨道杂化离域能为EMD=90.8kJ·mol-1。轨道杂化后电子的离域可以很好地解释上述事实。
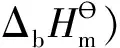
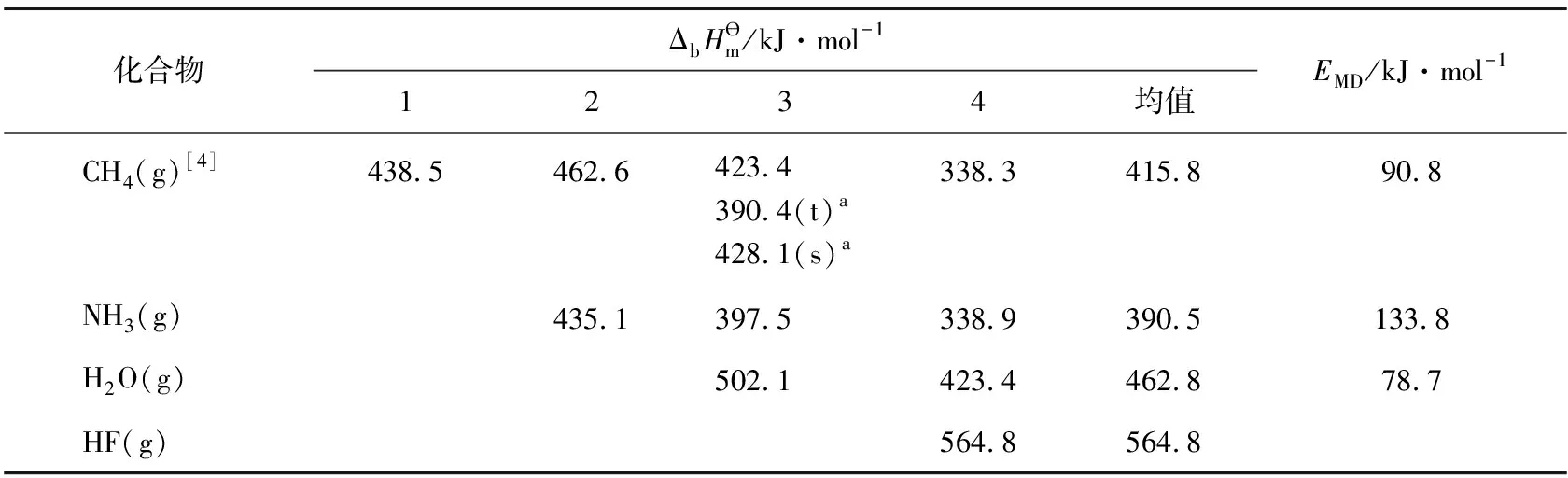
表1 4种化合物的键焓和分子离域能[2-3]
a:t,s分别表示三线态和单线态,数据源于文献[5]。

图1 各级键焓变化Nb表示键焓的顺序,为了便于比较,将最后断裂的键序定为4,依次类推。
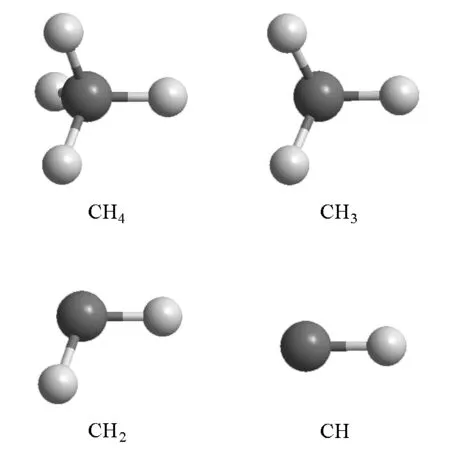
图2 CH4各级单元的空间伸展
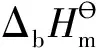

图3 卡宾单元三线态和单线态的构型差异
3 杂化电子离域能的估算
离域能可用来衡量不饱和共轭体系的电子离域程度及其稳定性,所以可借鉴共轭体系计算离域能(又称共轭能)的方法来估算轨道杂化后体系的离域能[6]。要估算轨道杂化之后能量的变化,有必要为轨道杂化新定义两个概念:绝对离域能(EAD)和相对离域能(ERD)。绝对离域能是指参与离域的键焓与没有参与离域的键焓之间的差值;相对离域能是指参与离域的键焓与各价键的平均键焓之间的差值。以CH4为例,相应的绝对离域能和相对离域能为:
(1)
(2)

综上所述,电子离域不仅只存在于共轭体系中,也存在于同一原子的能级相近的轨道间,杂化电子的离域来源于原子轨道间存在的电子交换。杂化电子离域这个观点可用于解释原子轨道杂化后分子出现的诸多现象。如杂化键参数的平均化,杂化现象只发生在能量接近的轨道之间,杂化后分子额外的稳定化作用等;还可以用轨道杂化离域能定量地判断杂化分子的稳定性。
[1] 武汉大学,吉林大学.无机化学.第4版.北京:高等教育出版社,2004
[2] Haynes W M.Handbook of Chemistry and Physics.91st ed.CRC Press,2010
[3] Luo Y R.Comprehensive Handbook of Chemistry Bond Energies.Boca Raton,FL:CRC Press,2007
[4] Seetula J A,Russell J J,Gutman D.JAmChemSoc,1990,112:1347
[5] Ruscic B,Litorja M,Asher R.JPhysChemA,1999,103:8625
[6] 邢其毅.基础有机化学.第3版.北京:高等教育出版社,2005
