液体发酵树舌提取凝集素的生理学功能检测
2012-09-25张春玉刘黎红邵佳甲逯家富
张春玉,宋 凯,刘黎红,邵佳甲,逯家富
(1.长春职业技术学院食品与生物技术分院,吉林长春 130033;2.东北师范大学生命科学学院,吉林长春 130024;3.长春师范学院生命科学学院,吉林长春 130032)
液体发酵树舌提取凝集素的生理学功能检测
张春玉1,2,宋 凯3,刘黎红1,邵佳甲1,逯家富1
(1.长春职业技术学院食品与生物技术分院,吉林长春 130033;2.东北师范大学生命科学学院,吉林长春 130024;3.长春师范学院生命科学学院,吉林长春 130032)
本文对树舌菌丝体的深层发酵工艺进行了初步的研究。试验结果表明,树舌菌丝体在大豆培养基中培养5天,产出的总蛋白、总糖含量较高。从发酵液中分离和纯化出树舌凝集素具有明显的生物学活性。
树舌;液体发酵;凝集素
20世纪60年代,人们就开始从真菌中提取生物活性物质,如多糖、多糖蛋白复合物、凝集素、核糖失活蛋白、多肽、嘌呤和三萜类等,并评价它们的抗肿瘤和抗病毒活性[1-2]。在这种需求下,真菌有效成分的获取成为研究的热点[3-5]。
传统方法都是通过野外采集或是人工栽培种植真菌子实体等,缺点是生长周期长、品质不易控制。1947年,Humfeld发明了深层发酵技术,使真菌具有可工业化大规模生产、产量高、周期短、易于控制、质量稳定、相对容易进行提取分离等优点[6]。本实验首先以树舌菌丝体为材料,对其深层发酵工艺的最优化条件进行研究。并对发酵液的有效成分凝集素进行提取分离,通过凝血实验评价其生理学功能。
1 材料
1.1 菌株
树舌菌种购自吉林农业大学菌物所。
1.2 培养基
YPG培养基:胰蛋白胨10 g·L-1,酵母提取物5 g·L-1,葡萄糖20 g·L-1(或麦芽糖15 g·L-1),MgSO40.5 g·L-1,KH2PO41 g·L-1。配制固体培养基时加琼脂粉15 g·L-1。110℃高压灭菌30min。
不同配比花生和大豆培养基的配制如下表,高压灭菌30min。

表1 不同培养基的成分配比 g·L-1
2 方法
2.1 接种及培养
树舌菌种活化培养一周后,切取约1cm2的菌丝体小块接种到以上6种液体培养基中,26℃摇床中,150rpm振荡培养,分别重复4组。
2.2 树舌菌丝体总蛋白含量的测定
(1)分别取每种培养基培养的菌丝体干样100mg,液氮中迅速研磨成细粉。
(2)加入到1ml预冷的10mMpH 7.4的PBS溶液中,4℃冰箱中放置24 h。
(3)12000rpm离心20 min。
(4)去除上清,将沉淀物用1ml预冷PBS缓冲液重新悬浮、离心。(5)取3和4步骤一次。
(6)BCA试剂盒法测定每种菌丝体中总蛋白含量。
2.3 树舌菌丝体总糖含量的测定
(1)分别取每种培养基培养的菌丝体干样100mg,液氮中迅速研磨成细粉。
(2)样品悬浮于25ml的80%的乙醇溶液中,95℃回流提取4h。
(3)回流后的混合液12000rpm离心20min。
(4)25ml热水重新溶解沉淀,95℃回流提取2 h。
(5)取混合液12000rpm离心15min,取上清液。
(6)苯酚-硫酸法测定总糖含量。
2.4 树舌菌丝体总生物量的测定
取一定量的发酵液3000rpm离心10 min。蒸馏水洗涤沉淀后置于55℃烘干称重。
2.5 树舌菌丝体发酵液pH值的测定
每天测定发酵液的pH值。
2.6 凝集素粗提液的制备和活性检测
称取液体培养的树舌菌丝体60g(鲜重),加入10mmol·L-1Tris-HCl(pH 8.0)置冰箱浸泡24h,经高速捣碎机匀浆后,4层纱布过滤,滤液在3500r/min条件下离心20min,收集上清液,即得粗提液。
2.7 血细胞凝集活性的实验
按照凝血活性测定法,在“V”型血凝板上,在“V”型血凝板中加入25μl的生理盐水,取凝集素粗提液(浓度为1mg·ml-1)25μl作倍比稀释,每孔加入2%的血球悬液。摇动血凝板使溶液混匀,血凝板在室温放置1.5~2h,显微镜下检测观察结果。
3 结果与讨论
3.1 总蛋白和总糖含量比较
蛋白质和多糖是大型真菌食用和药用价值的重要成分[7],本实验将树舌菌丝体分别接种于不同成分配比的花生和大豆液体培养基中,对所得的菌丝体的总蛋白含量、总糖含量进行了测定。图1给出了树舌在大豆液体培养基中培养时,获得总蛋白量都略高于或等于在花生培养基中的,且在加入20 g·L-1原料时培养状态最好,总蛋白含量最高。

图1 不同浓度配比的大豆和花生培养基培养树舌中总蛋白含量比较
总糖含量的测定采用苯酚-硫酸方法,并以葡萄糖作标准曲线。将各样品测得的平均OD值分别代入标准曲线方程,求得总糖的含量。如图1所示,糖含量的变化与蛋白量变化相一致,大豆培养基要优于花生培养基,且在20 g·L-1原料时培养状态最好。

图2 不同浓度配比的大豆和花生培养基培养树舌中总糖含量比较
3.2 树舌菌丝体总生物量
参照前面的实验数据,选取最优的花生培养基(20 g·L-1)进行总生物量的测定。树舌菌丝体在26℃条件下,110转/分的转数在摇床上振荡培养,其生长曲线近似“S”型(图3)。接种初期菌丝体生长很快,从第二天就进入对数生长期,直至第五天达到阈值。随后生长速度放缓,可能是经过生长的最高峰后培养基里的一些菌丝体代谢物产生了抑制的效果。7天后可见呈球状的菌丝体(图4)。
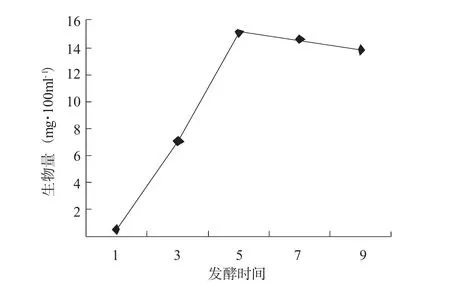
图3 树舌菌丝体生长曲线

图4 深层发酵培养的树舌菌丝体
3.3 树舌灵芝菌发酵液中pH值的变化
树舌菌丝体发酵液的pH值变化见图5,pH值在最初的两天有略下降的趋势,到了第三天迅速降低。结合上面的生长曲线分析,是由于在生长旺盛的阶段,菌丝体产生大量的酸性物质,直至发酵的第六天,这时菌丝体生长基本稳定,pH值也稳定在4.0~4.5之间。这说明,随着生长状态的变化,树舌菌丝体为了使环境适应自身的生长代谢,对酸碱度进行了自我调节。

图5 树舌菌丝体发酵液pH值的变化曲线
3.4 凝血实验
真菌凝集素的细胞凝集作用是凝集素分子的一个亚基与一个细胞表面的凝集素专一识别的糖基结合,另一个亚基与另一个细胞上的糖基结合,从而通过凝集素的“架桥”作用而导致的本试验中[8-9],树舌菌丝体粗提液经血凝实验检测有凝血活性,检测结果见图6左侧A为实验样品,右侧B为对照组(以0.9%NaCl作阴性对照)。这表明在这种发酵条件下,获得的凝集素具有良好的生理学活性。
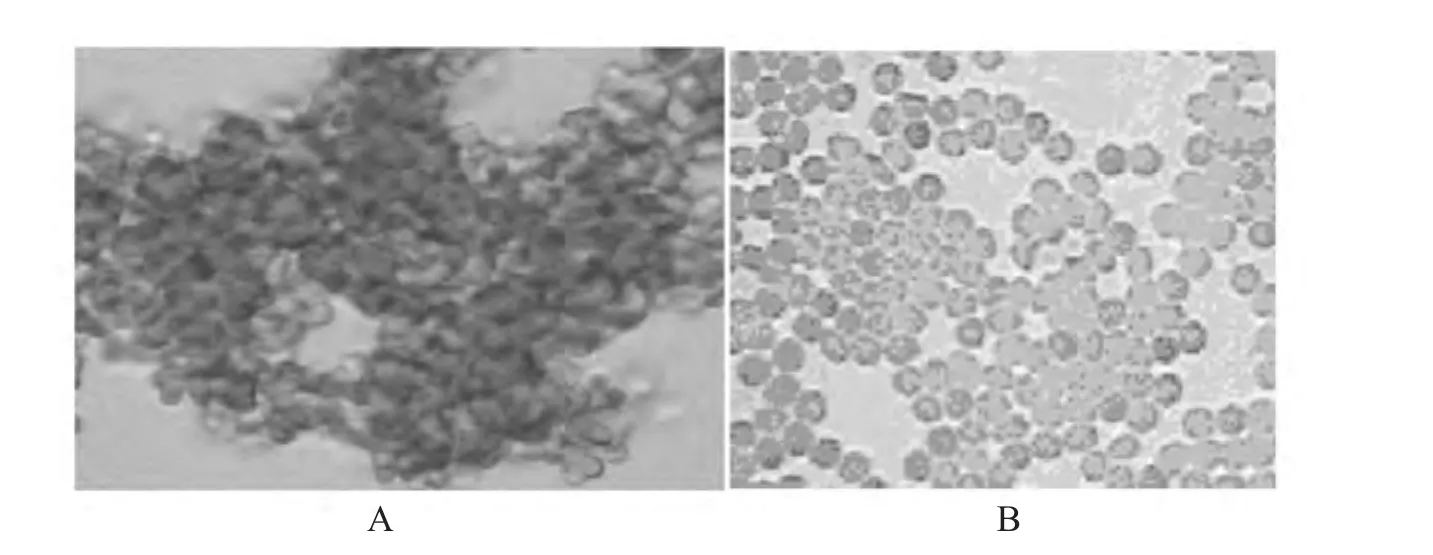
图6 凝集素对血细胞的凝血反应的显微照片
4 结论
本实验对树舌菌丝体的液体深层发酵培养工艺进行了优化,通过设定不同氮源、氮源不同含量、不同的发酵时间,对其总蛋白含量、总糖含量进行测定比较,确定了20 g·L-1的大豆培养基最为树舌菌丝体大规模深层发酵生产更为优良。在这种情况下,发酵的生物量变化和发酵液pH值变化相一致,且发酵5天时,树舌菌丝体生长状态最为良好,此时提取凝集素具有明显的凝血活性。
[1]黄年来,吴经纶,陈忠纯,等.18种珍稀美味食用菌栽培[MJ].北京:中国农业出版社,1998:1-115.
[2]ChangSTand Miles,Mushroombiology-a newdiscipline[J].The Mycologist,1992(6):64-65.
[3]MoH,Winter HC,Goldstein,Purification and characterization ofa Neu5Acalpha2-6Gallbetal1-4Glc/GlcNAc lectin fromthe fruitingbodyofthe polypore mushroomPolyporus squamosus[J].BioChem2000,275(14):10623-9.
[4]Kochibe N,and Matta KL,Purification and prosperities ofan N-acetylglucosamine-specific lectin fromPsathyrella Velutina mushroom[J].Journal ofBiological Chemistry,1989,264:173-177.
[5]KinoK,Yamashita Aand Yamaoka et al.Isolation and characterization ofa newimmunomodulatoryprotein,Lingzhi-8(LZ-8),from Ganoderma lucidum[J].Journal ofBiological Chemistry,1989;264:472.
[6]刘祖同,罗信昌.食用蕈菌生物技术及应用[M].北京:清华大学出版社,2002:166.
[7]徐锦堂.中国药用真菌学[M].北京:北京医科大学,中国协和医科大学联合出版社,1997:496-516.
[8]HoiK,Ogate T,Kamiga H,et al.Lectin-like compounds and lectin receptors in marine microalgae:hemagglutination and reactivity with purified lectins[J].Phycal,1996,32:819-825.
[9]于敏,王志德,董志芳.植物凝集素PHA的提取及血凝效果研究[J].安徽技术师范学院学报,2002,16(1):23-25.
Physiologic Function Tests on the Extraction of Lectin from Liquid Fermentation Ganoderma
ZHANGChun-yu1,2,SONGKai3,LIULi-hong1,SHAOJia-jia1,LUJia-fu1
(1.School ofFood Production Technologyand Biotechnology,Changchun Vocational Institute ofTechnology, Changchun 130033,China;2.School ofLife Sciences,Northeast Normal University,Changchun 130024,China; 3.School ofLife Sciences,Changchun Normal University,Changchun 130032,China)
This paper studies the deep fermentation process of the Ganoderma mycelium preliminarily.Test results showthat after 5 days of cultivation in soybean agar,the Ganoderma mycelium’s total protein and total sugar content is higher,and the lectin ofGanoderma isolated and purified fromfermentation liquid has obvious biological activity.
Ganoderma;liquid fermentation;lectin
O625
A
1008-178X(2012)09-0069-05
2012-06-15
吉林省教育厅项目(2010第480号)。
张春玉(1972-),女,吉林长春人,长春职业技术学院食品与生物技术分院副教授,博士,从事生物化学与分子生物学研究。
