电导法测定乙酸乙酯皂化反应级数
2012-09-25张虎成裴渊超赵扬
张虎成 裴渊超 赵扬
(河南师范大学化学与环境科学学院化学实验教学中心 河南新乡 453007)
乙酸乙酯皂化反应动力学参数的测定是化学专业的一个经典的反应动力学实验。因此,有关该反应的实验装置改进[1]、化学测定法[2]、电导测定法[3]、pH测定法[4]以及数据处理方法[5]等已有许多报道。然而,所有这些教学研究工作都是关于如何更准确、更简便地测定反应速率常数和活化能。近年来,随着教学改革的不断深入,迫切需要在化学实验教学中实现培养学生设计实验和创新能力的教学理念。为此,本实验项目设想在未知乙酸乙酯皂化反应级数的前提下,让学生自行灵活地应用化学动力学原理去设计反应级数的测定方法,并通过正确的实验步骤获得合理的结果。教学实践表明:该实验有利于提高学生测定化学反应动力学参数的技能和综合设计实验的能力。
1 实验原理
设反应初始时,水溶液中乙酸乙酯的浓度(cA,0)大于或等于NaOH的浓度(cB,0),则皂化反应进程中各反应物和产物的浓度关系为:
已知该反应的速率方程为:
(1)
其中,ct表示经过时间t后消耗的反应物浓度,k表示反应速率常数,α和β分别表示反应物乙酸乙酯和NaOH的分级数。
对于任一强电解质稀溶液,可近似认为其电导与电解质的浓度成正比,因此,反应进程中任一时刻的电导就是组成反应混合物的各个电解质电导之和。若令G0、Gt和G∞分别表示反应初始时、反应时间t时和反应终态时反应体系的电导,则在该反应条件下,显然G0是浓度为cB,0的NaOH溶液的电导,G∞是浓度为cB,0的CH3COONa溶液的电导,Gt是浓度为(cB,0-ct)的NaOH溶液与浓度为ct的CH3COONa溶液的电导之和[6],因而:
(2)
整理式(2)可得:
(3)
由此可见,若测得Gt,利用上式可计算得到反应体系在任一时刻的ct。若跟踪测定Gt随t变化的数据,即可获得参加反应的物质浓度随时间的变化曲线。据此,可采用不同的数据处理方法(如:积分法、微分法、半衰期法、改变反应物数量比例方法等)得到反应级数,并建立该反应的速率方程。
2 结果与讨论
本工作使用了数字电导率仪(上海大蒲,DDS-12A),采用常规的电导实验方法[6]和改变反应物数量比例方法,报道了在35℃下的稀溶液中乙酸乙酯皂化反应级数的测量结果。图1表示在不同反应物浓度下ct与t之间的关系曲线,由反应起始时曲线的斜率可确定皂化反应的初始速率(dct/dt)0(见表1中实验1~3)。
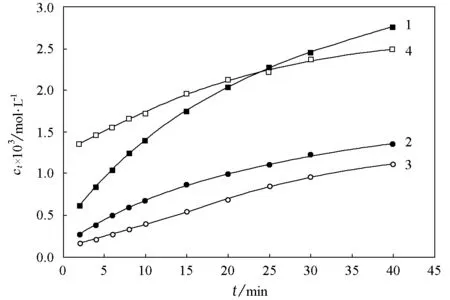
图1 35℃下乙酸乙酯皂化反应的ct-t变化曲线曲线上的数字为实验编号

实验编号cA,0/mol·L-1cB,0/mol·L-1G0/mSG∞/mS(dct/dt)0×103/mol·L-1·min-110.0100.0101.5200.7710.110820.0100.0050.7580.3870.056630.0050.0050.7580.3870.028940.0050.0101.5201.1450.0489
依据方程式(1)得:
(4)
将表1中相应的实验数据代入式(4),解得α=β=0.97≈1,因此乙酸乙酯皂化反应为2级反应。
在上述实验1~3中,总是设计cA,0≥cB,0,因此当t=∞时,可认为NaOH完全反应,G∞可通过直接测定浓度为cB,0的CH3COONa水溶液的电导获得。然而,当cA,0 (5) (6) 在图1和表1中,实验4表示的是在cA,0 (7) 由式(7)可解得α=1.2,β=0.76。与cA,0≥cB,0的条件下所测反应级数相比较,当cA,0 另外,在常用的反应级数测定方法中,实验也表明准级数近似处理法不适用于测定乙酸乙酯皂化反应的级数,这一方面是由于当cB,0≫cA,0时,反应进程中电导或pH随时间变化不明显;另一方面是由于乙酸乙酯在水中的溶解度较小,也造成在cA,0≫cB,0时很难准确测定反应的初始速率。 由上述讨论可见,依据化学动力学的原理和方法,可在cA,0≥cB,0条件下的稀溶液中准确测定乙酸乙酯皂化反应的级数,学生实验证明:α=β=1±0.05;即使当cA,0 [1] 罗觉生,赖璐,段明峰.大学化学,2005,20(5):33 [2] 冯安春.化学通报,1983(9):36 [3] 易回阳,陆江林,黄玲.湖北师范学院学报(自然科学版),2001,21(4):56 [4] 邵水源,刘向荣,庞利霞,等.西安科技学院学报,2004,24(2):196 [5] 况黎,吴玲.大学化学,2004,19(4):39 [6] 常照荣,张虎成.物理化学实验.郑州:河南科技出版社,20093 结论
