关于化学平衡移动的商榷
2012-09-25靳福全
靳福全
(太原工业学院化学与化工系 山西太原 030008)
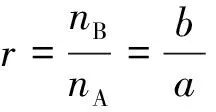
1 化学反应平衡移动一般性讨论[2-3]

由定义:

将上式两边对nj求偏导,得:
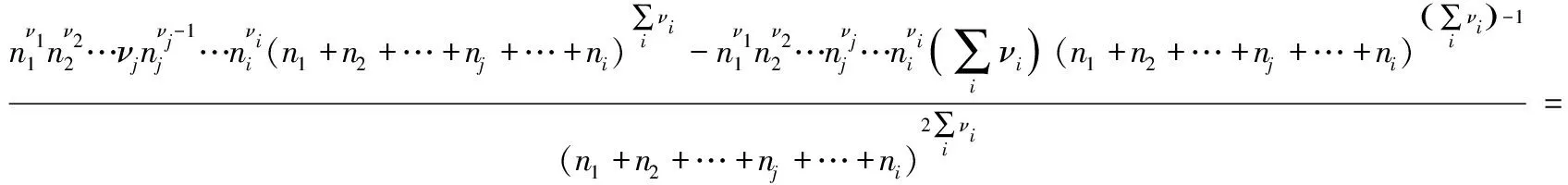
两边同除以Qy,整理得:
(1)
式(1)是任意指定状态时,Qy随nj变化的一般规律。现将其应用于化学平衡时的Qy(平衡时Qy=Ky)随nj的变化,即可导出处于化学平衡的系统反应组分j的物质的量nj发生变化时的平衡移动规律。具体分析如下:

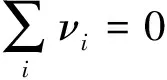


针对教材中的解释,结合上面推出的结论分析,只有反应物的系数之和大于产物的系数之和且某种反应物的平衡时的物质的量分数大于该反应物的化学计量数与化学计量数代数和的商时,增加该种反应物的物质的量才会导致向反应物方向的反常移动;否则,都将导致向产物方向的正常移动。这说明增加某种反应物的物质的量引起反常的平衡移动是有条件的,一定要按照判断条件进行分析,不能简单地认为增加反应物的量,产物平衡时的物质的量分数减小了,就是平衡左移了。
2 投料比等于系数比的化学反应平衡移动[4]
对于一般理想气体反应,有:
aA(g)+bB(g)+…=yY(g)+zZ(g)+…
若a+b+…≤y+z+…,增加反应物物质的量,平衡为正常的向右移动;若a+b+…>y+z+…,可以证明,增加反应物物质的量,平衡仍为正常的向右移动,而不是反常的向左移动。
证明如下:
aA(g) +bB(g) + … =yY(g) +zZ(g) + …
开始时ab… 0 0 … mol
平衡时a-axb-bx…yxzx… mol
平衡时的物质的量分数为:
因为
又因为
这就说明,在恒温恒压下,对于投料比等于系数比的任何理想气体反应,当反应达平衡时,增加任一反应物的物质的量都将导致正常的平衡移动,不会导致反常的平衡移动。显然,引文部分第2句至第4句的描述是错误的。需要强调的是,不要混淆了浓度和物质的量变化对平衡移动影响的区别。平衡移动原理要求用浓度变化进行判断,改变某反应组分的浓度,平衡总是向着削弱这种改变的方向移动,该原理是普遍适用的,不会有例外。如果用物质的量变化判断平衡移动,在恒温恒压下就可能会出现反常的平衡移动。考虑到全国很多高校使用该教材,影响面大,因此撰写此文以引起使用该教材的教师和学生的注意,并希望教材再版时能给以纠正。
参 考 文 献
[1] 刘俊吉,周亚平,李松林.物理化学(上册).第5版.北京:高等教育出版社,2009
[2] Levine I N.物理化学(上册).褚德萤,李芝芬,张玉芬译.北京:北京大学出版社,1987
[3] 登比 K G.化学平衡原理.第4版.戴冈夫,谭曾振,韩德刚译.北京:化学工业出版社,1985
[4] 王颖霞.大学化学,2009,24(5):75
