五味子提取物对肥育猪抗氧化功能及肉质的影响
2012-09-22李建平单安山
李建平 单安山
(东北农业大学动物营养研究所,黑龙江哈尔滨 150030)
高集约化饲养条件以及抗生素、化学合成药物的长期饲用导致畜产品的安全及质量下降。我国同许多国家已经开始致力于研究和开发无公害的抗生素等化学性饲料添加剂的替代品。五味子(Schisandra chinensis,SC)为天然植物产品,兼有营养与药用两种属性,富含多糖、有机酸、维生素和微量元素。近年来,对SC的研究表明:SC有增强免疫和提高抗氧化机能等作用[1-3]。SC有效成分多存在于其植物细胞壁中,单胃动物无法有效利用。因此本试验在前期研究的基础上,采用超临界萃取工艺提取SC中有效成分。通过研究日粮中添加五味子提取物(SCE)对肥育猪抗氧化功能及肉品品质的影响。
1 试验动物与分组
采用单因素完全随机试验设计,选择平均体重(60.8±1.4)kg的二元杂交(大白×长白)猪48头。购自哈尔滨市鸿福猪场。随机分为2组,每组6个重复,每栏4头猪为一个重复,公母各半。设对照组和五味子提取物(SCE)组。
1.1 日粮组成
五味子购自哈尔滨药材批发市场,产于黑龙江省北部,为野生北五味子干燥成熟果实,粉碎后过40目筛。采用超临界CO2萃取工艺,将五味子原粉中的有效成分提取出来,并利用高效液相色谱测定其有效成分的含量 [五味子甲素,shiandrin A:(3.67±0.19)mg/g;五味子乙素,shiandrin B:(6.80±0.28)mg/g]。对照组饲喂基础日粮,基础日粮中养分含量均达到或超过NRC(1998)标准。试验组日粮添加0.125%SCE。基础日粮组成及营养水平见表1。
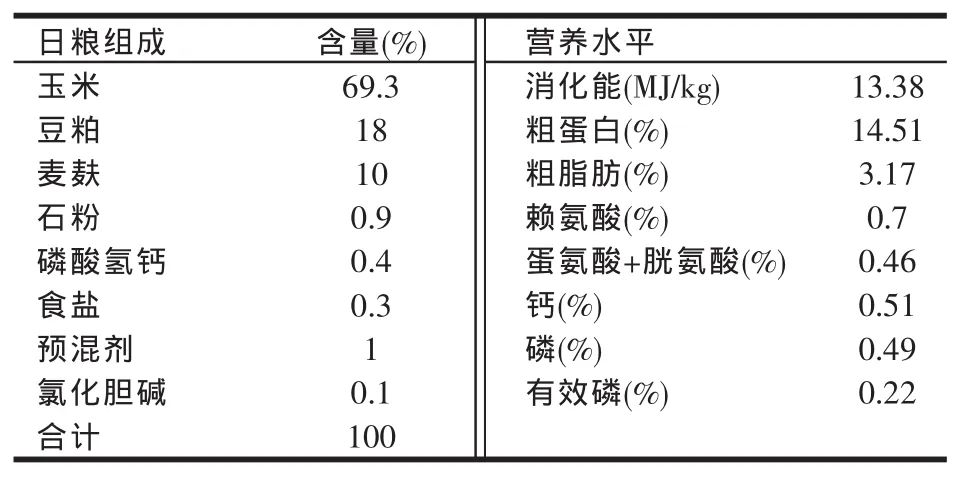
表1 基础日粮组成及营养水平
1.2 饲养管理与样品采集
自由采食、饮水,光照等管理同常规。当试验猪平均体重达到90 kg左右时,随机从试验组和对照组中的每个重复中选取体重平均的2头猪 (公母各半),共24头进行前腔静脉采血,分离血清,-20℃保存待测,试验猪采血后屠宰(电击致晕,然后放血),取少量心、肝、脾、肾和肌肉组织,在4℃生理盐水中洗去血液等杂质,用滤纸吸干,研磨,以生理盐水稀释成10%或1%组织匀浆,-30℃保存待测。
1.3 测定指标
1.3.1 血清及组织中SOD、GR活性及T-AOC、MDA含量的测定
血清和组织匀浆中超氧化物歧化酶(SOD)活性测定采用黄嘌呤氧化物酶法,谷胱甘肽还原酶(GR)活性采用NADHP法,血清和组织匀浆中总抗氧化能力(T-AOC)测定采用比色法,丙二醛(MDA)含量测定采用硫巴比妥酸法(TBA),组织匀浆蛋白质测定采用考马斯亮蓝法(CBB),测定试剂均采用南京建成生物工程研究所生产的试剂盒,在UV—2401 PCSHIMADZU型紫外分光光度计上进行测定,测定过程完全按试剂盒说明书进行操作。
1.3.2 肌肉组织中MDA含量的测定
将肉样置于4℃冰箱,分别于12、24、48、72和96 h取少量肉样,研磨,用生理盐水稀释成10%组织匀浆,以生理盐水稀释成10%或1%组织匀浆,测定MDA含量。
1.3.3 肉质的测定
将试验猪屠宰后分割胴体,测定45 min和24 h的pH值。冷却24 h后采集肉样(取左侧胴体第10胸椎至第6腰椎处背最长肌),留待测定肌肉品质用。依据Honikel(1987)的方法,计算滴水损失[4];参照陈润生(1995)的方法测定肌肉pH值、大理石纹、嫩度(剪切力)[5]。肉色的测定(提取总色素测定法)采用酸性丙酮萃取法进行[6]。
1.4 数据处理
用SAS软件(1996)进行方差分析和多重比较,试验结果数据以“平均值±标准差”表示。
2 结果与分析
2.1 五味子提取物对肥育猪抗氧化功能的影响 (见表 2、表 3)

表2 五味子提取物对肥育猪血清和组织SOD活性的影响

表3 五味子提取物对肥育猪血清和组织GR活性的影响
由表2可见,日粮中添加SCE显著提高了肥育猪血清SOD活性(P<0.05),极显著提高了肾脏组织中SOD活性(P<0.01)。与对照组相比,SCE组心脏、肝脏、脾脏中SOD活性有升高趋势,但差异不显著(P>0.05)。
由表3可见,日粮中添加SCE显著提高了肥育猪血清、心脏、肝脏中GR活性(P<0.05)。SCE组脾脏和肾脏组织中GR活性与对照组接近(P>0.05)。
由表4可见,日粮中添加SCE显著提高了肥育猪血清和肝脏组织的T-AOC(P<0.05)。SCE组心脏、脾脏和肾脏组织T-AOC与对照组接近(P>0.05)。

表4 五味子提取物对肥育猪血清和组织T-AOC的影响

表5 五味子提取物对肥育猪血清和组织MDA含量的影响
由表5可见,日粮中添加SCE显著降低了肥育猪血清、肝脏和脾脏中MDA含量(P<0.05)。SCE组心脏、肾脏MDA含量与对照组接近(P>0.05)。
2.2 五味子提取物对肥育猪肌肉抗氧化能力的影响(见表 6)

表6 五味子提取物对不同贮存时间肥育猪肌肉MDA含量的影响(nmol/mg prot)
由表6可见,随贮存时间增加各处理肌肉MDA含量呈上升趋势。SCE组肥育猪肌肉在4℃贮存12~96 h内MDA含量低于对照组,其中在12、24和48 h肌肉MDA含量显著低于对照组(P<0.05)。
如表7所示,日粮中添加五味子提取物可提高肌肉SOD、GR活性和T-AOC水平,其中,GR活性显著提高(P<0.05)。

表7 五味子提取物对肥育猪肌肉T-AOC的影响
2.3 五味子提取物对肥育猪肉质的影响(见表8)
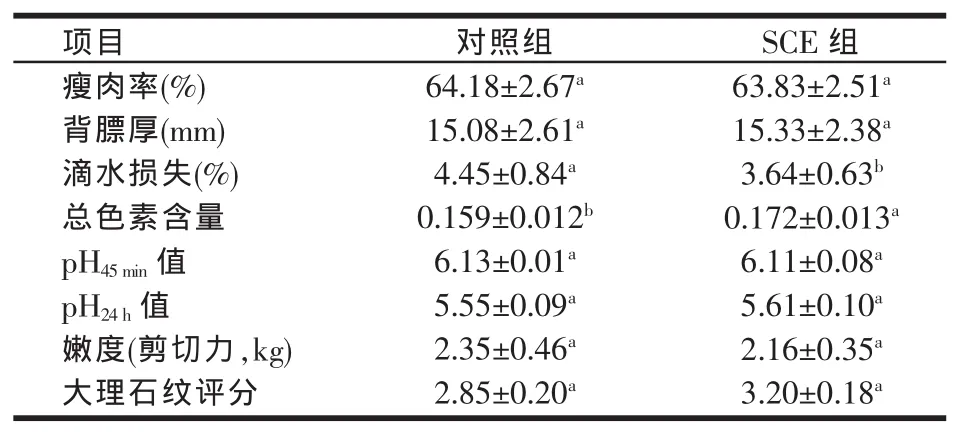
表8 五味子提取物对肥育猪胴体品质及肉质的影响
与对照组相比较,SCE组肥育猪瘦肉率有下降趋势,背膘厚有上升趋势,但差异不显著(P>0.05)。日粮中添加SCE显著降低了肥育猪背最长肌的滴水损失(P<0.05),提高了肌肉中总色素含量(P<0.05)。SCE 组肥育猪背最长肌45 min和24 h的pH值、嫩度和大理石纹评分与对照组相比均无显著差异(P>0.05),其中,大理石纹评分和24 h的pH值有上升趋势(见表8)。
3 讨论
3.1 五味子提取物对肥育猪血清及组织抗氧化能力的影响
由自由基引发的脂质氧化通常与人或其它动物的病理状况有关[7]。细胞拥有多级抗氧化的防御体系,包括清除自由基的酶类和自由基清除剂,如SOD、GR、生育酚、抗坏血酸等。SOD可以催化过氧化物转化为过氧化氢,GR可催化氧化型谷胱甘肽还原成还原型谷胱甘肽。这两种酶是细胞内重要的防止脂质氧化的酶。脂质过氧化物为多不饱和脂肪酸经酶促反应或非酶途径生成的一类过氧化物,其主要成分为MDA,MDA又可氧化细胞膜中的多不饱和脂肪酸,破坏细胞膜的完整性,导致细胞膜的严重损伤。因此,MDA为衡量机体总体抗氧化水平的重要指标。关于SC的抗氧化作用,国内外已进行了广泛的研究。五味子是木脂素类化合物,含有较多的酚羟基。一般认为含酚羟基的化合物有还原性,故可作为自由基清除剂[8]。Ip等(1996)研究表明,五味子多糖对受甲萘醌诱导的小鼠肝脏氧化损伤也有明显的抑制作用,降低其肝脏70%的MDA水平[9]。Zhu等(2000)报道,五味子对CCl4损伤的肝脏第一阶段氧化代谢有很强的保护效应[2]。汤臣康等(1994)试验表明,用五味子饲喂老年大鼠后,分别提高其红细胞SOD和GSH-Px的活性达8.42%和59.26%[10]。李莉等(1997)进行体内高氧分压应激损伤小鼠试验表明,可逆转脾淋巴细胞SOD活性代偿性增高,并提高脾淋巴细胞内GSH含量,结果提示五味子酚对氧自由基损伤脾淋巴细胞有保护作用[11]。刘忠民等(1996)认为,五味子提取液可提高机体清除自由基的能力,对脂质过氧化物损伤有明显的抑制作用[12]。
本试验结果表明,日粮中添加SCE能显著降低肥育猪血清、肝脏和脾脏的MDA含量,提高血清或组织中SOD和GR活性及T-AOC水平。说明可通过直接参与清除体内超氧阴离子自由基和过氧化氢自由基作用或间接通过提高血清、组织抗氧化酶活性,降低血清或组织中MDA含量,发挥抗氧化作用。有关其作用机理还有待进一步深入研究,这与前人报道的结果一致[13-15]。
3.2 五味子提取物对肥育猪肉质的影响
多不饱和脂肪酸(PUFA)是非常重要的细胞膜的组成成分,对氧自由基的攻击十分敏感。受到自由基攻击后,细胞膜的完整性被破坏,胞浆液穿过胞膜流失。无法控制的细胞膜多不饱和脂肪酸的损伤以及氧化损伤产物的积聚会导致细胞和器官功能的破坏[16]。猪在运输期间和屠宰前发生应激,会影响肉质。面对国际猪肉市场的日趋激烈的竞争,猪肉品质已经变得愈加重要。肉色和持水力差是猪肉市场各个环节中都非常关注的主要品质问题[17]。许多研究表明,在猪的日粮中添加如:维生素E、硒等抗氧化剂可通过提高其抗氧化功能保护细胞膜免受自由基损伤以减少由此产生的流体损失和稳定肉色,提高猪肉的氧化稳定性,降低滴水损失[18-22],从而达到改善肉质的效果。Munoz等(1996)报道,在猪的日粮中添加有机硒和其它抗氧化剂,可以显著降低背最长肌的滴水损失,而且屠宰后成熟的时间越长,滴水损失越高,添加抗氧化剂的效果更明显[23]。
本试验结果表明,五味子提取物可显著降低肥育猪背最长肌的滴水损失,提高肌肉中总色素含量,45 min和24 h的pH值、嫩度和大理石评分均有不同程度的改善。日粮中添加SCE提高了肌肉中GR活性,在48 h内显著降低4℃贮存肌肉的MDA含量。说明五味子提取物可通过提高肥育猪机体的抗氧化能力降低滴水损失,提高肌肉中总色素含量,与前人报道结果一致[22,24-25]。对其它肉质指标影响不大,可能是由于所需的五味子提取物的添加时间更长或添加量更高才能达到理想的效果,具体原因尚待进一步研究。
4 小结
在本次试验条件下,日粮中添加五味子CO2超临界提取物可通过显著提高组织或血清的抗氧化酶活性,降低脂质过氧化物含量,从而提高肥育猪机体抗氧化功能,改善部分肉品品质。但从目前应用情况看,其作用机理、最佳添加时间及剂量还需要进一步研究。
[1]Pan S Y,Han Y F,Carlier P R.Schisandrin B protects against tacrine and bis(7)-tacrine-induced hepatotoxicity and enhances cognitive function in mice[J].Planta Med.,2002,68(3):217-220.
[2]Zhu M,Lin K F,Yeung R Y.Improvement of phase I drug metabolism with Schisandra chinensis against CCl4hepatotoxicity in a rat model[J].Planta Medicine,2000,66(6):521-525.
[3]丁小凤.五味子粗多糖的初步药理研究[J].白求恩医科大学学报,1995,21(2):147-149.
[4]Honikel K O.How to measure the water holding capacity of meat?Recommendation of Standardized methods in evaluation and control of meat quality in pigs[M].Netherlands:Martinus Nijhoff Publisher,1987:129-142.
[5]陈润生.猪生产学[M].北京:中国农业出版社,1995:165-169.
[6]陈明造.肉品加工理论与应用[M].台北:艺轩图书出版社,1983:454-455.
[7]Halliwell B,Gutteridge J M C.Free radicals aging and disease.In Free Radical in Biology and Medicine[M].Clarendon Press:Oxford U.K.,1989:416-508.
[8]Fridovich I.The biology of oxygen radicals.The superoxide radical is anagentofoxygentoxity;SODprovideanimportant[J].Sci.,1978,201:875.
[9]Ip S P,Mak D H,Li P C.Effect of a ligan enriched extract of Schisandra chinensis on aflatoxin B1 and cadmium chloride-indued hepatotosicity in rats[J].Pharmacol Toxdcol,1996,78(6):413-416.
[10]汤臣康.五味子的化学和药理研究的新进展[J].西北药学杂志,1994,9(6):278-279.
[11]李莉,吴若.五味子酚对氧自由基损伤小鼠脾淋巴细胞的保护作用[J].药学学报,1997,32(3):178-182.
[12]刘忠民,陈练,董加喜,等.兔脑缺氧—复氧性损伤与五味子提取液的保护作用[J].中草药,1996,27(6):355-357
[13]Deying Ma,Anshan Shan,Zhihui Chen,et al.Effect of Ligustrum lucidum and Schisandra chinensison the egg production,antioxidant status and immunity of laying hens during heat stress[J].Archives of Animal Nutrition,2005,59(6):439-447.
[14]Deying Ma,Qundao Li,Juan Du,et al.Influence of mannan oligosaccharide,Ligustrum lucidum and Schisandra chinensis on parameters of antioxidative and immunological status of broilers[J].Archives of Animal Nutrition.2006,60(6):467-476.
[15]李建平,单安山,程宝晶.五味子、柠檬酸对生长肥育猪抗氧化功能和肉品质的影响[J].中国畜牧杂志,2010,46(15):31-34.
[16]Chan H W S.The mechanism of autoxidation.Chan H.W.S.eds.Autoxidation of Unsatura-ted Lipids[M].Academic Press London,UK.1987:1-16.
[17]Cannon J E,Morgan J B,Heavner J,et al.pork quality audit:A review of the factors influencing pork quality[J].Muscle Foods,1995,6:369-402.
[18]Asghar A,C.F.Fin,J.I.Gray,et al.Influence of supranutritional vitamin E supplementation in the feed on swine growth performance and deposition in different tissues[J].J.Sci.Food Agric.,1991,57:19-29.
[19]Buckley D J,Morrissey P A,Gray J I.Influence of dietary vitamin E on the oxidative stability and quality of pigmeat[J].J.Anim.Sci.,1995,73:3122-3130.
[20]Lauridsen C,J.H.Nielsen,P.Henckel,et al.Antioxidative and oxidative status in muscles of pigs fed rapeseed oil,vitamin E and copper[J].J.Anim.Sci.,1999,77:105-115.
[21]Rudolf Lahucky,Ivan Bahelka,Ulrich Kuechenmeister,et al.Effects of dietary supplementation of vitamins D3and E on quality characteristics of pigs and longissimusmuscleantioxidative capacity[J].Meat Science,2007,77(2):264-268.
[22]Rudolf Lahucky,Karin Nuernberg,Lubomir Kovac.et al.Assessment of the antioxidant potential of selected plant extracts In vitro and in vivo experiments on pork[J].Meat Science,2010,85(4):779-784.
[23]Munoz A,Garrido M D,Granados M V.Effect of selenium yeast and vitamins E and C on pork meat exudation and natural antioxidants on consumer satisfaction and pork meat quality[C].Presented at the 12th Animal symposium on Biotechnology in the feed industry,Lexington,K.Y,1996:80-82.
[24]Monahan F J,Buckley D J,Gray J I,et al.Influence of diet on lipid oxidation and membrane structure in porcinemuscle microsomes[J].Agric.Food Chem.,1994(42):59-63.
[25]Seko Y,Saito Y,Kitahara J,et al.Active oxygen generation by the reaction of selenite with reduced glutathione in vitro[M].In:Wendel A.ed.Selenium in Biology and medicine.Springer-Verlag,Berlin,1989:70-73.
