柠檬酸对小鼠睾丸组织抗氧化酶活性的影响
2012-09-21张鹏飞吕琼霞刘玉梅陈晓光王艳杰
张鹏飞,吕琼霞,刘玉梅,邓 雯,陈晓光,王艳杰
(河南科技大学动物科技学院,河南洛阳471003)
柠檬酸(citric acid,CA)属于天然的有机酸,作为酸化剂能降低饲料酸碱度,提高饲料的适口性,并能提高机体消化酶活性[1],因其具有抗菌和抑菌作用,可以调节畜体肠道有益菌群的平衡,具有促进动物机体生长的作用[2];作为抗氧化辅剂能够防止饲料营养物质的氧化而用于饲料的储存[3]。此外,柠檬酸作为三羧酸循环中重要的中间产物,连接着糖酵解和三羧酸循环,对糖和脂肪代谢有极为重要的作用,通过线粒体中的氧化为机体提供足够的能量。
需氧生物在氧化还原过程中往往产生大量的超氧阴离子自由基、羟自由基、过氧化氢等活性氧。少量的自由基是生物体所必需的,作为第2信使,对信号的传导起重要作用,并影响基因的表达。但过多的自由基如果不能被及时消除,将会攻击各种生物大分子,引起DNA损伤、酶失活、脂质过氧化等一系列氧化损伤,进而引起生物体的各种生理病变[4]。已有的研究表明,柠檬酸能够引起大鼠肾脏功能损害,血清肌酐和尿素氮显著或极显著增加[5];使鸡和小鼠的肝脏损伤,导致肝脏细胞质空泡变性、细胞核膜内陷和肝细胞坏死,血清乳酸脱氢酶、丙氨酸转氨酶和谷草转氨酶等升高[6-7];长时间给家兔饲喂添加柠檬酸(约5%)日粮,会使睾丸管周会产生少量纤维化,间质轻微玻璃样变性[8]。另有研究显示,柠檬酸能够引起小鼠肝脏组织的总过氧化物歧化酶(to-tal superoxide dismutase,T-SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性显著降低,造成肝脏氧化应激[9]。尽管睾丸组织对机体内的氧化自由基更为敏感,但由于睾丸组织及精液中柠檬酸的含量较其他组织高出许多,因此,外源性柠檬酸的过多摄入是否会引起睾丸组织的氧化应激,未见相关报道。本研究采用腹腔注射染毒,通过测定小鼠睾丸组织SOD、GSH-Px、乳酸脱氢酶(lactate dehydrogenase,LDH)、总一氧化氮合酶(total nitric oxide synthase,T-NOS)活性及丙二醛(malondialdehyde,MDA)含量,探讨柠檬酸是否会引起睾丸的氧化应激。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性昆明系小鼠40只,体重(20±2)g,购自郑州大学医学院。
1.1.2 主要试剂 柠檬酸,分析纯,天津市化学试剂厂;SOD、GSH-Px、LDH、T-NOS、MDA检测试剂盒,均购自北京鼎国昌盛生物技术有限公司;考马斯亮蓝蛋白测定试剂盒,购于南京建成生物工程研究所。
1.2 方法
1.2.1 实验动物分组与处理 小鼠适应饲养1周后,随机分为4组,每组10只,即对照组(生理盐水)和柠 檬 酸 低 (180mg/kg)、中 (270mg/kg)、高(360mg/kg)剂量组。分别经腹腔注射途径给予相应处理,每只0.2mL,每周1次,连续注射3周,第3次注射后的第7天,将受试小鼠颈椎脱臼处死,取其睾丸并剔除脂肪等多余组织,制备10%的匀浆液,离心后取上清液备用。饲养期间小鼠自由采食和饮水,隔天更换小鼠垫料,且每天保持饲养室通风透气。
1.2.2 小鼠睾丸组织SOD、GSH-Px、LDH、NOS活性和MDA含量的测定 取制备好的质量分数为100g/L的小鼠睾丸组织匀浆液,按试剂盒说明,分别采用黄嘌呤氧化酶法、DTNB法、丙酮酸-二硝基苯腙法、精氨酸法、TBA法分别测定匀浆中SOD、GSH-Px、LDH、NOS的活性和MDA的含量。
1.2.3 数据的处理 试验结果用“平均数±标准差”表示,并应用SPSS 11.5进行单因素方差分析。组间差异显著性采用LSD检验法,P<0.05为差异显著。
2 结果
2.1 柠檬酸对小鼠睾丸组织SOD活性的影响
小鼠睾丸组织SOD活性检测结果见表1。

表1 柠檬酸对小鼠睾丸组织SOD活性的影响Table 1 Effects of CA on testicular SOD activities in mice
由表1可见,随着柠檬酸浓度的升高,小鼠睾丸组织SOD活性呈下降趋势。与对照组相比,柠檬酸中、高剂量组小鼠睾丸组织的SOD活性显著降低(P<0.05);且柠檬酸低与高剂量组间呈现显著差异(P<0.05)。
2.2 柠檬酸对小鼠睾丸组织GSH-Px活性的影响
由表2可知,柠檬酸低、中、高剂量组小鼠睾丸组织的 GSH-Px活性均显著低于对照组(P<0.05),柠檬酸各处理组间GSH-Px活性无统计学上的差异(P>0.05)。

表2 柠檬酸对小鼠睾丸组织GSH-PX活性影响Table 2 Effects of CA on testicular GSH-PX in male mouse
2.3 柠檬酸对小鼠睾丸组织T-NOS活性的影响
小鼠睾丸组织T-NOS活性检测结果见表3。

表3 柠檬酸对小鼠睾丸组织T-NOS活性影响Table 3 Effects of CA on testicular T-NOS activities in mice
由表3可知,与对照组相比,不同浓度柠檬酸处理后,小鼠睾丸组织T-NOS活性均无显著变化(P>0.05),但随着柠檬酸浓度的升高,T-NOS活性呈现上升趋势,与对照组相比分别增加2.1%、5.5%和18.3%。
2.4 柠檬酸对小鼠睾丸组织MDA含量的影响
由表4可知,与对照组相比,柠檬酸各处理组小鼠睾丸组织MDA含量均显著降低(P<0.05);随着柠檬酸浓度的升高,MDA含量呈下降趋势,柠檬酸高剂量组MDA含量显著低于柠檬酸低、中剂量组(P<0.05)。说明细胞膜的脂质过氧化随柠檬酸浓度的升高而降低。
2.5 柠檬酸对小鼠睾丸组织LDH活性的影响
由表5可知,与对照组相比,不同浓度柠檬酸处理后,小鼠睾丸组织LDH活性均无显著变化(P>0.05),但随着柠檬酸浓度的升高,LDH 活性呈现下降趋势,分别比对照组降低8%、8.6%和10.4%。
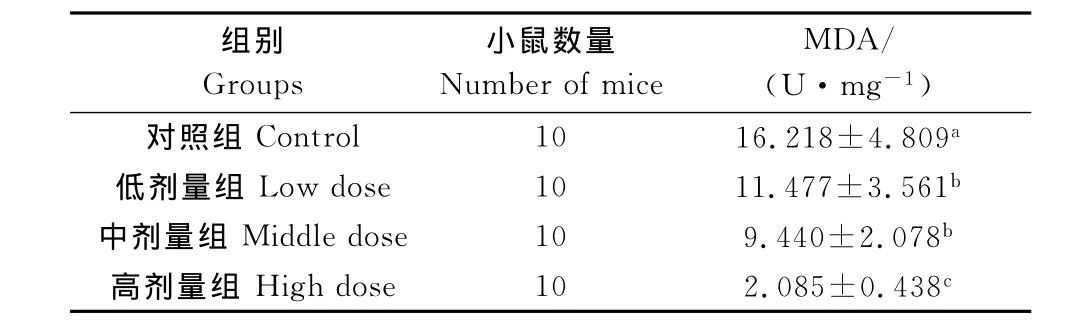
表4 柠檬酸对小鼠睾丸组织MDA含量影响Table 4 Effects of CA on testicular MDA activities in mice
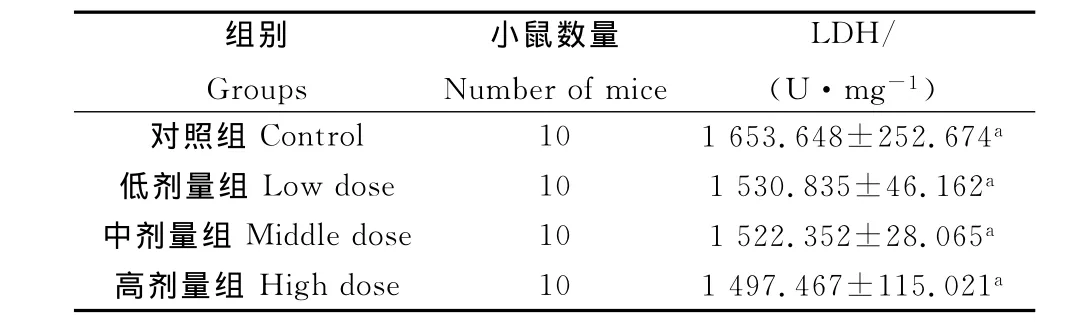
表5 柠檬酸对小鼠睾丸组织LDH活性影响Table 5 Effects of CA on testicular LDH activities in mice
3 讨论
机体通过酶系统与非酶系统产生自由基,攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,并形成脂质过氧化物。氧自由基不但通过生物膜中的多不饱和脂肪酸的过氧化引起细胞损伤,而且还能通过脂氢过氧化物的分解产物引起细胞损伤,造成MDA等脂质过氧化物的堆积。因此,组织中MDA的量常用来反映机体内细胞膜脂质过氧化的程度,间接反映出细胞损伤的程度。SOD是一种机体防御氧化损伤的酶,通过清除机体氧化反应产生的O2-阻断脂质过氧化作用,解除超氧阴离子对生物体细胞的损伤,起到保护细胞膜的作用。GSH-Px对防止体内自由基引起膜脂质过氧化特别重要,对氢过氧化物具有相对的专一性,能够催化过氧化氢(H2O2)与GSH反应生成水及氧化型谷光甘肽,使有毒的过氧化物还原成无毒的羟基化合物,从而保护细胞膜的结构及功能免受过氧化物的干扰及过氧化损害。机体内的GSHPx、SOD受外界刺激或细胞老化的影响,其含量会大幅降低,进而导致器官功能衰退。在自由基堆积时,血液的GSH、SOD等酶的活性下降或其作用的还原性底物含量减少。
李成文等[10]通过草酸对大鼠肾小管上皮细胞脂质过氧化损伤的研究表明,草酸对体外培养的Wistar大鼠肾小管上皮细胞可造成脂质过氧化损伤,而外源性柠檬酸具有减轻这种脂质过氧化损伤的作用,本研究的结果与此基本一致。研究结果显示,随柠檬酸剂量的增加,小鼠睾丸组织内的MDA含量显著降低。但本研究中MDA含量降低的结果仅能说明柠檬酸能够降低睾丸组织细胞的脂质过氧化,但并不代表睾丸细胞总体抗氧化能力的增强。因为,研究结果同时显示SOD、GSH-Px活性显著降低。这种结果表明,柠檬酸处理后睾丸组织由SOD途径清除自由基O2-能力的降低;由GSH的还原作用呈现的对抗膜脂质过氧化能力也减弱。即柠檬酸对SOD、GSH-Px抗氧化酶系统的抗氧化作用呈现抑制效应。张自强等[9]在研究柠檬酸对小鼠肝脏的氧化应激时也有类似的结果。值得关注的是,本研究中小鼠睾丸组织T-NOS活性随着柠檬酸剂量的增加呈上升趋势,据此推测睾丸组织内脂质过氧化物MDA含量的降低,不是经SOD、GSH-Px抗氧化酶系统途径完成,而可能是通过NO途径实现的。NOS是合成NO的限速酶,NO可以影响多种细胞的功能,在生理剂量下通过NO-cGMP途径发挥生理学效应,尤其是能够舒张组织血管,改善血液局部微循环。而在病理状态下,各种刺激因子导致诱导型一氧化氮合酶的过度表达,生成大量NO,在引起非特异性免疫作用的同时,对周围环境中的正常细胞也产生毒性效应[12]。研究显示,大量NO产生可引起肾组织损伤[13];但在急性肝脏病变时,局部升高的NO可避免氧自由基损害肝细胞,有助于肝脏渡过应激期,对肝细胞起保护作用[14-15];在脂肪肝模型中,NO能够改善肝脏的微循环,减少HbO2和细胞色素C氧化酶的含量,增加脂肪肝胆固醇的氧化,降低肝脏细胞损伤[16]。1995年,Rosseli M等[17]首次证实,硝普钠分解产物NO使精子活力下降,NO的灭活剂血红蛋白则抑制该种效应。较低剂量下,NO促进精子运动的机制目前仍不清楚。Hellstom W J等[18]认为,NO对氧自由基的捕捉使精子脂膜脂质过氧化水平下降,本研究与Hellstom W J持相同的观点。但亦有人认为可能与NO存在的氧化还原状态有关,因其状态不同,可以对细胞起破坏或保护作用。田溪泉等研究了NO对精子运动功能的影响,揭示NO对精子功能调节具有剂量依赖效应。NO对精子存在两种效应,一是NO通过NO-cGMP途径对精子功能的调节,可以显著提高精子的功能,对精子起保护作用;另外,NO与呼吸链代谢生成的超氧离子反应生成剧毒的过氧化亚硝酸根离子(ONOO-),其对精子产生毒害作用导致精子运动能力下降。本研究中,NOS活性随柠檬酸浓度增加呈上升趋势的结果说明,睾丸组织内的NO生成量当呈增加趋势,结合睾丸组织中MDA含量降低的变化,可以推测NO在本研究中主要表现抗氧化保护作用。这种保护作用除了通过NO对氧自由基的捕捉使精子脂膜脂质过氧化水平下降外,还有可能通过增加睾丸的血液供应,及时输出睾丸组织的毒性物质,从而降低对睾丸组织细胞的损伤。
正常情况下,组织细胞内LDH活性较高,而血清中的活性较小,较高的LDH活性,可以加速乳酸转变为丙酮酸,减少组织中乳酸的积累,降低乳酸对机体的损害。而当组织发生病变时,就会大量进入血液,使血清中LDH活性升高,组织中的活性降低。本研究发现,随着柠檬酸浓度的升高,小鼠睾丸组织LDH活性呈现下降趋势,预示随柠檬酸剂量增大,睾丸细胞膜的通透性可能会增加,使细胞膜的稳定性受到一定影响。
[1] 潘 庆,谭永刚,毕英佐.柠檬酸对罗非鱼生长、体成分和消化酶活性的影响[J].中国水产科学,2004,11(4):344-348.
[2] 程广凤,骆仲明,钱海兵.日粮中添加柠檬酸对雏鸡生长发育的影响[J].青海畜牧兽医杂志,2005,35(3):11-12.
[3] 胡延春,贾 艳.柠檬酸在仔猪饲料中的应用效果的研究进展[J].辽宁畜牧兽医,1999(4):70-72.
[4] 顾有方,陈会良,刘德义.自由基的生理和病理作用[J].动物医学进展,2005,26(1):94-97.
[5] Abd-Al Gadir M I,Ihaimer M M,Elkhier M K S,et al.Effect of benzoic acid and combination of benzoic with citric acid as food additives on the renal function of experimental rats[J].Asian J Clin Nutr,2009,1(2):83-87.
[6] Akta T,Kabolu A,Ertan F.The effects of citric acid[antioxidant]and benzoic acid[animicrobial agent]on the mouse liver:biochemical and histopatological study[J].Biologia Bratisl,2003,58:343-347.
[7] Aktac T,Kaboglu A,Bakar E,et al.The short-term effects of single toxic dose of citric acid in mice[J].J Cell Mol Biol,2003,2:19-23.
[8] Packman E W,Abbott D D,Harrisson J W E.Comparative subacute toxicity for rabbits of citric,fumaric and tartaric acids[J].Toxicol Appl Pharmacol,1963,5(2):163-167.
[9] 张自强,刘玉梅,邓 雯,等.柠檬酸对小鼠肝脏组织氧化应激的影响[J].西北农业学报,2011,20(4):16-19.
[10] 李成文,孙 光,常 峰.草酸对大鼠肾小管上皮细胞脂质过氧化损伤的实验研究[J].广西医学,2006,28(4):503-505.
[11] 王亚珍,刘 莹.对一氧化氮的作用的新认识[J].江汉大学学报:自然科学版,2006,34(3):37-40.
[12] Snyder S H,Bredt D S.Biological roles of nitric oxide[J].Scientific American,1992,266:28-36.
[13] Maeda S,Miyauchi T,Iemitsu M,et al.Endothel in receptor antagonist reverses decreased NO system in the kidneyin vivo during exercise[J].Am J Physiol Endocrinol Metab,2004,286(4):E609-E614.
[14] Aiba M,Takeyoshi I,Ohwada S,et al.Novel nitric oxide donor(FK409)ameliorates liver damage during extended liver resection with warm ischemia in dogs[J].J Am College Surge,2001,193(3):264-271.
[15] Koti R S,Seifalian A M,McBride A G,et al.The relationship of hepatic tissue oxygenation with nitric oxide metabolism in ischemic preconditioning of the live[J].FASEB J,2002,16(12):1654-1656.
[16] Ijaz S,Yang W Z,Winslet M C,et al.The role of nitric oxide in the modulation of hepatic microcirculation and tissue oxygenation in an experimental model of hepatic steatosis[J].Microvascular research,2005,70(3):129-136.
[17] Rosseli M,Dubey R K,Imthurn B,et al.Effects of nitric oxide on human:evidence that nitric oxide decreases motility and induces sperm toxicity[J].Hum Reprod,1995,10:1786-1790.
[18] Hellstrom W J,Bell M,Wang R,et al.Effect of sodium nitroprusside on sperm motility.viability and lipid peroxidation[J].Ferti Steril,1994,61:1117-1122.
