基于含水层介质中铁的类Fenton技术去除地下水中硝基苯
2012-09-21孙猛董军耿方兰周影王玮瑜董莉莉
孙猛,董军,耿方兰,周影,王玮瑜,董莉莉
(吉林大学 地下水资源与环境教育部重点实验室,吉林 长春,130021)
1 材料与方法
1.1 实验材料和设备
实验用含水层介质为细砂,采自国内某硝基苯污染场地,其性质见表 1。模拟地下水为实验室配置,其性质见表2。实验用浸提剂各种指标见表3。用气相色谱仪分析测定硝基苯的质量浓度[13]。
实验仪器有:ZHWY-2102C恒温培养振荡器;六联磁力搅拌器;GC-2010气相色谱仪(日本岛津公司)。

表1 细砂各项指标Table 1 Indicators of sand

表2 硝基苯污水各项指标Table 2 Indicators of nitrobenzene
1.2 实验方法
1.2.1 含水层介质中铁的浸提
取20 g灭菌细砂和20 mL浸提液于50 mL透明顶空瓶中,氮气顶空后于暗光、转速200 r/min 和10 ℃下恒温振荡器震荡120 h。分别于3,6,12,24,48,72,96和120 h取浸提液,过滤后测Fe2+和Fe3+[14],每种浸提剂做两组平行实验取均值,并且加入空白对照组。
1.2.2 催化氧化过程中羟基自由基的生成规律
羟基自由基的检测是根据柴多里等[15]的研究,亚甲基蓝(MB,蓝色)与羟基自由基发生反应,可生成稳定的羟化亚甲蓝(hydroxyl methyleneblue,HMB,无色),通过可见分光光度计测定MB浓度的变化。
实验方法:在最佳浸提剂作用后,加入一定量H2O2,依照1.2.1的取样时刻,取0.5 mL样品经过滤后稀释至10 mL加入到10 mL含MB溶液与10 mL pH缓冲溶液的混合液中,反应 5 min,然后,以蒸馏水为参比液,在波长 664 nm下测定其吸光度得到 MB浓度cn。实验还需做加入叔丁醇的对照组进行对比。
水产养殖过程中,常常有亲鱼在产后死亡,有的死亡数量甚至超过一半,这给养殖户造成了很大的经济损失,怎样才能减少亲鱼的死亡?现将亲鱼产后护理要点介绍如下:
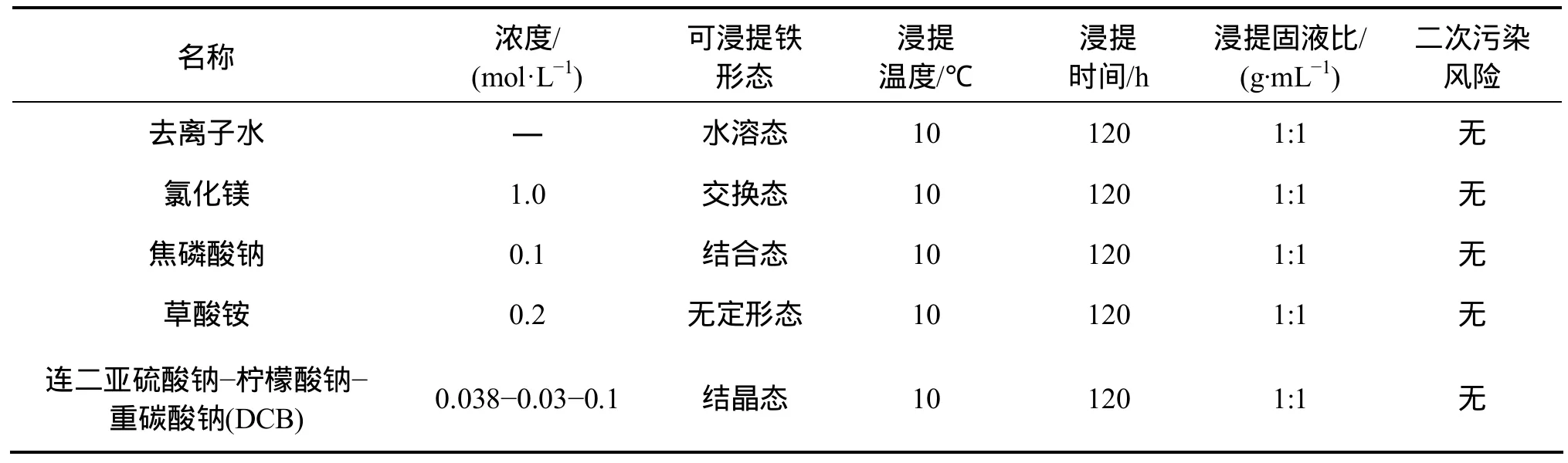
表3 浸提剂各项指标Table 3 Indicators of extraction agent
1.2.3 H2O2催化氧化硝基苯与 H2O2最佳摩尔比的确定
取20 g灭菌细砂和20 mL硝基苯(浓度c0)和最佳浸提剂组成的混合溶液于50 mL透明顶空瓶中,氮气顶空后于暗光、转速200 r/min和10 ℃下恒温振荡器震荡 5 d后,加入不同浓度的 H2O2,设定硝基苯与H2O2摩尔比为1:30,1:60,1:90,1:120,1:200,1:500和不加H2O2的空白对照组。实验分别于10,30,60,90,120和240 min取混合溶液,过滤后测硝基苯浓度cm。
2 结果与分析
2.1 含水层介质中铁的浸提及最佳浸提剂的确定
图1和图2所示分别为含水层介质中Fe3+和Fe2+随浸提时间的变化。从图1和图2可以看出:施用浸提剂使得含水层介质中多种形态的铁释放出来。由图1可见:去离子水、氯化镁、焦磷酸钠和草酸铵分别使得含水层介质中水溶态Fe3+、交换态Fe3+、结合态Fe3+和无定形态 Fe3+从固相中溶解进入浸提液中,浸提120 h后其浸提含量(将单位体积浸提液中铁质量换算为单位质量细砂中铁质量后以表示浸提含量)分别为3.14,3.89,4.86和18.23 mg/kg,浸提效率(浸提含量占 TFe含量百分数)仅为 0.58%,0.70%,0.88%和3.30%。浸提剂DCB对含水层介质中结晶态Fe3+的浸提含量高达347.31 mg/kg,浸提效率为62.92%。说明该细砂中结晶态Fe3+含量大,浸提剂DCB对该种细砂的浸提效率最高。从图1中可看出:48 h后Fe3+的浸出含量达到峰值,之后趋于稳定,说明浸提含水层介质与浸提土壤存在一定的共性,即浸出峰值带有滞后性。
图2所反映的规律与图1的相近,可以看出浸提剂 DCB对细砂中结晶态 Fe2+的浸提含量较高,到达166.51 mg/kg,浸提效率为30.17%,远远大于其他4种浸提剂的浸提含量。不同之处为Fe2+的浸提含量小于Fe3+的浸提含量,并且在3~12 h之间出现了一段平稳期,于24 h达到浸出峰值后趋于稳定。其原因可能是 DCB中的连二亚硫酸钠是一种还原剂,在浸提过程中可以将Fe3+还原为Fe2+,而后被柠檬酸钠络合,进而强化了铁从固相向液相的释放[16]。这一停滞期可能为铁还原阶段,致使大量Fe2+累积,因此,36 h时Fe2+浸出含量到达峰值。
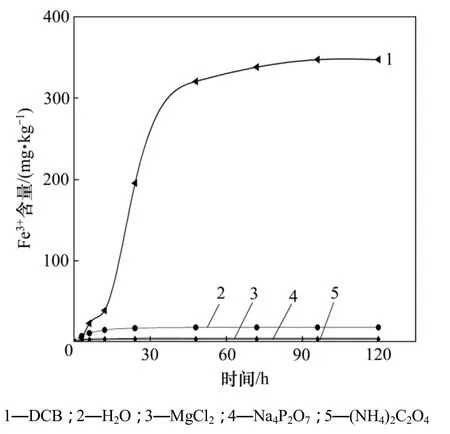
图1 含水层介质中Fe3+随浸提时间的变化Fig.1 Variation of extracting Fe3+ in aquifer materials

图2 含水层介质中Fe2+随浸提时间的变化Fig.2 Variation of extracting Fe2+ in aquifer materials
图3所示为5种浸提剂120 h的浸提含量。从图3可以明显看出:DCB对该细砂中铁的浸提效率最高,远大于其他4种浸提剂的浸提效率。其中DCB浸提出的TFe中Fe3+占67.6%,Fe2+占32.4%。由于DCB的浸提时还存在还原反应,因此,可以推断该细砂中结晶态Fe3+含量较高。
综上所述可以认为,浸提剂 DCB是对该污染场地的含水层介质中铁的最佳浸提剂。

图3 含水层介质中铁浸提总量比较Fig.3 Comparison of extracting TFe with different extraction agents
2.2 催化氧化过程中羟基自由基的生成规律
图4所示为催化氧化反应中羟基自由基含量随时间变化。图4中曲线1为催化氧化反应过程中MB随时间的变化情况,曲线2为加入叔丁醇后MB随时间的变化情况。叔丁醇与羟基自由基的亲和能力最强,它最先与羟基自由基发生反应,使得羟基自由基不能再与MB反应。由图4曲线1可以看出:在30 min时MB溶液浓度远低于其初始浓度,残余率仅为39.64%,由此证明了反应中生成的物质与MB发生了反应,使其浓度降低。将曲线2与曲线1进行对比可见:加入叔丁醇后,MB溶液浓度几乎没有变化,说明催化反应生成了HO·,叔丁醇抑制了HO·与MB的反应。

图4 催化氧化反应中羟基自由基含量随时间变化Fig.4 Variation of hydroxyl radical in catalytic oxidation reaction
由图4中曲线1可见:催化氧化反应为快速反应,0~30 min阶段产生了大量的HO·,产生速率最大,此时MB浓度降至最低点。30~120 min,HO·产生量逐渐降低,产生量小于其参与氧化反应的量,此阶段MB溶液浓度缓慢升高。120~240 min HO·产生量极少,产生量与参与氧化反应的量近似相等,趋于稳定。从反应的全过程可以发现,HO·在催化氧化反应中的生成规律经过3个阶段,分别为0~30 min的快速生成阶段,30~120 min的生成速率降低阶段,120~240 min的稳定阶段。
2.3 H2O2催化氧化机理及硝基苯与H2O2最佳摩尔比的确定
2.3.1 H2O2催化氧化硝基苯机理
图 5所示为不同硝基苯与 H2O2摩尔比对硝基苯去除的影响。由图5可见:当不加H2O2时,240 min后硝基苯浓度仅有微量降低,去除率为 2%,可推断此条件下硝基苯浓度的降低主要是由于细砂的吸附作用造成;而当加入H2O2时,以硝基苯与H2O2摩尔比为1:60为例,在30 min时硝基苯的去除率升高,达到 12%,之后趋于稳定。这证明了加入 H2O2后,其与细砂中浸提出来的Fe2+和Fe3+发生了催化氧化反应生成羟基自由基,羟基自由基将硝基苯氧化被去除。这一系列化学反应的机理[17-18]为:
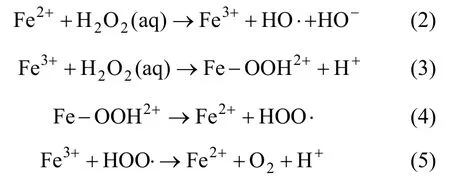

以上 6个反应揭示了基于含水层介质中铁的类Fenton技术氧化硝基苯的全过程,对于反应(1)~(5)是铁离子催化H2O2产生羟基自由基的过程。对于反应(6)来说,根据Regina等[17-18]的研究结果,产生的HO·首先攻击硝基苯上的硝基或邻位、间位碳原子,破坏苯环稳定结构,最终使硝基苯氧化开环,生成小分子脂肪酸,CO2,H2O和NOx。
2.3.2 硝基苯与H2O2最佳摩尔比的确定
从图5还可以看出:随着硝基苯与H2O2摩尔比的增加,硝基苯的去除率逐渐增大。分析原因认为:随着H2O2浓度的增大,浸提出的铁与H2O2接触概率也随之增加,催化氧化反应剧烈程度增大,产生HO·的量增多,因此,硝基苯的去除率大幅度增加。
当硝基苯与H2O2摩尔比增至1:500时,硝基苯的去除率与 1:200时的相比并无显著变化。这与 Kwan等[19]的研究结果相似,即过量的 H2O2不仅不能通过分解产生更多的自由基,反而在反应起始便将Fe2+迅速氧化为 Fe3+,降低反应速率;另外过量的 H2O2与HO·可发生反应,造成羟基自由基的数量减少,降低了H2O2的利用率[19-20]。因此当硝基苯与H2O2摩尔比增至1:200以上时,硝基苯的去除率不再显著增加,240 min后去除率都在80%左右。
从图5还可发现:0~60 min硝基苯残余量快速降低,60~240 min衰减曲线反应趋于平缓,说明反应已由剧烈反应阶段进入稳定阶段;当反应物铁与 H2O2含量充足时,该催化反应速率快。可对硝基苯与H2O2摩尔比为1:200曲线进行指数方程的拟合,拟合结果如表4所示。

表4 拟合的指数方程及参数Table 4 Exponential equations and parameters
从拟合结果看出:硝基苯的衰减与指数方程极为相近,R2=0.998。当硝基苯残余浓度为初始浓度的一半时,反应用时仅为12.02 min。综上所述,硝基苯与H2O2最佳摩尔比选定为1:200。

图5 不同硝基苯与H2O2摩尔比对硝基苯去除的影响Fig.5 Influence of NB removal efficiency with different mole ratios of NB and H2O2
3 结论
(1) 浸提剂的浸提作用可强化含水层介质中各形态铁的释放。浸提作用存在滞后性,浸提约36 h时铁浸出量到达峰值。浸提剂 DCB对污染场地的细砂中结晶态Fe3+的浸提含量最高为347.31 mg/kg,浸提效率为 62.92%;对结晶态 Fe2+的浸提含量较高,到达166.51 mg/kg,浸提效率为30.17%。DCB是该污染场地含水层介质中铁的最佳浸提剂。
(2) 催化氧化反应产生 HO·,其在催化氧化反应中的生成规律经过3个阶段,即0~30 min的快速生成阶段;30~120 min的生成速率降低阶段,120~240 min的稳定阶段。
(3) 含水层介质经浸提后,浸出铁与H2O2发生反应,可催化氧化硝基苯。当硝基苯与 H2O2摩尔比为1:200以上时,240 min后硝基苯的去除率最高,可达80.2%。硝基苯的衰减与指数方程极为相近,R2=0.998。硝基苯残余浓度为初始浓度的一半时,反应用时仅为12.02 min。
[1] Daisuke N, Dongwook K, Timothy J. Abiotic reduction of nitroaromatic compounds by aqueous Iron(Ⅱ) catechol complexes[J]. Environment Science and Technology, 2006, 40(9): 3006-3012.
[2] 谢丽, 盛杰, 周琪, 等. 硝基苯在钢渣-Fe(Ⅱ)系统中的还原转化[J]. 同济大学学报: 自然科学版, 2008, 36(1): 1666-1669.XIE Li, SHENG Jie, ZHOU Qi, et al. Reductive transformation of nitrobenzene in steel slag and Fe(Ⅱ) system[J]. Journal of Tongji University: Natural Science, 2008, 36(1): 1666-1669.
[3] 赵勇胜. 地下水污染场地污染的控制与修复[J]. 长春工业大学学报: 自然科学版, 2007, 28(2): 116-123.ZHAO Yong-sheng. Groundwater pollution control and remediation[J]. Journal of Changchun University of Technology:Natural Science Edition, 2007, 28(2): 116-123.
[4] Romero A, Santos A, Vicente F, et al. Chemical oxidation of 2,4-dimethylphenol in soil by heterogeneous Fenton process[J].Hazardous Materials, 2008, 23(5): 785-790.
[5] Tuba T, Mirat D G. Oxidation of diethylene glycol with ozone and modified Fenton processes[J]. Chemosphere, 2002, 47(1):293-301.
[6] Lauren L B, Jeffrey L S, Richard J W. Soil organic matterhydrogen peroxide dynamics in the treatment of contaminated soils and groundwater using catalyzed H2O2propagations[J].Water Research, 2006, 40(5): 2477-2484.
[7] Marcio P, Giacomo C. Electro-Fenton degradation of synthetic dyes[J]. Water Research, 2009, 43(4): 339-344.
[8] Marcio P, Nihal O, Marcia D, et al. Phenol degradation by advanced electrochemical oxidation process electro-Fenton using a carbon felt cathode[J]. Applied Catalysis, 2008, 83(3):140-149.
[9] 燕启社, 孙红文, 周长波, 等. 类Fenton氧化在污染土壤修复中的应用[J]. 生态环境, 2008, 17(1): 216-220.YAN Qi-she, SUN Hong-wen, ZHOU Chang-bo, et al.Application of like-Fenton oxidation on remediation of contaminated soil[J]. Ecology and Environment, 2008, 17(1):216-220.
[10] Schwestmann U, Cornell R M. Iron oxides in the laboratory[M].German: VCH Publisher, 1991: 5-55.
[11] 曾昭华. 地下水中铁元素的形成及其控制因素[J]. 江苏地质,2003, 27(4): 220-224.ZENG Shao-hua. Formation of Fe element in groundwater and its control factors[J]. Jiangsu Geology, 2003, 27(4): 220-224.
[12] Kong S H, Watts R J, Choi J H. Treatment of petroleumcontaminated soils using iron mineral catalyzed hydrogen peroxide[J]. Chemosphere, 1998, 37(8): 1473-1482.
[13] GB 13194—1991, 水质硝基苯、硝基甲苯、硝基氯苯、二硝基甲苯、二硝基氯苯的测定液液萃取和固相萃取气相色谱法[S].GB 13194—1991, Water quality—Determination of nitrobenzenc, mononitrotoluene (MNT), nitrochlorobenzenc and dinitrotolnene (ONT)—Gas-chromatography[S].
[14] 魏复盛. 水与废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002: 467-470.WEI Fu-sheng. Monitoring analysis method of water and wastewater[M]. 4th ed. Beijing: China Environmental Technology Press, 2002: 467-470.
[15] 柴多里, 刘忠煌, 陈刚, 等. 水热法合成纳米 Fe3O4及其对含酚废水的处理[J]. 硅酸盐学报, 2010, 38(1): 105-109.CHAI Duo-li, LIU Zhong-huang, CHEN Gang, et al. Preparation of nano-sized magnetite particles by hydrothermal method for treatment of phenolic wastewater[J]. Journal of the Chinese Ceramic Society, 2010, 38(1): 105-109.
[16] 夏旭, 胡正义, 高明霞, 等. 水稻根表胶膜浸提中根内元素溢出与浸提条件优化研究[J]. 土壤通报, 2009, 40(6):1289-1291.XIA Xu, HU Zheng-yi, GAO Ming-xia, et al. Elements leakage from roots in extracting iron plaque on the rice root surface and optimization of extraction conditions[J]. Chinese Journal of Soil Science, 2009, 40(6): 1289-1291.
[17] Regina C C, Flavia C C, Ardisson J D, et al. Highly active heterogeneous Fenton-like systems based on Fe0/Fe3O4composites prepared by controlled reduction of iron oxides[J].Science Direct, 2008, 83(3): 131-139.
[18] Cesare C, Renato B, Tuula T. In fl uence of the operating conditions on highly oxidative radicals generation in Fenton's systems[J]. Journal of Hazardous Materials, 2009, 16(1):402-408.
[19] Kwan W P, Voelker M B. Decomposition of hydrogen peroxide and organic compounds in the presence of dissolved iron and ferrihydrite[J]. Environment Science and Technology, 2002,36(1): 1467-1476.
[20] Kwan W P, Voelker M B. Rates of hydroxyl radical generation and organic compound oxidation in mineral-catalyzed Fentonlike systems[J]. Environment Science and Technology, 2003,37(4): 1150-1158.
