16个高丛越橘品种VcCBF基因的单核苷酸多态性(SNP)分析
2012-09-20王甲威魏海蓉刘庆忠
王甲威,林 科,姜 超,魏海蓉,刘庆忠*
(1.山东省果树研究所,山东省果树生物技术育种重点实验室,山东 泰安 271000;2.泰山学院生物与酿酒工程学院,山东 泰安 271021)
CBF基因(又称DREB1基因),编码一个具有AP2-domain的转录激活子,能够结合到DNA上具有 CRT(C-repeat)或 DRE(Dehydration-responsive element)调节位点的位置,调节植物冷适应相关基因表达[1]。CBF基因是植物冷适应及信号传导领域最有意义的发现之一,在多种重要农作物及蔬菜中均发现该基因,进一步研究发现,多种与植物冷适应相关的基因都受其调控[2-4]。国外学者在高丛越橘(Highbush blueberry,Vaccinium corymbosum)和兔眼越橘(Rabbiteye blueberry,Vaccinium virgatum)中也克隆到越橘的CBF基因,通过试验验证其功能,研究发现CBF基因表达量和表达模式的差异可能与高丛越橘品种蓝丰(Bluecrop)和兔眼越橘品种梯芙蓝(Tifblue)的抗寒性不同相关[5]。
单核苷酸多态性(Single nucleotide polymorphism,SNP)是指在基因组水平上由单核苷酸变异所引起的一种序列多态性[6]。在所有可能的DNA序列差异性中,单核苷酸多态性是发生频率最高的变异。在人类的DNA序列多态性中,90%序列多态性都是单核苷酸多态性[7]。单核苷酸多态性具有数量大、分布广、稳定性强、易于分型等优点,在人类疾病诊断及治疗、致病基因的发现、族群演化研究等方面起重要作用,同时在小麦、玉米、大豆等作物的物理作图、进化研究、遗传研究中也是很有效的分子标记[6,8-13]。
本研究以16个抗寒性不同的高丛越橘品种为试材,克隆其CBF基因,采用直接测序法筛查VcCBF基因的单核苷酸多态性,以期为研究VcCBF基因与越橘抗寒性的关系奠定基础。
1 材料与方法
1.1 高丛越橘品种
研究采用的16个高丛越橘品种采自山东省果树研究所越橘品种资源圃,分别为北陆(Northland)、喜来(Sierra)、陶柔(Toro)、都克(Duke)、日出(Sunrise)、蓝丰(Bluecrop)、埃利奥特(Elliott)、达柔(Darrow)、蓝塔(Bluetta)、泽西(Jersey)、布里吉塔(Brigitta)、早蓝(Earliblue)、晚蓝(Lateblue)、蓝金(Bluegold)、瑞卡(Reka)和普鲁(Puru)。
1.2 VcCBF基因的克隆、测序及单核苷酸多态性分析
以越橘幼嫩叶片为试材,采用TIANGEN植物基因组提取试剂盒提取基因组DNA,根据已发表越橘CBF基因序列设计引物,进行PCR扩增,扩增所用的上游引物为5'GAATCGTCGATGGAATATA ACT 3',下游引物为5'TCTAAAATCTAACTCCACA ACG 3',PCR产物回收后采用pMD18-T Vector载体(TaKaRa公司)连接,转化DH5a感受态细胞,LB/Amp平板上培养过夜后挑取菌落进行菌落PCR筛选阳性克隆,阳性克隆测序由上海生工生物技术有限公司完成[14]。每个品种测序8个阳性克隆,所得序列采用DnaSP v5分析VcCBF基因的单核苷酸多态性[15]。
2 结果与分析
2.1 VcCBF基因的克隆
PCR所得目的片段长度为698 bp,PCR产物回收后连接转化,将阳性克隆进行测序,对测序结果进行序列比对,除去重复序列,每个越橘品种得到4~8个序列,共得到94个非重复序列(见表1)。

表1 16个高丛越橘品种测序得到的VcCBF基因非重复序列Table1 Non repetitive sequences of VcCBF gene in 16 highbush blueberry cultivars
2.2 VcCBF基因的单核苷酸多态性
将所得VcCBF基因编码区(全长681 bp)的94个非重复序列利用DnaSP软件进行单核苷酸多态性分析,共发现103个SNP,全部为单核苷酸的替换,并没有InDel情况发生,SNP发生频率为1/619 bp,核苷酸多态性值(Pi)为0.01274。在103个SNP中,单态突变位点(Singleton variable sites)52个,简约信息位点(Parsimony informative sites)51个,在简约信息位点中,双突变为50个,三突变为1个(见表2)。

表2 16个高丛越橘品种VcCBF基因的单核苷酸多态性类型Table2 SNPs type of VcCBF gene in 16 highbush blueberry cultivars
进一步对VcCBF基因单核苷酸多态性碱基替换方式进行分析(见表3),除去三突变的简约信息位点后,在剩余的102个SNP中,转换(A↔G,T↔C)共有83个,颠换(G↔T,A↔C,C↔G,A↔T)共有19个,转换与颠换的比率为4.37∶1。
2.3 VcCBF基因的单倍型分析
对来自同一品种不同克隆的非重复序列进行组装,得到一致序列。利用DNAStar Megalign软件分别对来自不同材料的序列进行多序列联配,分析其单倍型,结果见图1。组装得到一致序列后,通过序列联配,这16个越橘品种可分为5种单倍型(Haplotype),且不同品种的越橘单倍型差异较大。
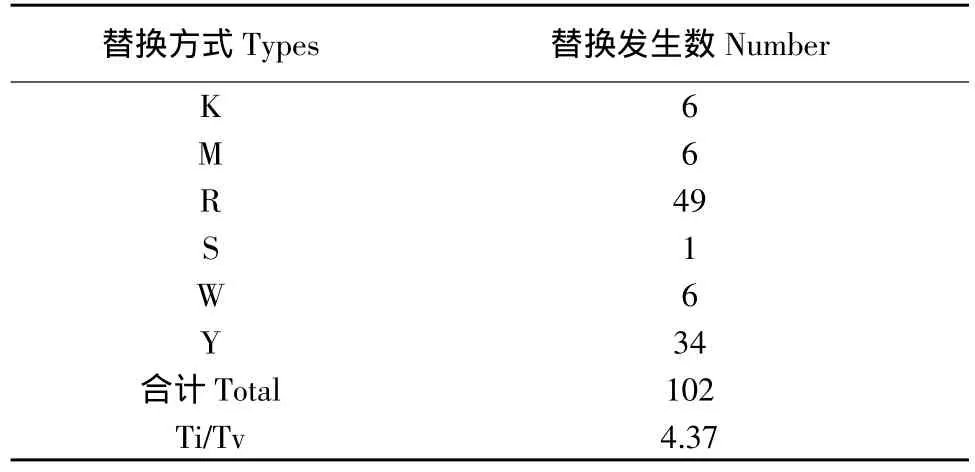
表3 VcCBF基因的碱基替换方式Table3 Substitution types of bases in SNPs
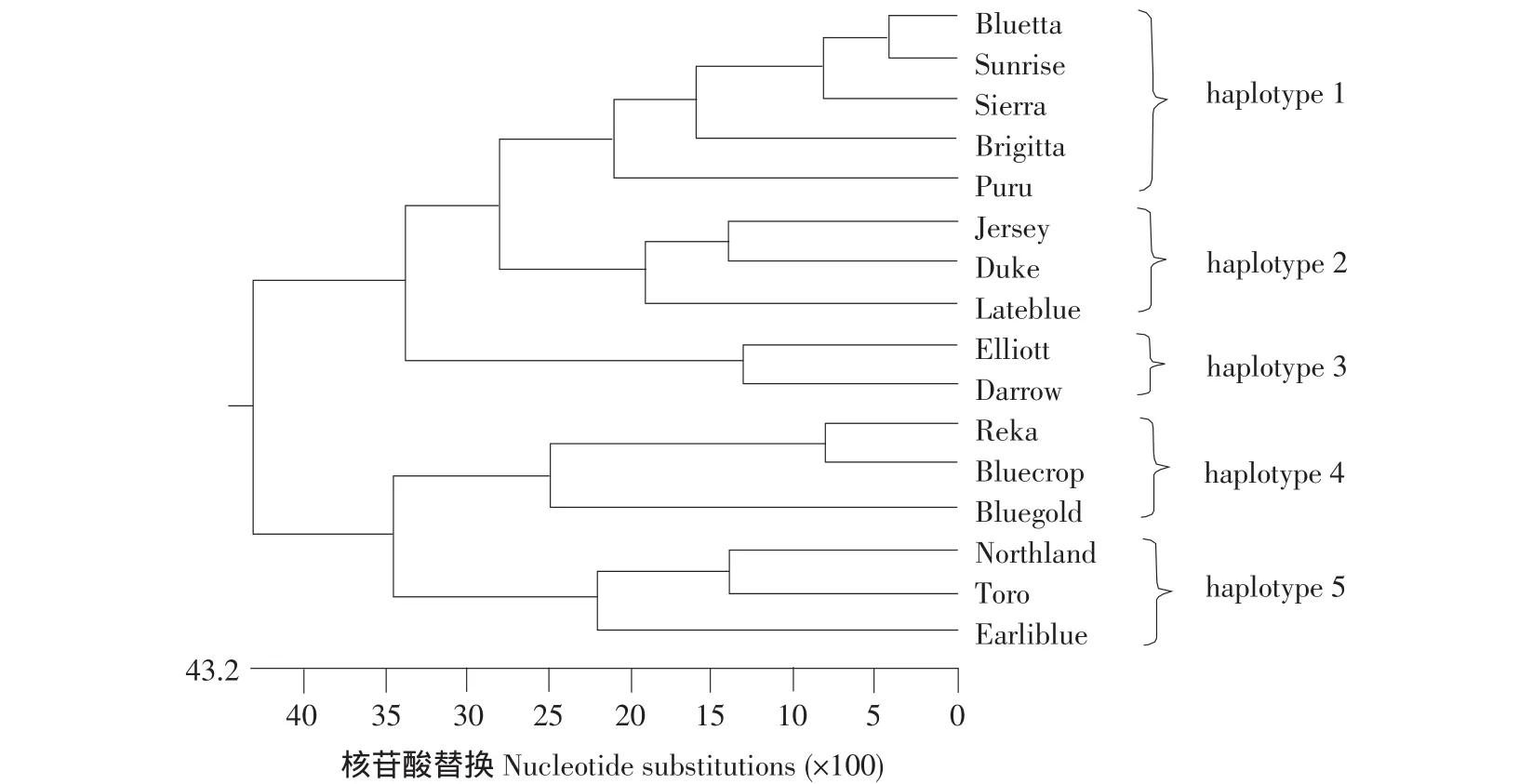
图1 16个高丛越橘品种VcCBF基因的单倍型关系Fig.1 VcCBF gene haplotype of 16 highbush blueberry cultivars
3 讨论与结论
检测单核苷酸多态性的方法很多,直接测序法是筛查SNP最可靠的方法之一,特别是对基因组信息较少、分子生物学研究较少的物种而言。本研究通过对16个越橘品种VcCBF基因的克隆测序,得到94个非重复序列,测序总长度63 732 bp,在VcCBF基因的编码区共发现103个多态性位点,单核苷酸多态性发生频率为1/619 bp,核苷酸多态性值(Pi)为0.01274,相对于其他物种,VcCBF基因单核苷酸多态性频率较低,这可能与其受到的选择压力较大相关。通过对103个SNP的具体分析,发现单态突变位点52个,简约信息位点51个(其中双突变50个,三态突变1个),在碱基转换方式分析中发现转换共有83个,颠换为19个,转换与颠换的比率为4.37∶1。通过进一步组装一致序列,进行单倍型分析,在16个越橘品种中共有5种单倍型。
直接测序法筛查SNP也存在不足,首先在克隆和测序过程中会造成假阳性,在检测到的52个单态突变位点中可能存在克隆或测序错误造成的误差。此外,高丛越橘品种为四倍体,且多为杂交选育而来,其本身VcCBF基因的情况较为复杂,本研究从每个品种筛选8个阳性克隆进行测序,可能造成其内源VcCBF基因的缺失,从而对分析其单核苷酸多态性和单倍型造成不足,这也是多倍体植物中单核苷酸多态性开发的难点之一[16]。多倍体植物中单核苷酸多态性开发的另外一个难点就是区分品种内的多态性和品种间的多态性,如普通小麦(异源六倍体),以26个品系为材料,采用直接测序法筛查其21个基因的SNP,结果发现大部分的SNP是品种内的多态性,品种间的多态性数量较少[17]。
[1]Fowler S,Thomashow M F.Arabidopsis transcriptome profiling indicates that multiple regulatory pathways are activated during cold acclimation in addition to the CBF cold response pathway[J].Plant Cell,2002,14(8):1675-1690.
[2]Thomashow M F.Plant cold acclimation:Freezing tolerance genes and regulatory mechanisms[J].Annu Rev Plant Physiol Plant Mol Biol,1999,50:571-599.
[3]Hsieh T H,Lee J T,Yang P T,et al.Heterology expression of the Arabidopsis C-repeat/dehydration response element binding factor 1 gene confers elevated tolerance to chilling and oxidative stresses in transgenic tomato[J].Plant Physiol,2002,129(3):1086-1094.
[4]Sanghera G S,Wani S H,Hussain W,et al.Engineering cold stress tolerance in crop plants[J].Curr Genomics,2011,12(1):30-43.
[5]Polashock J J,Arora R,Peng Y,et al.Functional identification of a C-repeat binding factor transcriptional activator from blueberry associated with cold acclimation and freezing tolerance[J].Journal of the American Society for Horticultural Science,2010,135(1):40-48.
[6]Brookes A J.The essence of SNPs[J].Gene,1999,234(2):177-186.
[7]Collins F S,Brooks L D,Chakravarti A.A DNA polymorphism discovery resource for research on human genetic variation[J].Genome Res,1998,8(12):1229-1231.
[8]Rafalski J A.Novel genetic mapping tools in plants:SNPs and LD-based approaches[J].Plant Science,2002,162(3):329-333.
[9]Chagne D,Gasic K,Crowhurst R N,et al.Development of a set of SNP markers present in expressed genes of the apple[J].Genomics,2008,92(5):353-358.
[10]Ganal M,Altmann T,Roder M S.SNP identification in crop plants[J].Curr Opin Plant Biol,2009,12(2):211-217.
[11]Shu Y J,Li Y N,Wu L H,et al.Mining and Identification of SNPs from EST sequences in soybean and converting SNP markers into CAPS[J].Acta Agronomica Sinica,2010,36(4):574-579.
[12]李亚玲,李景富,康立功,等.番茄Mi-1基因的SNP分型[J].东北农业大学学报,2010,41(10):42-44.
[13]张育垚,李景富,谢立波,等.番茄Cf-5基因的SNP分子标记开发[J].东北农业大学学报,2012,43(4):99-104.
[14]臧建磊,李亚东,刘庆忠,等.笃斯越橘CBF基因的克隆及序列分析[J].吉林农业大学学报,2011,33(5):532-535.
[15]Librado P,Rozas J.DnaSP v5:A software for comprehensive analysis of DNA polymorphism data[J].Bioinformatics,2009,25(11):1451-1452.
[16]贺道华,邢宏宜,赵俊兴,等.多倍体植物中单核苷酸多态性(SNPs)的开发[J].浙江大学学报:农业与生命科学版,2011,37(5):485-492.
[17]Ravel C,Praud S,Murigneux A,et al.Single-nucleotide polymorphism frequency in a set of selected lines of bread wheat(Triticum aestivum L.)[J].Genome,2006,49(9):1131-1139.
