不同品种唐菖蒲叶片浸提液对土壤微生物数量的影响
2012-09-20龚束芳吴凤芝
龚束芳,张 波,吴凤芝
(东北农业大学园艺学院,哈尔滨 150030)
近年来,随着对作物重茬(连作)障碍原因的深入研究,植物的化感作用(Allelopathy)越来越受到学者重视[1-3]。化感作用不但在植物相互干扰中起重要作用,而且影响土壤微生态环境,使微生物结构失衡[2,4-5]。泷岛在分析连作障碍原因时强调,土壤微生物的变化是连作障碍的首要因子[2,6]。自毒作用作为化感作用的一种特殊类型,被认为是造成作物连作障碍的重要因素之一。作物自身的残体、残茬分解是自毒作用重要表现形式之一[7-8]。
唐菖蒲(Gladiolus hybridus Hort)是我国切花生产量最大的花卉之一,生产中存在重茬(连作)障碍问题[9]。目前,对于唐菖蒲化感作用及唐菖蒲地上部分对土壤微生物数量影响等方面的研究尚未见报道。本文通过研究不同品种唐菖蒲叶片浸提液对土壤微生物数量的影响,了解唐菖蒲地上部分叶片对土壤微生态环境的影响,为探索唐菖蒲化感作用本质及克服其连作障碍提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试植物
唐菖蒲(Gladiolus hybridus Hort),各栽培品种均取自于东北农业大学设施园艺工程中心(见表1)。
表1 供试唐菖蒲品种Table1 Different varieties of Gladiolus hybridus Hort
1.1.2 供试土壤
试验所用的土壤取自东北农业大学设施园艺工程中心圃地0~15 cm耕层黑土。测定土壤基本理化性质采用鲍士旦的pH方法[10],pH 7.02,电导率0.566 mS·cm-1,有机质10.31 g·kg-1,碱解氮198.02 mg·kg-1,有效磷 137.52 mg·kg-1,速效钾321.28 mg·kg-1。
1.2 方法
1.2.1 唐菖蒲叶片的采集与浸提液的制备
选取旺盛生长的健康唐菖蒲植株,随机采集唐菖蒲叶片,先用清水冲洗去附在叶片表面的灰尘,再用蒸馏水淋洗叶片3次,然后再用去离子水浸洗1次,室温条件下阴干,-20℃冷藏保存备用。用时将叶片剪成1~2 cm的小段,将100 g叶片中加入1 L蒸馏水浸泡48 h,收集的溶液即为唐菖蒲的叶片浸提液,并通过3层滤纸布氏漏斗过滤2次,加去离子水定容至100 g·L-1,再用0.45 μm滤膜过滤后密封置于4℃冰箱中备用,再以母液加水稀释成1/10,1/5,1/2,3/4等不同浓度,即得浓度为10,20,50,70 g·L-1的唐菖蒲茎叶浸提液,4℃冰箱中保存备用[11-12]。
1.2.2 土壤微生物数量的测定
1.2.2.1 供试培养基
真菌培养基:采用马丁氏(Martin)培养基;细菌培养基:采用牛肉膏蛋白胨琼脂培养基,pH 7.0~7.2;放线菌培养基:采用改良高氏1号培养基[13]。
1.2.2.2 微生物数量测定
土壤微生物数量采用稀释平板菌落计数法计数[13]。真菌、放线菌、细菌分别取10-3,10-4,10-5倍的土壤稀释液1 mL,再加入浓度为10,20,50,70,100 g·L-1的唐菖蒲叶片浸提液1 mL,设添加无菌水为对照(CK),采用倾注法加入盛有12~15 mL的培养基的培养皿中,每处理重复5次。将接好菌的平板置于28~30℃电热恒温培养箱内倒置培养。真菌、细菌、放线菌分别培养3、3和7 d后记录土壤稀释分离结果,计算出每克干土中的真菌、细菌、放线菌的数量。计算公式如下:
菌落数=菌落平均数×稀释倍数×土样湿质量/土样干质量[13]。
1.3 数据分析
试验数据采用Excel和DPS(9.50)软件进行统计分析。
2 结果与分析
2.1 不同品种唐菖蒲叶片浸提液对土壤细菌数量的影响(差异显著性用一个水平即可,以下同)
由表2可见,与对照相比,A1、A2、A3三个品种对土壤细菌数量影响上表现出显著的促进作用,各处理浓度之间差异均极显著,并表现出低浓度促进效应,其中A3在叶片浸提液浓度为10 g·L-1时使细菌数量最多,约是对照的4~5倍。

表2 不同品种唐菖蒲叶片浸提液对土壤细菌数量的影响Table2 Influence of aqueous extracts of leaves from the different varieties of Gladiolus hybridus Hort on soil bacteria(×105cfu·g-1干土)
A4、A5叶片浸提液对土壤细菌数量为抑制作用,但各浓度处理与对照之间的差异均不显著。
2.2 不同品种唐菖蒲叶片浸提液对土壤真菌数量的影响
由表3可见,与对照相比,各品种唐菖蒲叶片浸提液对土壤真菌数量均表现出极显著的抑制作用,各品种均呈随着叶片浸提液浓度的降低,土壤真菌的抑制作用逐渐增强的趋势。其中A4在叶片浸提液浓度为10 g·L-1时使真菌数量最少,仅为对照的5%。A1和A2两个品种叶片浸提液各浓度处理与对照之间的差异较显著。A3、A4和A5三个品种叶片不同浓度浸提液间有极显著的浓度效应。
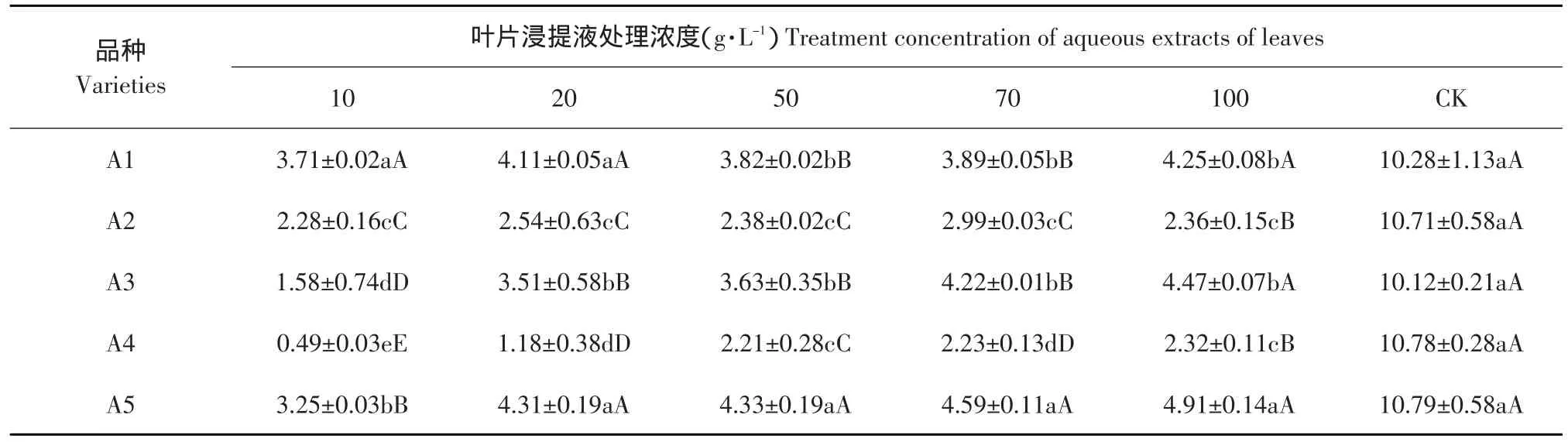
表3 不同品种唐菖蒲叶片浸提液对土壤真菌数量的影响Table3 Influence of aqueous extracts of leaves from the different varieties of Gladiolus hybridus Hort on soil fungi (×103cfu·g-1干土)
2.3 不同品种唐菖蒲叶片浸提液对土壤放线菌数量的影响
由表4可见,与对照相比,A1、A2、A4和A5四个品种对土壤放线菌数量均有不同程度的抑制作用,A5叶片浸提液各浓度处理之间对放线菌数量抑制作用不显著;A1、A4表现出一定的低浓度抑制效应,而A2的低浓度抑制效应较强,在叶片浸提液浓度为10 g·L-1时抑制作用最强,放线菌数量约为对照的30%。
A3叶片浸提液对土壤放线菌数量则有显著的低浓度促进效应,在叶片浸提液浓度为10 g·L-1时放线菌数量约为对照的二倍。

表4 不同品种唐菖蒲叶片浸提液对土壤放线菌数量的影响Table4 Influence of aqueous extracts of leaves from the different varieties of Gladiolus hybridus Hort on soil actinomycetes (×104cfu·g-1干土)
3 讨论与结论
土壤微生物除了包括分解有机质的真菌、细菌和放线菌外,还包括能进行光和作用的藻类以及原生动物和病毒等。在土壤肥力形成、物质循环和能量流动及有机质的分解等方面起重要作用[13-14]。
在土壤微生物的不同类群中,细菌的个体数最多,是土壤中的主要功能群落[14]。在对土壤细菌数量的影响上,唐菖蒲存在明显的品种差异效应,A1、A2、A3具有极显著的促进作用,低浓度促进作用更强;对土壤养分循环和土壤肥力提高具有促进作用。A4和A5则表现较强的抑制作用,低浓度抑制作用更强,对土壤肥力提高的影响相对较小。
土壤中的真菌数量少于细菌和放线菌,虽然数量较少,但与植物病害和物质转化却密切相关[14]。土壤中的许多真菌都是植物的致病菌,如土壤中的尖孢镰刀菌(F.oxysporum)能引起唐菖蒲的枯萎病[9,14-15]。由试验结果可见,在对土壤真菌数量的影响上,虽然各品种间抑制效应存在较大差别,但主要以抑制效应为主。因此试验中的这5个唐菖蒲栽培品种对大部分真菌病害的侵染上表现出较强的抵御能力。
土壤中的放线菌种类很多,大部分为好氧腐生菌。土壤中的放线菌对促进碳循环和腐殖质形成有重要作用,另外,土壤中一些放线菌还能产生抗菌素,对其他有害菌起拮抗作用[13-14]。由于A3对土壤放线菌的数量有显著促进作用,因此在抵御有害菌的侵害上,与其他4个品种相比,A3对有菌害可能表现出较强的抗性。
本试验通过传统的稀释平板培养法,直观地对唐菖蒲叶片对土壤中最重要的三大类群微生物数量的消长影响进行观察。结果表明,唐菖蒲叶片对土壤中微生物数量化感作用产生显著影响,同时,这种影响具有一定的品种效应和浓度效应。浓度效应的产生,一方面可能是由于叶片浸提液中含有较高浓度的碳水化合物、氨基酸等丰富的营养物质,为微生物的繁殖创造了有利条件,影响土壤微生物的种类和数量分布[14,16-18],另一方面是唐菖蒲叶片浸提液中含有的化感抑制物质进入土壤后,改变土壤微生物种群结构,抑制土壤微生物的生长[14,16,19-20]。营养物质和抑制物质的相互作用,对土壤微生物数量的变化和唐菖蒲生长环境产生重要影响。土壤中的微生物种类繁多,传统的平板培养法不能把它们在土壤中的种类分布完全表现出来,也不能全面系统地反映土壤中微生物的多样性生态功能和动态变化过程[21]。本试验结果表明,唐菖蒲品种间对微生物种类和数量影响存在显著差异,因此在众多资源中,通过品种筛选、定向育种以及栽培管理方式的优化,将使得唐菖蒲栽培管理中的自毒作用得到一定的缓解和控制。
[1]王广印,韩世栋,谢玉会,等.辣椒植株水浸液对辣椒和番茄种子萌发的自毒作用[J].华北农学报,2009,24(3):123-127.
[2]吴凤芝,赵凤艳,刘元英.设施蔬菜连作障碍原因综合分析与防治措施[J].东北农业大学学报,2000,31(3):241-247.
[3]吴凤芝,赵凤艳,马凤鸣.酚酸物质及其化感作用[J].东北农业大学学报,2001,32(4):313-319.
[4]Lin D Z,Tsuzuki E,Sugimoto Y,et al.Allelopathic effects of aqueous Aloe vera leaf extracts on selected crops[J].Allelopathy Journal,2004,13:67-74.
[5]董林林,王倩.黄瓜组织浸提液对黄瓜幼苗及土壤生化特性的影响[J].中国农业大学学报,2009,14(4):54-58.
[6]泷岛.防止连作障碍的措施[J].日本土壤肥料学杂志,1983(2):170-178.
[7]Rice E L.Allelopathy,2nd ed[M].London:Academic Press,1984.
[8]Blum U.Allelopathic interactions involing phenoliac acids[J].Nemat,1996,28:259-267.
[9]唐道城,曾丽,曹生海.唐菖蒲重茬病害的化学防治试验[J].青海大学学报:自然科学版,2002,20(1):25-27.
[10]鲍士旦.土壤农化分析[M].第3版.北京:中国农业出版社,2005:30-34,42-56,74-80,100-109,777.
[11]须海丽,张爱民,陈栋安,等.辣椒叶浸提液对土壤微生物数量和土壤酶活性的影响[J].长江农业,2008,6b:52-54.
[12]王玉娟,刘婉娈,康英,等.草地早熟禾对多年生黑麦草种苗化感影响的研究[J].作物杂志,2010(1):40-42.
[13]中国科学院土壤研究所微生物室.土壤微生物研究法[M].北京:科学出版社,1985:40-59.
[14]姚槐应,黄昌勇,等.土壤微生物生态学及其实验技术[M].北京:科学出版社,2006:57-115.
[15]方中达.植病研究方法[M].北京:中国农业出版社,1998:123-124.
[16]高子勤,张淑香.连作障碍与根际微生态研究:Ⅰ.根系分泌物及其生态效应[J].应用生态学报,1998,9(5):549-554.
[17]吕可,潘开文,王进闯,等.花椒叶浸提液对土壤微生物数量和土壤酶活性的影响[J].应用生态学报,2006,17(9):1649-1654.
[18]Francisco A M,Rose M V,Ascersion T,et al.Potential allelopathic guaianolides from cultivar sunflower Leaves[J].Phytochemistry,1993,34:669-674.
[19]Mallik A U,Zhu H,Park Y G.Overcoming Kalmia induced growth inhibition of Picea mariana by mycorrhizal inoculation[J].Journal of Kotean For Science,1998,87:429-444.
[20]Potter M J,Vanstone V A,Davies K A,et al.Breeding to increase the concentration of 2-phenylethy1 glucosinolate in the root of Brasscanapus[J].J Chem Ecol,2000,26:1811-1820.
[21]王林闯,贺超兴,张志斌.PCR-DGGE和FAMEs技术在土壤微生物多样性研究中的应用[J].生物技术通报,2009:113-117.
