几类茎叶处理除草剂对远志的安全性评价
2012-09-19温银元郭平毅尹美强原向阳王玉国
温银元,郭平毅,尹美强,原向阳,王玉国
(山西农业大学 农学院,山西 太谷030801)
远志驰名于国内外中药市场,过去主要源于野生。由于需求量的增加,连年采挖,只采不育,致使野生资源遭到严重破坏,资源日益减少,特别是种子未到成熟季节便抢先采挖,断绝了种源,不仅产量、收购量逐年下降,质量也有所下降,而且野生资源有濒临绝迹的危险。为满足市场需求,从上世纪80年代开始人工栽培细叶远志。山西、陕西、河北为主要栽培产区,其中山西栽培的面积最大。关于远志药材的品质,传统认为山西、陕西两地远志的质量最好,产量最大,为远志的道地产区[1~3]。人工栽培远志不仅能获得一定的经济效益和社会效益,而且对保护植物种质资源具有重要意义。
在远志栽培(尤其是规模化种植)过程中,杂草防除是一项艰巨的田间管理工作[4]。化学除草具有省工、高效、增产的优点,但目前还没有专门用于防除药用植物(包括远志)田间杂草的除草剂,另外,远志苗期长,幼苗生活力弱,对除草剂较为敏感,所以,对除草剂种类、用量、施用时期都要进行系统的试验研究[4]。
本研究根据远志的生物学特性,初步选用几类茎叶类化学除草剂在远志田进行安全性试验,研究并筛选安全、高效的远志化学防除的除草剂。
1 材料与方法
1.1 除草剂处理
试验在山西省新绛县山西作物化学调控重点实验室中药材种植试验基地进行。各供试除草剂分别设5个处理(表1),以不喷除草剂为对照。除草剂于2010年8月6日8:00~11:00喷施。小区面积为4m2,每小区按表1对应比例取药,加300 mL水喷施。每个处理重复3次,于8月13日观察远志的除草剂药害情况并记录。
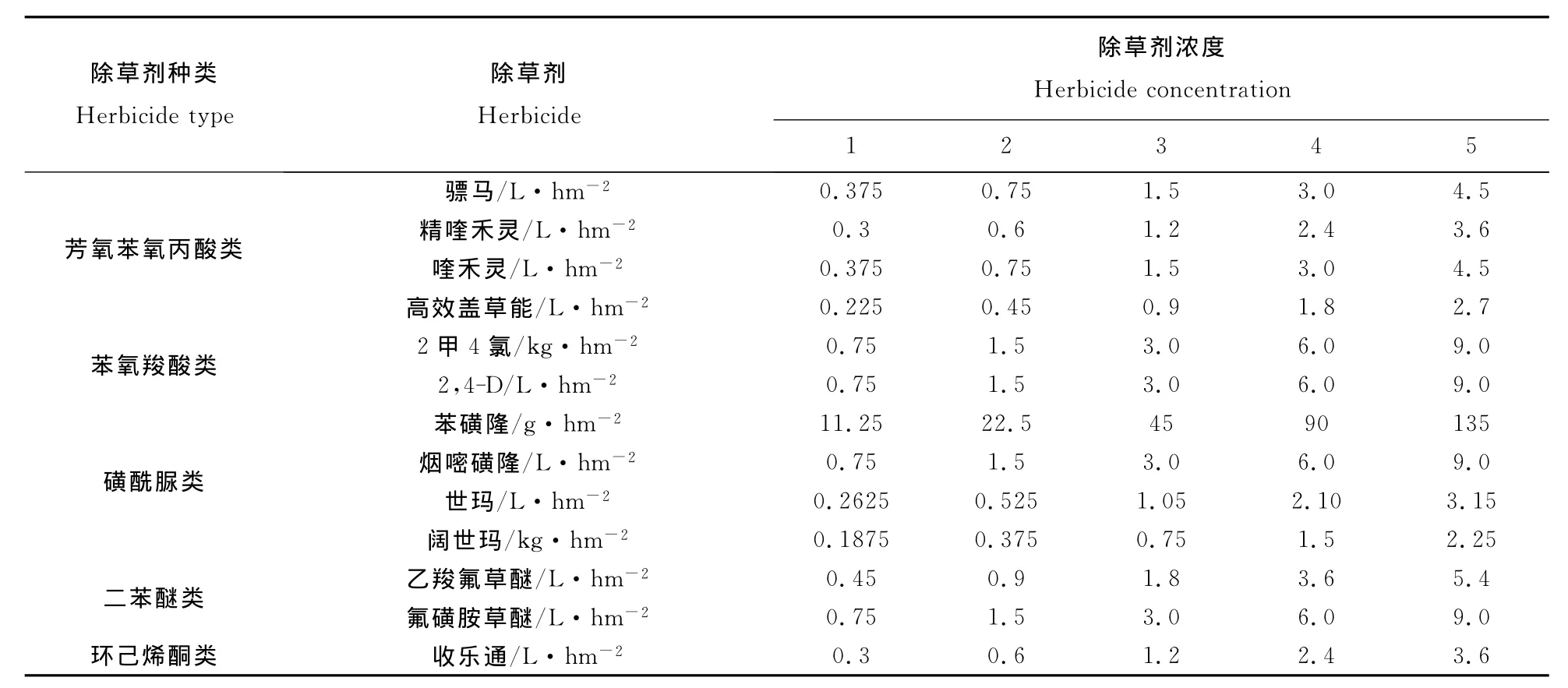
表1 除草剂处理浓度Table 1 Herbicide and concentration
1.2 叶片SPAD值、Y(II)、ETR测定
在除草剂处理后第7d时测定各指标。用手持式叶绿素仪(Minolta SPAD-502,日本)测定叶绿素相对含量SPAD值,用PAM-2500调制荧光仪(walz,德国)测定叶绿素a荧光参数实际光化学效率Y(II)和电子传递速率ETR。
2 结果与分析
2.1 除草剂处理对远志药害症状观察
由表2可见,远志对芳氧苯氧丙酸类除草剂(骠马、精喹禾灵、高效盖草能、喹禾灵等)和环己烯酮类(收乐通)表现出较强的耐药性,在试验用量范围内,植株生长正常,无药害症状。远志对磺酰脲类除草剂均表现出轻微药害,主要症状为叶色略微发黄。施用2甲4氯和2,4-D后表现出苯氧羧酸类除草剂的典型药害,即植株扭曲,叶片翻转,喷药后2~3h即出现该症状。在施用二苯醚类的乙羧氟草醚和氟磺胺草醚后,表现出明显药害症状,植株叶片发枯、发黄。
2.2 除草剂对远志叶绿素含量的影响
从表3可见,不同类型除草剂对远志叶绿素含量的影响不同。芳氧苯氧丙酸类和环己烯酮类除草剂对远志叶绿素含量的影响较小,只在最大剂量(6倍推荐剂量)处理时SPAD值显著低于对照,骠马、精喹禾灵、喹禾灵和高盖处理分别比对照降低10.42%、14.40%、19.34% 和 15.23%。低 浓 度(处理1和2)环己烯酮类除草剂收乐通处理后,远志SPAD值降低,而高浓度则增加了远志SPAD值,均未达显著水平。磺酰脲类除草剂对远志叶绿素含量的影响较大,所有浓度处理都降低了远志SPAD值,在1/4推荐剂量(处理2)磺酰脲类除草剂显著降低远志幼苗叶绿素含量(除阔世玛),在最大剂量处理时,苯磺隆、烟嘧磺隆、世玛、阔世玛处理分别比对照降低24.28%、24.07%、24.07%和27.57%。

表2 除草剂对远志的药害症状Table 2 Phytotoxicity symptoms of P.tenuifoliaexposed to herbicides

表3 除草剂对远志叶绿素含量(SPAD值)的影响Table 3 Effect of herbicide on SPAD value in P.tenuifolia
2.3 除草剂对远志PSII实际光化学效率Y(II)的影响
PSII实际光化学效率Y(II)反映在光照下PSⅡ反应中心部分关闭情况下的实际光化学效率。如表4所示,非胁迫条件下,远志的 Y(II)为0.583,磺酰脲类除草剂对远志Y(II)影响大于芳氧苯氧丙酸类和环己烯酮类。除精喹禾灵和高盖的处理5外,芳氧苯氧丙酸类除草剂对远志Y(II)无显著性影响,精喹禾灵和高盖处理5显著降低远志的 Y(II),分别比对照降低15.95%和23.33%。磺酰脲类除草剂处理降低了远志的Y(II),其中苯磺隆和烟嘧磺隆对远志Y(II)的影响大于世玛和阔世玛,如在推荐剂量下(处理4),苯磺隆和烟嘧磺隆处理使远志 Y(II)分别降低23.33%和25.56%,而世玛和阔世玛处理后远志的Y(II)分别降低20.58%和16.98%。随着收乐通处理浓度增加,远志的Y(II)逐渐降低,最低浓度时对远志Y(II)无影响,推荐剂量(处理2)处理后远志Y(II)比照低11.0%,但不显著,最高剂量处理时远志Y(II)最低(0.352),比对照低39.62%,显著低于对照。

表4 除草剂对远志PSII实际光化学效率Y(II)的影响Table 4 Effect of herbicide on Y(II)in P.tenuifolia
2.4 除草剂对远志表观电子传递速率(ETR)的影响
PSII的表观电子传递速率ETR反映了Rubisco(1,5-二磷酸核酮糖羧化/加氧酶)的活性。如表5所示,远志的ETR为154.21(CK),随除草剂浓度增加远志ETR逐渐降低;与对Y(II)的影响相似,磺酰脲类除草剂对远志ETR的影响最大。在芳氧苯氧丙酸类中,精喹禾灵的影响最小,高盖的影响最大,如6倍推荐剂量处理(处理5)使远志ETR显著降低,比对照低11.37%,而精喹禾灵处理后只降低5.54%,与对照差异不显著。1/8推荐剂量(处理1)磺酰脲类除草剂处理后使远志的ETR降低0.57%~25.36%,当处理浓度增加到推荐剂量时(处理4),苯磺隆、烟嘧磺隆、世玛和阔世玛处理的远 志 ETR 分 别 比 对 照 降 低 44.78%、41.20%、23.92%和29.75%,苯磺隆产生的影响最大,世玛产生的影响最小。1/2推荐剂量和推荐剂量(处理1和2)的收乐通增加了远志ETR,而高剂量处理则抑制了远志的电子传递速率,如在6倍推荐剂量(处理5)处理时,远志的ETR比对照低14.62%。
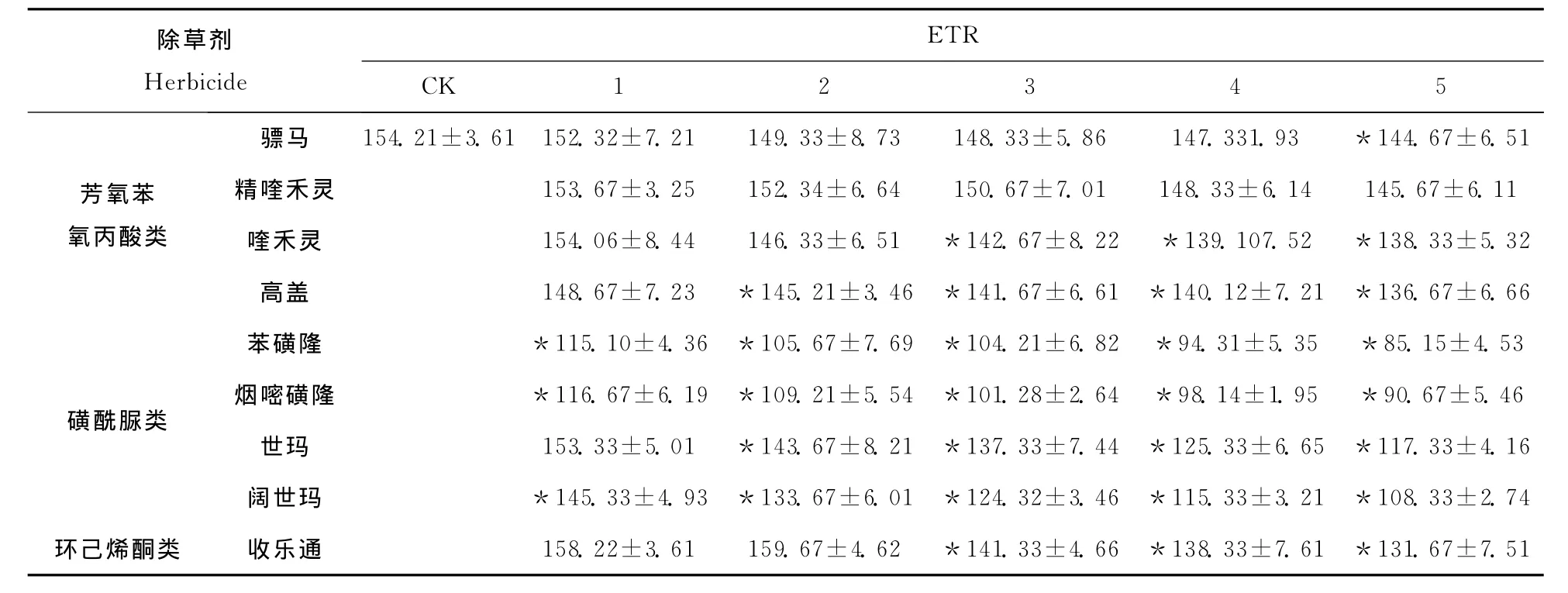
表5 除草剂对远志表观光合电子传递速率(ETR)的影响Table 5 Effect of herbicide on ETR in P.tenuifolia
3 结论与讨论
除草剂是通过植物吸收后在其体内运转并与作用靶标结合,发挥除草剂生理与生物化学效应,干扰植物的代谢作用,导致其死亡,其正确使用至关重要,而其不当使用不仅不会有效地防除农田杂草,反而会导致作物受害,甚至死亡[5,6]。叶绿素荧光动力学参数能够灵敏反映光合作用的变化情况,为植物抗逆生理、作物增产潜力预测等方面的研究提供了极大方便,因而被视为揭示植物光合作用与环境关系的内在探针,成为研究作物光合生理的有力工具,近年来,叶绿素荧光动力学参数已经受到广泛关注[7~9]。苯嗪草酮对敏感性植株(藜)叶片的光电子传递速率(ETR)的抑制效果要显著高于耐性植株[10],ETR的变化也可以作为初期植株药害检测手段来分析甲黄隆(ALS抑制剂)对植株个体的毒性[11]。丙酯草醚对敏感性油菜(白菜型)的Y(II)和ETR的抑制率要显著高于甘蓝型油菜[7]。在本试验中,磺酰脲类除草剂对远志幼苗Y(II)和ETR的抑制显著高于芳氧苯氧丙酸类和环己烯酮类,说明Y(II)和ETR的变化在除草剂药害检测过程中具有重要作用,能及时便捷的发现植株药害情况,对远志生产上的除草方案的选择具有指导意义。
芳氧苯氧丙酸类和环己烯酮类除草剂的作用靶标是乙酰-CoA羧化酶,抑制脂肪酸的合成,从而使植物生长过程中膜系统建立所需脂类的合成被抑制,其对植物的伤害可能是破坏了跨膜的电化学势。这两类除草剂的处理浓度小于4倍推荐剂量时对远志的生长状况、叶片SPAD值和叶绿素荧光参数Y(II)、ETR等都没有影响,无药害症状产生,高浓度处理(6倍推荐剂量)处理时对远志叶片SPAD值和Y(II)、ETR有一定影响,但仍未产生药害,表明芳氧苯氧丙酸类除草剂中的骠马、精喹禾灵、喹禾灵、高盖以及己烯酮类的收乐通对远志是安全的,可用于远志田的化学除草[12~14]。
磺酰脲类除草剂的作用靶标是ALS,抑制三种支链氨基酸(亮氨酸、异亮氨酸和缬氨酸)的合成,从而阻断或干扰功能大分子物质(如蛋白质、核酸等)的合成;进一步对光合作用和呼吸作用及其它生长发育相关的代谢过程产生影响。磺酰脲类除草剂胁迫下远志叶片黄化,SPAD值降低,Y(II)和ETR下降,表现出一定的药害症状,表明磺酰脲类除草剂不能用于远志田化学除草[12~14]。
苯氧羧酸类除草剂2甲4氯和2,4-D施用后植株扭曲,叶片翻转,喷药后2~3h即出现该症状,为典型药害症状。在二苯醚类的乙羧氟草醚和氟磺胺草醚施用后,植株叶片发枯、发黄,药害症状明显。这两类除草剂也不能用于远志田化学除草[12~14]。
[1]滕红梅.药用远志的结构发育与主要药用成分积累关系的研究[D].西安:西北大学,2009.
[2]徐国钧,徐珞珊.常用中药材品种整理和质量研究(南方协作组)[M].福州:福建科学技术出版社,1994:24-263.
[3]肖培根.新编中药志,第一卷[M].北京:化学工业出版社,2002:488.
[4]杨继祥,田义新.药用植物栽培学(第二版)[M].北京:中国农业出版社,2004:93-94.
[5]原向阳.干旱胁迫下草甘膦对抗草甘膦大豆生长发育影响的生理机制[D].太谷:山西农业大学,2009.
[6]原向阳,王鑫,郭平毅,等.叶面处理除草剂对防风等中药材的药害症状观察[J].山西农业科学,2011,39(3):262-265.
[7]金宗来.丙酯草醚对甘蓝型油菜与白菜型油菜生长发育的影响及其耐性差异机理[D].杭州:浙江大学,2010.
[8]Maxwell K,Johnson G N.Chlorophyll fluorescence-apractical guide[J].Journal of experimental botany,2000,51(345):659-668.
[9]Kopsell D A,Armel G R,Abney K R,et al.Leaf tissue pigments and chlorophyll fluorescence parameters vary among sweet corn genotypes of differential herbicide sensitivity[J].Pesticide biochemistry and physiology,2011,99(2):194-199.
[10]Aper J,De Marez T,Mechant E,et al.Chlorophyll fluorescence tests for monitoring triazinone resistance in Chenopodium album L[J].Commun Agric Appl Biol Sci.2008;73(4):939-44.
[11]Riethmuller-Haagea I,Bastiaansb L,Kropffb M J,et al.Can photosynthesis-related parameters be used to establish the activity of acetolactate synthase-inhibiting herbicides on weeds[J].Weed Science,2006,54(6):974-982.
[12]苏少泉.除草剂在植物体内的代谢与选择性及使用[J].现代农药,2003(6):14-17.
[13]Monaco T J,Weller S C,Ashton F M.Weed science:principles and practices,4th edition[M].Wiley-Blackwell,2002.
[14]Zimdahl R L.Fundamentals of weed science(third edition)[M].California,2007:396-435.
