不同激素配比对辣木组培苗生长的影响
2012-09-19武新琴智顺
武新琴,智顺
(山西林业职业技术学院,山西 太原030009)
辣木(Moringa oleifera Lam.)又称鼓槌树、马萝卜、不死树、萝卜树等,属辣木科,原产于印度。辣木叶片、果荚富含多种矿物质、维生素,作为蔬菜和食品有增进营养、食疗保健功能,根据测定,辣木干叶粉所含的钙质是牛奶的4倍,蛋白质是牛奶的2倍,钾是香蕉的3倍,铁是菠菜的3倍,维生素C是柑橘的7倍,维生素A(β胡萝卜素)是胡萝卜的4倍。只要3汤匙的辣木叶粉,就含有幼儿每日所需的270%维生素A、42%的蛋白质、125%的钙、70%的铁及22%的维生素C。它丰富的蛋白质、维生素及氨基酸,不但对先进国家素食者有极大益处,而且在对抗营养不良及提升免疫力方面也功效显著[1,2]。我国广东、广西、台湾、云南、福建、厦门均有栽培。
辣木种子比较昂贵,通过组织培养建立植株再生体系,是解决辣木种苗供应的有效途径[3]。本研究选择印度传统辣木嫩梢为外植体,应用25种激素配比的培养基进行初代诱导试验,建立了辣木的植株再生体系,总结了辣木组培快繁的培养方式,为辣木幼苗组培快繁提供了有用的数据及技术支持。此研究比其它辣木组培研究者的激素浓度及配方均有扩大[3~6],总结了不同激素配比对辣木再生体系的影响,并提出了不同的辣木组培方式。
1 材料与方法
1.1 试验时间、地点
辣木组培研究试验于2009年8月开始在山西林业职业技术学院组培实验室及温室中进行。
1.2 试验材料
利用传统辣木实生苗的嫩梢为外植体。实生苗于5月在温室容器育苗,6月移栽至校园苗圃。8月开始采摘嫩梢试验。
1.3 试验方法
剪取辣木实生苗约6cm长的嫩梢,摘除叶片,剪成两段,上段放在一起,下段放在一起,分别用清水清洗,用2%洗衣粉浸泡清洗约5min,再用自来水冲洗干净后放入无菌操作台备用;在无菌操作台上,将外植体分批灭菌,先用70%酒精震荡漂洗30s,酒精灭菌后的外植体用无菌水冲洗2次后,用0.1%升汞浸泡并震荡5min,用无菌水冲洗4~5次[7,8],用无菌滤纸吸干剪切为1cm 长带芽茎段,接种。以MS为基本培养基,琼脂0.6%,蔗糖3%,pH 6.5,培养基中采用激素为5个浓度的6-BA:0mg·L-1、0.02mg·L-1、0.2mg·L-1、0.5mg·L-1、1.0mg·L-1与5个浓度的 NAA:0mg·L-1、0.02mg·L-1、0.2mg·L-1、0.5mg·L-1、1.0mg·L-1,共25个处理。每个处理5瓶,每瓶接入2个茎段,每个茎段均带一个侧芽。接种时将上段与下段的芽分别接入同一处理的不同培养瓶内,使每个处理的接种材料保持一致。
培养条件为每天光照13h,温度为25~30℃,20天后调查茎段生长情况。计算10个茎段的芽长度平均值为芽平均长度;增殖倍数=腋芽数/接种数[9];每个处理中选取有代表性的茎段并量取茎段一侧愈伤组织生长量为愈伤组织生长。
将继代培养形成的组培苗剪成单芽茎段转接于生根培养基上,以1/2MS(大量元素减半)为基本培养基,琼脂0.6%,蔗糖2%,PH 6.5,添加不同浓度NAA、6-BA及IBA形成6个处理。分别为:1/2MS+6-BA0.5+NAA0.2;1/2MS+6-BA0.02+ NAA0.2;1/2MS+ NAA0.2;1/2MS+NAA0.5;1/2MS+ NAA0.2+IBA0.5;1/2MS+NAA0.0。20天后调查茎段生根情况。
利用茎段形态学上端朝上或朝下两种不同方式接种在生根培养基上,观察茎段生根情况,并通过驯化移栽,观察成活情况。
2 结果与分析
2.1 不同激素配比对辣木茎段诱导的影响
将初代及继代接种20天后的芽生长高度、茎段增殖倍数及愈伤组织生长情况,调查汇总,结果见表1。由图1可见,培养基中加入0.02mg·L-1NAA和0.02mg·L-16-BA 比不加6-BA 和加0.2~1.0mg·L-16-BA 的芽长度大,但加入0.2mg·L-16-BA比加入0.02mg·L-16-BA的芽长度减小,节间缩短,茎稍粗壮。加入0.5mg·L-1和1.0mg·L-16-BA,芽长度更小,节间更短。6-BA在0.02mg·L-1至1.0mg·L-1浓度范围内,6-BA浓度越高,侧芽生长越明显。所以随植物生长调节剂6-BA的添加在抑制组培苗高生长的同时,却刺激了其腋芽的萌发,与对水曲柳组培苗的影响效果相似[9]。

图1 6-BA与NAA不同配比对芽长度的影响Fig.1 6-BA and NAA different ratio to the influence of length of bud
从图2可以看出,培养基中加入6-BA0.5mg·L-1NAA和0~0.2mg·L-16-BA茎段增殖倍数均比其它组合高,其中 MS+6-BA0.5mg·L-1+ NAA 0.02mg·L-1茎段增殖倍数最高达8.1,腋芽数多,茎健壮,节间长短适中,为最适宜的诱导及增殖培养基。MS+6-BA 1.0mg·L-1+ NAA 0.2mg·L-1虽然茎段增殖倍数达7.9,但节间很短不利于进行单芽茎段剪切。从图1和图2均可看出,培养基中加0.02mg·L-1NAA 比不含NAA的培养基茎生长速度快,但随着NAA含量增加,茎生长速度受到抑制。

图2 6-BA与NAA不同配比对茎段增殖倍数的影响Fig.2 6-BA and NAA different ratio of the influence of proliferation
由表1可以看出,随着培养基中6-BA和NAA含量增加,愈伤组织生长也增加。当培养基中含6-BA 1.0mg·L-1,NAA 0.5mg·L-1时愈伤组织生长最旺盛。
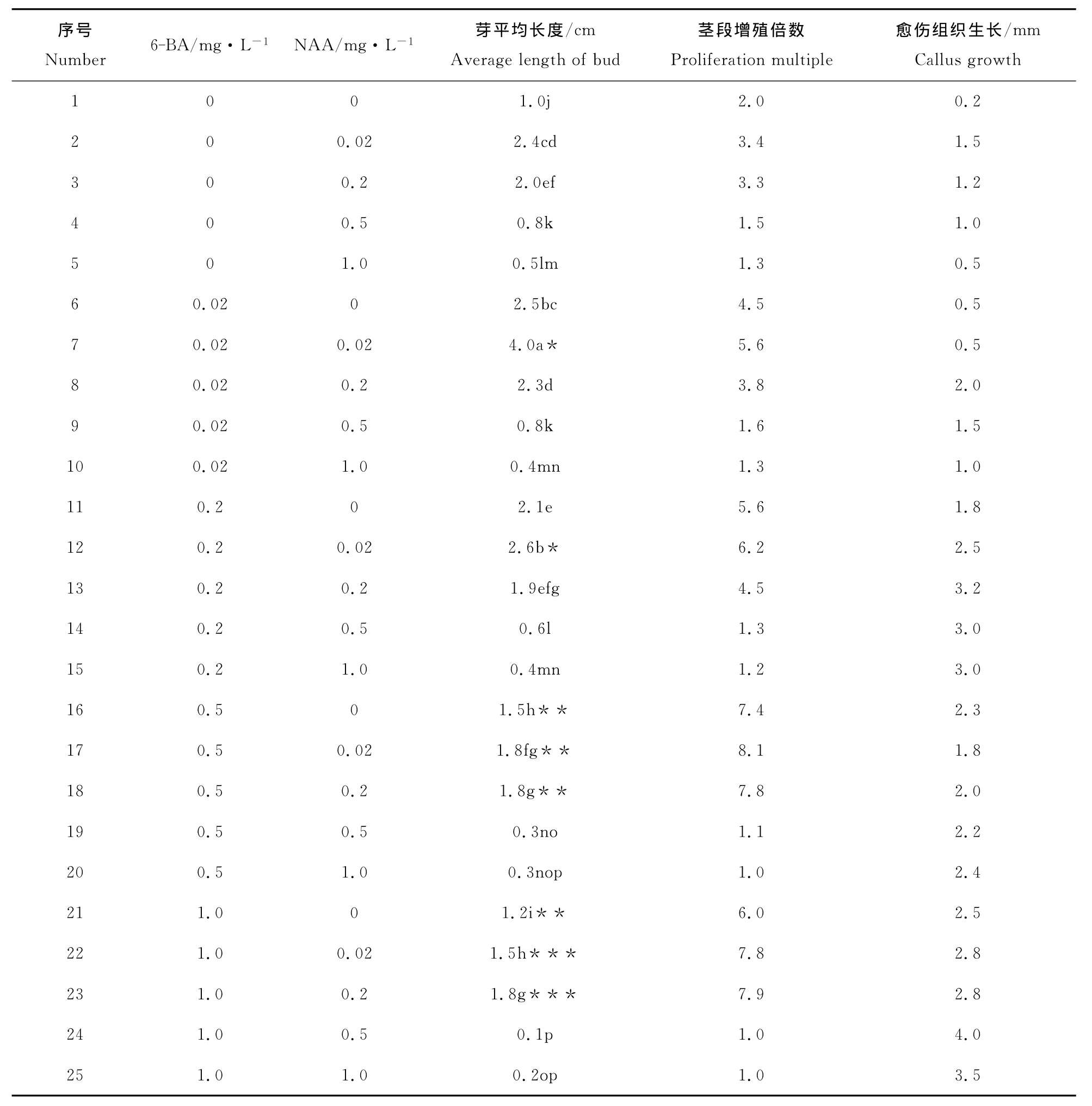
表1 不同培养基上芽生长结果Table 1 The differentiation result of the different culture medium
2.2 不同激素配比对辣木茎段生根的影响
由表2可见,在1/2MS+0.2mg·L-1NAA培养基上生根率最高达79%,加入0.5mg·L-1NAA时生根率降为75%,在0.2mg·L-1NAA基础上再加0.5mg·L-1IBA 时生根率降为72%,加入生长素比对照生根率明显提高,但随着生长素浓度的升高生根率反而下降。在1/2MS+NAA 0.2mg·L-1的基础上再加0.02mg·L-16-BA,生根率明显降低,在1/2MS+ NAA 0.2mg·L-1的基础上再加0.5mg·L-16-BA生根率为0,可见加6-BA不利于生根。

表2 不同培养基对生根的影响Table 2 Effect of the root in the different culture medium
2.3 不同接种方式对茎段生根及移栽成活的影响
将辣木带芽茎段以形态学上端朝上与朝下(倒插)两种方式接种在1/2MS+NAA 0.2mg·L-1+蔗糖2.0%培养基上,均可以在形态学下端生根,生根率相近,形态学上端朝上比朝下接种根系生长较快。但由于辣木根系较脆,形态学上端朝上在清洗移栽时,根系容易受损[5],形态学上端朝下,根系不沾琼脂,容易清洗,移栽成活率可提高10%。
3 结论与讨论
本研究结果表明,以辣木嫩茎为外植体,采用无菌微型扦插法[10]诱导及增殖培养,在 MS+6-BA0.02~0.5mg·L-1+NAA0.02mg·L-1+蔗糖3%的培养基上辣木组培苗生长良好,增殖倍数达5.6~8.1。其中 MS+6-BA 0.5mg·L-1+NAA 0.02mg·L-1增殖倍数最高达8.1,为芽诱导及增殖的最佳培养基。虽然MS+6-BA 1.0mg·L-1+NAA 0.2mg·L-1增殖倍数也可达7.9,但茎节过短,不利于单芽剪切。培养基中加6-BA不利于生根,加很少量也会使生根率降低。在1/2 MS+NAA0.2mg·L-1的培养基上生根率达到最高。随生长素浓度增加生根率降低,与其他学者的试验结果相似[4~6],利用低浓度 NAA、IBA 均可促进生根,但高浓度生长素不利于生根。总之,辣木茎和根的生长均喜欢较低浓度的生长调节物质。
辣木根系很脆,移栽清洗培养基时,根系容易断裂,不利于移栽,在诱导生根阶段,采用形态学上端朝下接种,仍在形态学下端生根,根部没有培养基使清洗变得容易,有利于移栽成活。
[1]陆斌,陈芳,张劲峰.印度的辣木生产和研究[J].世界农业,2005(10):32-35.
[2]刘昌芬,龙继明,杨焱,等.多功能植物辣木栽培技术研究初报[J].中国农学通报,2007,23(6):590-593.
[3]王洪峰,韦强.利用辣木茎段建立植株再生体系的研究[J].浙江林业科技,2008,28(5):40-43.
[4]马崇坚,王玉珍,任安祥,等.辣木的组织培养与快速繁殖[J].植物生理学通讯,2007,43(4):748.
[5]罗云霞,陆斌,陈芳,等.辣木组织培养试验[J].广东农业科学,2007(6):36-38.
[6]向素琼,梁国鲁,郭启高,等.辣木组织培养与四倍体植株诱导[J].热带亚热带植物学报,2007,15(2):141-146.
[7]王荃,胡宝忠.杜鹃花组织培养技术研究[J].东北农业大学学报,2003,34(4):459-464.
[8]张洁.辣木(Moringa oleifera Lam.)组培育苗及四倍体新种质诱导技术的研究[D].重庆:西南大学,2007.
[9]邓正正,王力华,王庆礼.植物生长调节剂对水曲柳组培苗生长及内源激素的影响[J].东北林业大学学报,2009,37(12):10-13.
[10]曹春英.植物组织培养[M].北京:中国农业出版社,2006:29.
