类胡萝卜素在锦鲤组织器官中的沉积与分布
2012-09-19姜志强崔培秦强刘芳高小强田青杰周小龙
姜志强,崔培,秦强,刘芳,高小强,田青杰,周小龙
(1.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023;2.大连市海洋与渔业局,辽宁大连116001)
锦鲤Cyprinus carpio体色的优劣是决定锦鲤市场价格的关键因素。许多研究表明,光照、生理状况、饲料营养等多种因素都能影响到鱼的体色。而在同一品种中,饲料对体色的影响更为突出。鱼类的体色主要是由类胡萝卜素决定的[1],而其自身并不具备能合成类胡萝卜素的能力[2],只能从食物中获得,因此,在饲料中添加类胡萝卜素可以增强鱼的体色。
研究发现,在饲料中添加螺旋藻干粉可以有效地改善锦鲤的体色,且随着螺旋藻干粉投喂量的增加,锦鲤体色更鲜艳[3]。鱼类消化系统吸收类胡萝卜素后,主要沉积在皮肤、肌肉、肝脏和肾脏中[4]。鱼体的不同部位对类胡萝卜素的沉积能力不同。目前已有学者报道了虹鳟 Oncorhynchus mykiss尾部对虾青素的沉积能力高于背部和腹部[5],而真鲷Pagrosomus major肌肉几乎不具有沉积虾青素的能力[6],但对锦鲤色素沉积与分布的研究还很少。本试验中,作者通过测定鱼体的眼、背鳍、尾鳍、皮肤、肌肉及肝胰脏中的类胡萝卜素含量,研究了锦鲤在摄食添加着色剂的饲料后成色物质在体内的沉积顺序,然后用基础饲料喂养,检测在停止投喂含虾青素、螺旋藻饲料之后体内的类胡萝卜素含量的变化,以期为研究锦鲤配合饲料中如何合理使用着色添加剂,实现节约饲料成本和养殖效益最大化提供参考资料。
1 材料与方法
1.1 材料
1.1.1 试验鱼 试验用锦鲤红白幼鱼由北京市水产科学研究所小汤山良种繁育中心提供,体质量为(7.31 ±0.12)g。
1.1.2 试验饲料 试验饲料的配方和生化组成见表1,其中混合维生素与混合矿物质购于北京桑普有限责任公司,虾青素购于德国巴斯夫 (BASF)公司,有效含量为10%,螺旋藻为大连金海岸水产养殖技术研发室生产。
1.2 方法
1.2.1 试验设计与饲养管理 将试验鱼在实验室中暂养,投喂基础饲料,2周后挑选体格健康的个体放于90L的水槽中,每槽放22尾。试验共分两组,每组设3个平行。试验用水采用曝气24 h以上的自来水。试验期间,每天投喂2次 (7:00、16:00),投喂量约为体质量的3%。每天换水一次,吸底并收取粪便,换水量为总水量的1/2。水温保持在 (20±1)℃,24 h充气。每隔3 d取一次鱼样,每槽随机取样2尾。试验前期投喂添加着色剂 (A组和 S组)的饲料,分别在第1、5、9、13、17、21天时取样;然后停止投喂添加着色剂的饲料,使用基础饲料进行投喂,在第0(停喂当天)、5、9、13、17、21天时分别随机取样,用于总类胡萝卜素含量的测定。试验共进行41 d。

表1 试验饲料组成(干物质)Tab.1 Ingredient and composition of the experimental diets(dry matter) w/%
1.2.2 总类胡萝卜素含量的测定 参考陈晓明等[7]的方法并略做修改:用电子分析天平准确称取鲜样品0.1 g,剪碎后,用丙酮定容至5 mL,放入超声波清洗机低温超声波震荡40 min后取出,以4 000 r/min离心10 min,放入冰箱 (4℃)中静置24 h。将所得的眼、背鳍、尾鳍、皮肤 (带鳞片)、肌肉及肝胰脏的色素萃取液分别置于1 cm比色皿中,以丙酮为空白对照管 (比色皿加盖以防止丙酮挥发,影响比色效果),用754型紫外-可见分光光度计进行扫描,找出最大吸收峰处的波长 (448 nm),在该波长下测定各组色素萃取液的吸光度值。
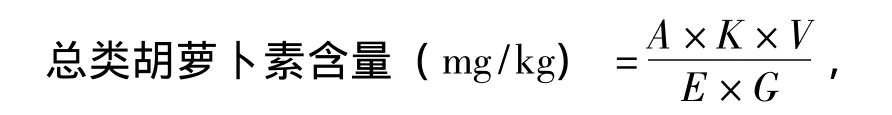
其中:A为吸光度值;K为常数 (104);V为提取液体积 (mL);E为摩尔消光系数 (2 500);G为样品质量 (g)。
1.3 数据处理
采用Excel软件处理试验数据,试验数据以平均值±标准差 (Mean±S.D.)表示。用SPSS 16.0软件进行相关性检验,用单因素方差分析法检验试验组差异的显著性,若组间差异显著 (P<0.05),用Duncan氏做多重比较分析。
2 结果
2.1 虾青素对锦鲤各组织器官中类胡萝卜素含量的影响
从表2可见,随着投喂时间的延长,锦鲤各组织器官中的类胡萝卜素含量均呈现递增的趋势,均在第21天时含量达到最高。与投喂虾青素饲料第1天相比,投喂第9天时,锦鲤背鳍、尾鳍和皮肤中的类胡萝卜素含量显著增加 (P<0.05),投喂第21天时,背鳍、尾鳍和皮肤中的类胡萝卜素含量较投喂第1天时分别增加247%、297%和181%;而眼中的类胡萝卜素含量在投喂第21天时显著增加 (P<0.05);与其它部位相比,肌肉中的类胡萝卜素含量极低,肝胰脏中的类胡萝卜素含量变化很小,且投喂时间的长短对其无显著影响 (P>0.05)。
2.2 螺旋藻对锦鲤各组织器官中类胡萝卜素含量的影响
从表2可见,随着投喂时间的延长,锦鲤各组织器官中的类胡萝卜素含量均呈现递增的趋势,均在第21天时含量达到最高。与投喂螺旋藻饲料第1天相比,投喂第9天时,背鳍、尾鳍中的类胡萝卜素含量显著增加 (P<0.05);投喂第13天时,皮肤和眼中的类胡萝卜素含量显著增加 (P<0.05);投喂第5天时,肌肉中的类胡萝卜素含量显著增加 (P<0.05);投喂第21天时,锦鲤背鳍、尾鳍和皮肤中的类胡萝卜素含量较投喂第1天时分别增加237%、409%和173%。
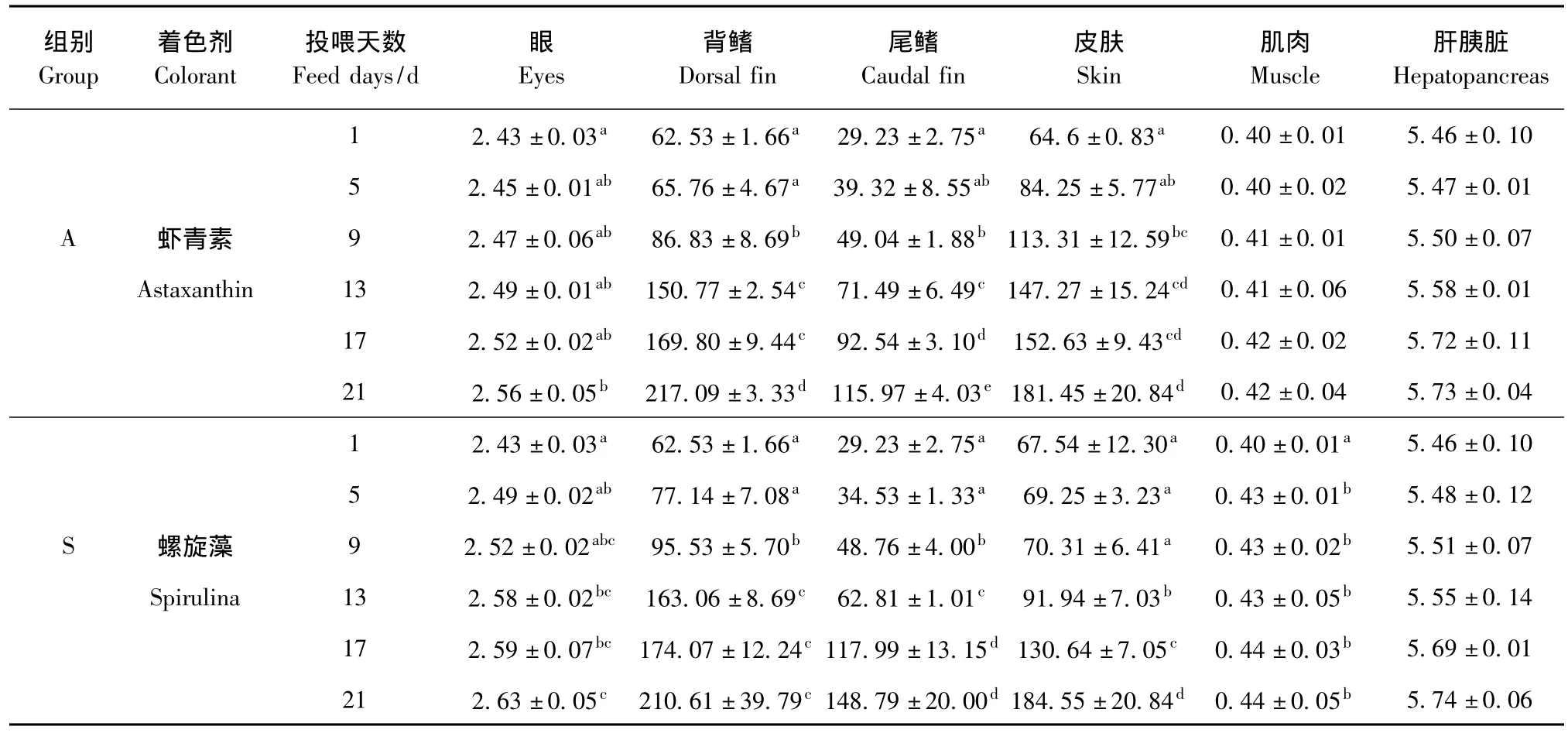
表2 虾青素、螺旋藻对锦鲤各组织器官中类胡萝卜素含量的影响Tab.2 Variations in total carotenoid contents in different tissues of ornamental carp fed the diets containing astaxanthin,and spirulina mg/kg
2.3 停喂虾青素饲料对锦鲤各组织器官中类胡萝卜素含量的影响
从表3可见,随着停喂时间的延长,锦鲤各组织器官中的类胡萝卜素含量均呈逐渐下降的趋势,均在停喂第21天时含量达到最低。在停喂添加虾青素的饲料0~13 d时,没有对锦鲤皮肤和尾鳍中的类胡萝卜素含量产生显著影响 (P>0.05),但当停喂时间达到17 d时,锦鲤皮肤、背鳍和尾鳍中的类胡萝卜素含量显著下降 (P<0.05),停喂第21天时,皮肤、背鳍和尾鳍中的类胡萝卜素含量与停喂当天相比,分别降低37%、51%和35%;停喂虾青素饲料没有对试验鱼肝胰脏、肌肉和眼中的类胡萝卜素含量产生明显影响 (P>0.05)。
2.4 停喂螺旋藻饲料对锦鲤各组织器官中类胡萝卜素含量的影响
从表3可见,随着停喂时间的延长,锦鲤各组织器官中的类胡萝卜素含量均呈逐渐下降的趋势,均在停喂第21天时含量达到最低。在停喂添加螺旋藻的饲料0~13 d时,没有对锦鲤皮肤、背鳍和尾鳍中的类胡萝卜素含量产生显著影响 (P>0.05),但当停喂时间达到17 d时,锦鲤皮肤、背鳍和尾鳍中类胡萝卜素含量均显著下降 (P<0.05),停喂第21天时,皮肤、背鳍和尾鳍中的类胡萝卜素含量与停喂当天相比,分别降低40%、38%和40%;锦鲤肝胰脏和眼中的类胡萝卜素含量在停喂0~17 d时差异不显著 (P>0.05),但停喂时间达到21 d时,肝胰脏和眼中的类胡萝卜素含量显著低于停喂当天的含量 (P<0.05);停喂螺旋藻饲料没有对锦鲤肌肉中的类胡萝卜素含量产生明显影响 (P>0.05)。
3 讨论
不同鱼类利用类胡萝卜素的能力不同,不同类胡萝卜素的着色效果也不同,其着色效果受饲料中多种因素的影响[8]。何培民等[3]研究发现,在饲料中添加螺旋藻可以有效改善锦鲤的体色,并且随着螺旋藻干粉投喂量的增加,锦鲤体色更鲜艳。Tanaka等[9]给对虾 Penaeus japonicus饲喂一定含量的类胡萝卜素4周后,其体色更加鲜艳。韩学哲[10]在对红剑尾鱼 Xiphophorus helleri等观赏鱼的体色研究时发现,虾青素添加量的不同及饲养周期的长短,都会影响鱼体的色素含量和着色效果。本试验中,随着含虾青素、螺旋藻饲料投喂时间的延长,鱼体各组织器官中的类胡萝卜素含量逐渐升高,体色逐渐加深,且饲养时间越长,着色效果越好,这与上述研究结果相一致。
类胡萝卜素在鱼体各组织器官的分布不同。虹鳟在幼鱼期,色素主要存在于皮肤中;在鱼种阶段之后,主要存在于肌肉中;性成熟时,雄性肌肉中的类胡萝卜素转移至皮肤中,雌性肌肉中的类胡萝卜素转移至生殖腺中[11]。Metusalach 等[12]在对北极红点鲑Salvelinus alpinus幼鱼体色的研究中发现,用添加角黄素的饵料饲喂24周后,沉积类胡萝卜素的主要组织器官为肌肉,其次是皮肤、肝脏和性腺。而张春兰等[13]、孙向军等[14]在对锦鲤体色的研究中发现,鱼体吸收的色素主要沉积于体表。本试验中也得出相类似的结果,即饲养时间一定时,皮肤和鱼鳍中的类胡萝卜素含量高于肝胰脏、眼和肌肉,说明锦鲤的眼、肌肉和肝胰脏中色素沉积量受影响较小,而背鳍、尾鳍和皮肤中色素的沉积量受影响较大。色素在鱼体内沉积的靶组织具有一定的选择性,不同部位沉积效率不同,仅从每个试验组来看,皮肤和鳍中色素沉积量增长较快,而其它部位色素沉积较慢。
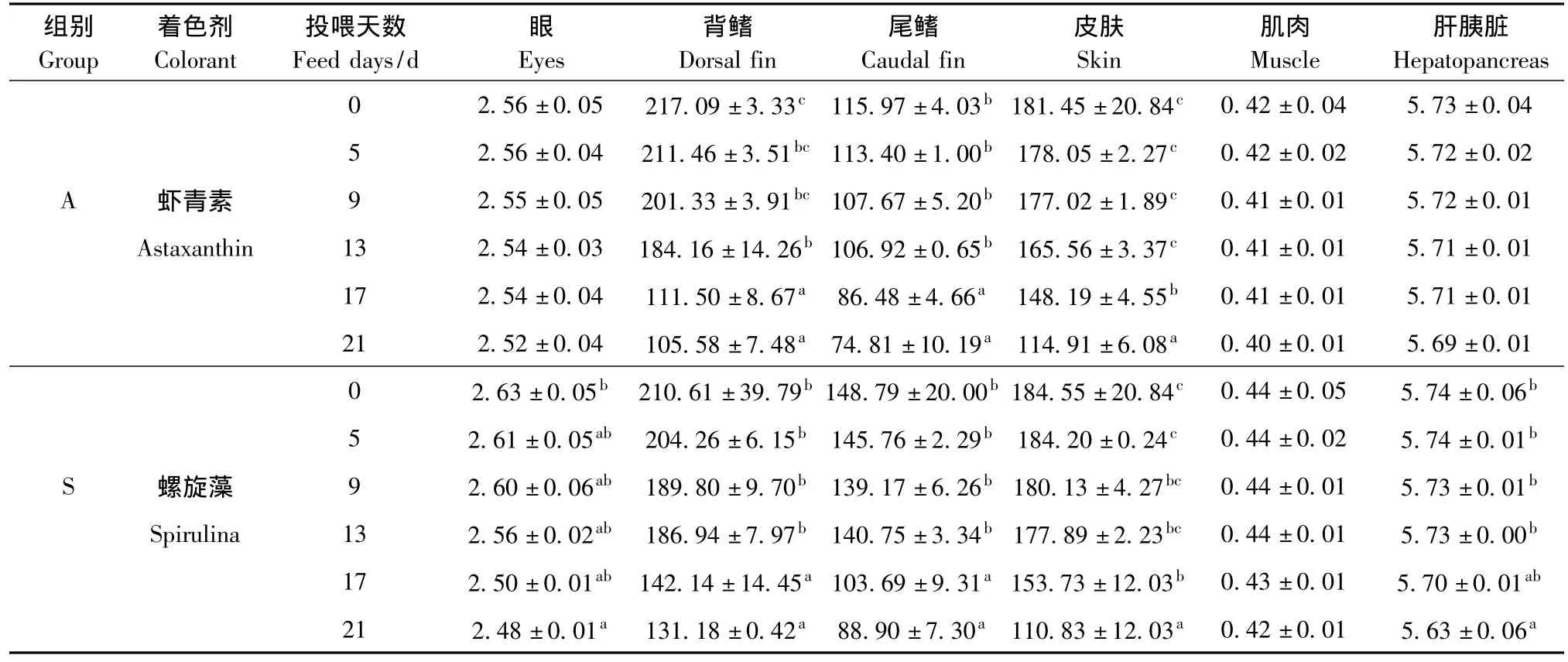
表3 停喂虾青素、螺旋藻饲料对锦鲤各组织器官中类胡萝卜素含量变化的影响Tab.3 Variations in total carotenoid contents in different tissues of ornamental carp unfed the diets containing axtaxnthin,and spirulina mg/kg
本试验中,随着饲养时间的延长,锦鲤皮肤和鳍中的类胡萝卜素逐渐升高,并且在第13天时显著升高 (P<0.05),说明饲喂达到一定时间后,锦鲤体表的类胡萝卜素含量才会显著增加。这与韩学哲[10]对红剑尾鱼、孔雀鱼Xiphophorus helleri和玫瑰无须鲃Barbus conchonius的研究结果一致。黄辨非等[15]发现,在饲料中添加红辣椒粉饲养红草金鱼,红色素的沉积不随投喂时间的延长而一直增加。本试验中,投喂虾青素饲料13~21 d时,锦鲤的皮肤、眼、肝胰脏以及肌肉中类胡萝卜素含量没有显著差异 (P>0.05);同时,投喂螺旋藻的试验组锦鲤的鳍、眼、肝脏、肌肉中类胡萝卜素也不再显著升高 (P>0.05),这与上述结果相类似。此外,以虾青素作为着色剂时,饲喂第9天时,锦鲤体表的色素含量显著增加;而以螺旋藻作为着色剂时,饲喂第13天时锦鲤体表的色素含量才显著增加。其原因可能是锦鲤对类胡萝卜素的代谢类型属于红鲤型[16],可将螺旋藻中富含的玉米黄质转变为虾青素[1],贮存于体内,用于增加体色;而对于虾青素来讲,锦鲤具有将其直接贮存于体内的能力,故以虾青素作为着色剂时,锦鲤沉积色素的速度要比以螺旋藻为着色剂时快。
Torrissen[17]研究发现,用不添加着色剂的基础饲料饲喂虹鳟,一段时间后,其色素含量明显下降。本试验中也出现了相类似的情况,即随着停喂时间的延长,锦鲤各组织器官中的类胡萝卜素含量逐渐降低。March等[18]认为,鱼体肌肉着色效果不好,主要是由于吸收的类胡萝卜素被氧化而褪色。在褪色试验过程中,开始投喂基础饲料对锦鲤各部分组织器官的影响并不显著,但随着饲养天数的延长,在第17天时锦鲤背鳍、尾鳍和皮肤的色素含量下降较之前有显著差异,说明投喂时间对色素的沉积有一定的影响。
本研究结果表明:当着色剂一定时,锦鲤各组织器官中的类胡萝卜素含量均随投喂时间的延长而升高;类胡萝卜素在锦鲤体内各组织器官中的含量从高至低依次为皮肤>鳍>肝胰脏>眼>肌肉,皮肤和鱼鳍是锦鲤色素沉积的主要部位;饲喂到一定时间后,体表类胡萝卜素含量才会显著增加 (虾青素饲喂9 d,螺旋藻饲喂13 d);停喂着色剂饲料后,锦鲤体内各组织器官中类胡萝卜素含量均随停喂时间的延长而降低。
[1]冷向军,李小勤.水产动物着色的研究进展[J].水产学报,2006,30(1):138-143.
[2]Goodwin T W.The biochemistry of the carotenoids[M].London:Chapman and Hall,1985:64-69.
[3]何培民,张饮江,何文辉.螺旋藻对锦鲤生长和体色的影响[J].水产学报,1999,23(2):162-168.
[4]Hardy R W.Absorption and distribution of C-labeled canthaxanthin in rainbow trout[J].Aquaculture,1990,97(3-4):331-340.
[5]Nickell D C,Bromage N R.The effect of dietary lipid level on variation of flesh pigmentation in rainbow trout(Oncorhynchus mykiss)[J].Aquaculture,1998,161(1-4):237-251.
[6]Emidio G,Jorge D,Paula S,et al.Utilization of natural and synthetic sources of carotenoids in the skin pigmentation of gilthead seabream(Sparus aurata)[J].European Food Research Technology,2002,214:287-293.
[7]陈晓明,徐学明,金征宇.富含虾青素的法夫酵母对金鱼体色的影响[J].中国水产科学,2004,11(1):70-73.
[8]丁小峰.饲料色素对黄颡鱼生长、生理机能及体色的影响[D].苏州:苏州大学,2006.
[9]Tanaka Y,Matsuguchi H,Katayama T,et al.The biosynthesis of astxanthin-XVIII.The metabolism of carotenoids in the prawn Penaeus japonicus Bate [J].Bulletin of the Japanese Society for the Science of Fish,1996,42:197-202.
[10]韩学哲.饲料中不同添加物对观赏鱼体色的影响[D].保定:河北大学,2001.
[11]Bjarne H,Grete H,Even H,et al.Pigmentation of 1,2 and 3 year old Arctic charr(Salvelinus alpinus)fed two different dietary axtaxanthin concentration[J].Aquaculture,1995,138(1-4):303-312.
[12]Metusalach,Synowiecki J,Brown J,et al.Deposition and metabolism of dietary canthaxanthin in different organs of Arctic charr(Salvelinus alpinus L.)[J].Aquaculture,1996,142(1-2):99-106.
[13]张春兰,赵文,徐立蒲,等.微生态制剂和着色剂对锦鲤体色的影响[J].大连海洋大学学报,2011,26(4):328-332.
[14]孙向军,罗琳,姜志强,等.饲料脂肪水平对锦鲤体色和几项免疫指标的影响[J].大连海洋大学学报,2011,26(5):397-401.
[15]黄辨非,冯端林,罗静波,等.饲料中添加红辣椒粉对红草金鱼体色及生长的影响[J].水利渔业,2008,28(4):52-54.
[16]Simpson K L.Carotenoids in fish feeds[C]//Carotenoids as colorants and vitamin A precursors.New York:Academic Press,1981:463-537.
[17]Torrissen O J.Pigmentation of salmonids:Factors affecting carotenoid deposition in rainbow trout(Salmo gairdneri)[J].Aquaculture,1985,46(2):133-142.
[18]March B,Macmillan C.Muscle pigmentation and plasma concentrations of astaxanthin in rainbow trout,Chinook salmon,and Atlantic salmon in response to different dietary levels of astaxanthin[J].Progressive Fish-Culturist,1996,58(3):178-186.
