草鱼呼肠孤病毒VP5蛋白的表达与纯化
2012-09-19方珍珍景宏丽江育林张利峰张旻李华
方珍珍,景宏丽,江育林,张利峰,张旻,李华
(1.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023;2.天津农学院水产科学系,天津300384;3.中国检验检疫科学研究院,北京100029;4.北京出入境检验检疫局,北京100026)
草鱼出血病是一种具高度传染性和致死性的病毒性鱼病,该病流行于中国各地草鱼养殖区,尤以长江流域和广东、广西、福建最为普遍,死亡率高达80%,严重影响了草鱼Ctenopharyngodon idellus养殖业的发展。1972年首次报道该病,1978年确定为病毒病,1980年首次在病鱼的头肾切片中观察到呈晶格状排列的病毒粒子,1984年确定草鱼出血病病原为呼肠孤病毒[1-2]。草鱼呼肠孤病毒(grass carp reovirus,GCRV)是中国分离、鉴定的第一株水生动物病毒,对该病毒的形态学、生物学、流行病学、理化及分子生物学等方面已进行了系统的研究[3-8]。
草鱼呼肠孤病毒的基因组由11个dsRNA片段组成,不同的毒株间病毒基因组的总分子质量差异不大 (相对分子质量约15×106),但各片段分子质量有所差异。近年来,方勤等[9]通过序列分析和三维结构研究表明,成熟的GCRV颗粒由7种结构蛋白和4种非结构蛋白组成,其中病毒蛋白VP5和VP7构成了病毒的外层衣壳组分。通过蛋白酶裂解试验揭示了VP5和VP7在病毒感染及致病中起着不可替代的作用。此外,VP5还可进行构象的改变,其作用是保证膜穿透[10-12],同时VP5也是GCRV的衣壳蛋白,可能具有较高的免疫原性。
关于草鱼出血病的检测,电镜观察是最直观而有效的方法,在最初的研究中应用较多,但是存在着技术和仪器要求以及样品制备复杂等问题[13]。分子检测技术PCR方法虽然具有高灵敏度的优点,但由于存在假阳性,在结果判定上容易出现不确定性,并且难以判断是具有完整病毒粒子还是仅存在残余的病毒核酸[14-16]。因此,用于抗原检测的免疫学方法可以作为确诊的重要依据。而免疫学方法的应用需要一定量的抗血清,通常采用灭活毒株免疫动物获得免疫血清,但这种方法需要增殖大量的病毒并对其纯化,血清生产成本高,过程复杂,制约了抗血清的大量获得。本研究中,作者在对GCRV基因序列分析的基础上,选择病毒的外壳蛋白VP5基因进行表达载体的构建和蛋白表达,以期得到人工表达的病毒外壳蛋白,旨在为该病毒单克隆抗体和多克隆抗体的制备,以及免疫检测试剂盒的研制提供依据。
1 材料与方法
1.1 材料
1.1.1 毒株、菌株和载体 毒株GCRV-873为中科院武汉病毒所赠送;pET-30α质粒购自Novagen公司;大肠杆菌E.coli DH5α、大肠杆菌BL-21(DE3)、RNA提取试剂盒 (硅基质膜吸附法)、Quant一步法RT-PCR试剂盒 (高效逆转录酶)、质粒提取试剂盒、胶回收试剂盒均购自天根生化科技 (北京)有限公司;限制性内切酶SacⅠ、XhoⅠ、T4 DNA连接酶均购自NEB公司;蛋白预染Marker购自 Fermentas公司;Ni-NTA HisBind融合蛋白纯化购自MERCK公司。
1.1.2 引物 根据GenBank中的序列(登录号AF239175)设计引物GCRV-U和GCRV-D分别为5'GAGCTCGGACTTCGCACTCTCTCTACAATG3',5'CTCGAG AA GTTCACGCGGGCATGGAAG 3'。上游引物引入SacⅠ位点,下游引物引入XhoⅠ位点,由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 GCRV-873病毒总RNA的提取和RTPCR扩增 使用RNA提取试剂盒提取总RNA。取总RNA 10 μL配制50 μL反应体系,进行 RTPCR扩增。反应条件:先在50℃下反转录30 min,再于94℃下预变性2 min;然后在94℃下变性1 min,在60℃下退火1 min,在72℃下延伸2 min,共进行35个循环;最后在72℃下延伸10 min。
1.2.2 PCR产物的亚克隆 取PCR回收产物用SacⅠ和XhoⅠ双酶切,用10 g/L琼脂糖凝胶回收目的片段;pET-30α质粒同样用SacⅠ和XhoⅠ双酶切、回收。取经酶切处理的1 μL pET-30α质粒、5 μL GCRV-VP5基因 PCR 产物、1 μL T4 DNA连接酶和1 μL 10×连接酶buffer,在16℃下连接12 h,连接产物转化至大肠杆菌DH5α感受态细胞中,筛选阳性菌落克隆,阳性菌落经过PCR和双酶切鉴定后,送北京诺赛基因组研究中心有限公司进行测序。
1.2.3 重组大肠杆菌的诱导培养和目的蛋白的检测 挑取测序验证构建成功的pET-30α重组质粒和空质粒分别转化至大肠杆菌BL-21(DE3)感受态细胞中,涂布于含卡那霉素 (Kan)的固体LB平板上,于37℃温箱中培养过夜。分别挑取带有重组质粒和空质粒的单克隆菌落接种于3 mL含卡那霉素的LB培养基中,于37℃下摇床培养过夜。次日转接种至50 mL含卡那霉素的LB培养基中,于37℃下摇床培养至光密度值OD600nm=0.6。每个克隆选取一瓶,加入原始浓度为1 mol/L的IPTG培养液,至终浓度为1 mmol/L,并于37℃下诱导培养4 h,分别离心收集菌体并超声破碎,将离心后的上清液和沉淀进行SDS-PAGE分析,凝胶用考马斯亮蓝染色。
1.2.4 包涵体的粗提和洗涤 取1 L菌液,参照《分子克隆实验指南》[17]有关方法,以低速离心收集沉淀,将沉淀重悬于细胞裂解液 (50 mmol/L Tris-HCl、1 mmol/L EDTA、100 mmol/L NaCl,pH 8.0)中,用功率为400 W的超声按照作用3 s、间隔3 s进行处理,直至菌液澄清。以4 000 g离心15 min,弃上清,收集沉淀,除去大部分可溶菌体蛋白。将沉淀于含有Triton-100的细胞裂解液中洗涤2~3次,进一步去除杂蛋白和杂质。最后收集沉淀,于-20℃下保存。
1.2.5 融合蛋白的纯化 将洗涤后的包涵体用含8 mol/L尿素的PBS缓冲液完全溶解,经带有Ni-NTA HisBind的树脂混匀,用柱层析纯化融合目的蛋白,用含4 mol/L尿素的透析液 (0.1 mol/L NaH2PO4、0.01 mol/L Tris-Cl,pH 8.0)进行透析,然后逐步降低尿素浓度至零,透析48~60 h后,取10 μL进行SDS-PAGE分析。
1.2.6 Western blotting分析 取纯化后的融合蛋白样品,经SDS-PAGE电泳后,用湿法电转移至硝酸纤维素膜中,以质量分数为10%的脱脂奶粉封闭过夜。次日进行Western blotting试验,分别以His·Tag单克隆抗体和羊抗GCRV抗血清作为一抗,于37℃下孵育1 h,用1×PBST洗涤3次。加入用HRP(辣根过氧化物酶)标记的抗鼠二抗和抗羊二抗,于37℃下孵育1 h,再用1×PBST洗涤3次,加入DAB显色,用去离子水终止反应。
1.2.7 多克隆抗体的制备及抗体效价的检测 将纯化病毒和表达蛋白分别作为抗原免疫山羊,共免疫4次。第一次基础免疫:抗原与弗氏完全佐剂按1∶1混合,皮下多点注射,免疫剂量为1 mg/只。一周后加强免疫一次:抗原与弗氏不完全佐剂按1∶1混合,皮下注射,免疫剂量为1 mg/只。之后每隔一周加强免疫一次,注射剂量加倍。4次免疫后采血,分离血清,用间接ELISA方法检测抗体效价。
2 结果
2.1 重组克隆的鉴定
从细胞培养的GCRV-873病毒悬液提取总RNA,通过RT-PCR扩增GCRV-VP5基因,得到约为2 005 bp的PCR产物 (图1)。PCR产物克隆至pET-30α质粒,转化至大肠杆菌BL-21(DE3)中,挑取过夜生长的菌落,进行小量培养。使用质粒提取试剂盒提取质粒,用SacⅠ和XhoⅠ做酶切鉴定,经10 g/L琼脂糖凝胶电泳,可得到2 005 bp的DNA目的条带 (图2),并鉴定为阳性重组质粒,命名为pET-30α-GCRV-VP5。菌落经PCR鉴定为阳性,显示克隆成功。

图1 GCRV-873病毒VP5基因的RT-PCR扩增Fig.1 RT-PCR amplification of GCRV-873 strain VP5 gene
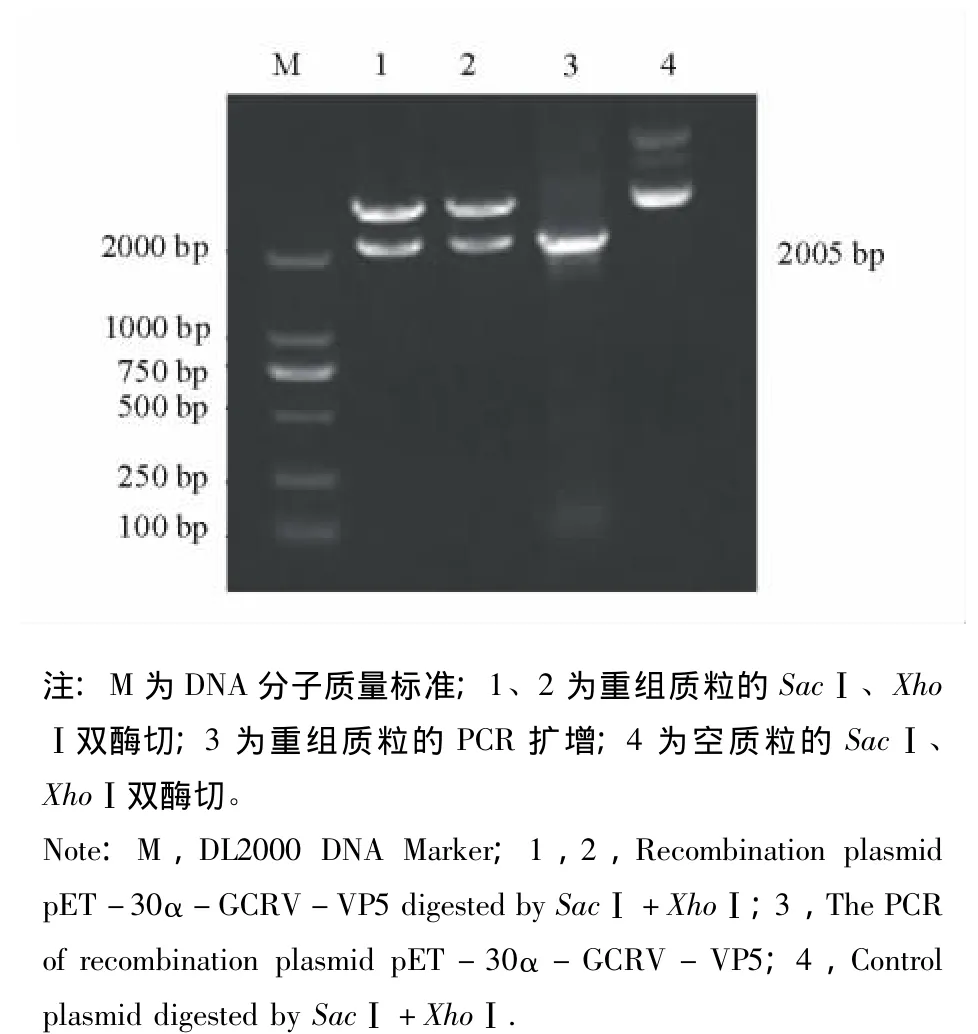
图2 重组质粒pET-30α-GCRV-VP5的酶切鉴定Fig.2 Identification of recombination plasmid pET-30α-GCRV-VP5 by enzyme digestion
测序结果显示,该基因序列与GenBank公布的AF239175相似性达99%,提示已成功构建了重组质粒pET-30α-GCRV-VP5。
2.2 表达产物的可溶性分析
诱导表达后,细胞经超声处理,上清与沉淀分别进行SDS-PAGE。结果显示,目的蛋白大部分在超声后的沉淀中,提示表达产物主要以不可溶的包涵体形式存在(图3(a))。
2.3 融合蛋白的纯化
将包涵体用Ni-NTA HisBind树脂将目的蛋白纯化,透析后进行SDS-PAGE分析。结果显示,可得到纯度较高的蛋白,经测定其质量浓度约为0.5 mg/mL(图3(b))。
2.4 重组蛋白的Western blotting鉴定
对纯化后重组蛋白进行Western blotting检测,结果显示,以His·Tag单克隆抗体为抗体,在硝酸纤维素膜相对分子质量为77 000处出现一特异性反应条带(图4(a)),同时以羊抗GCRV抗血清为抗体,也可出现相同分子质量大小的特异性反应条带(图4(b)),证实了相对分子质量为77 000处的条带为含有目的蛋白的融合表达产物。
2.5 多克隆抗体的效价
分别用病毒和表达蛋白作为抗原,对免疫山羊4次后获得的抗血清,用ELISA法测得抗体的效价均在10-4。表明两种抗原均可诱导动物产生良好的体液免疫反应。
3 讨论
本研究中对GCRV-VP5基因进行了人工表达,用表达的重组蛋白作为抗原,免疫动物并使之产生相应的抗体,表达的需要量较大,为此构建了原核表达体系。将RT-PCR扩增出的目的条带连接到表达质粒pET-30α中,构建的重组质粒转化至大肠杆菌BL-21(DE3)感受态细胞中进行表达。经过SDS-PAGE分析,诱导后重组菌在相对分子质量约为77 000处出现一条蛋白条带,提示感受态菌可能表达了含有目的蛋白的融合表达产物。经Western blotting鉴定,该条带可以与His·Tag抗体和羊抗GCRV抗血清特异性结合,表明在相对分子质量为77 000处的条带的抗原性和病毒蛋白的抗原性相似,也表明其中含有目的蛋白的融合表达产物。而利用pET-30α质粒载体系统表达的外源基因,表达蛋白带有6个组氨酸标记,因6×His很小,所以不会影响表达蛋白的结构和功能,无需用蛋白酶把6×His切除[18]。而且6×His免疫原性差,融合蛋白可直接用作抗原产生所需的抗体。

图3 重组蛋白的表达和包涵体的洗涤及重组蛋白的纯化Fig.3 Expression of recombinant proteins and washing,and purification of recombinant proteins
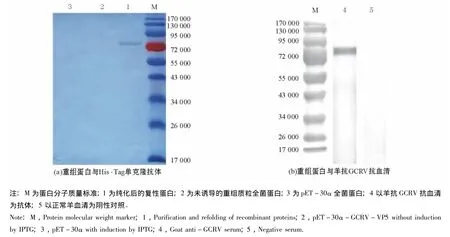
图4 重组蛋白与His·Tag单克隆抗体、羊抗GCRV抗血清进行免疫印迹Fig.4 Western blot analysis by recombinant proteins with His·Tag monoclonal antibodies,and goat anti-GCRV serum
本研究中在37℃下诱导,对表达产物的上清和沉淀分别进行SDS-PAGE分析,结果表明,该融合产物主要以包涵体的形式存在。重组蛋白在大肠杆菌中表达时,缺乏一些蛋白折叠过程中需要的酶和辅助因子,如折叠酶和分子伴侣等,是包涵体形成的原因之一[19]。但蛋白以包涵体形式出现,其蛋白的自然结构和抗原活性都会受到很大影响,为此进行了包涵体的洗涤、溶解、纯化、复性。本试验中首先通过物理方法超声破碎对表达菌进行裂解。由于菌体及部分破碎的细胞膜及膜蛋白常常与包涵体粘连在一起,因此在溶解包涵体之前的洗涤非常重要。本研究中参照《分子克隆实验指南》[17]对包涵体进行了洗涤,取得了较好的洗涤效果。对包涵体进行溶解纯化后,如何将其转化成有活性的蛋白,其中蛋白质的复性是非常重要的一步。在实验室中,一般采用传统的稀释和透析方法进行复性。由于多肽链之间的聚集容易造成蛋白质沉淀,而蛋白质的浓度是引起多肽链聚集的主要因素。通常蛋白质的质量浓度控制在0.1~1.0 mg/mL。变性蛋白经过尿素处理至可溶以后,再逐渐滴加到复性液中使之复性。但如果加到复性液中的速度过快,就容易形成絮状沉淀,这可能是蛋白重新凝聚的缘故[20]。为此,Mayer等[21]设计了一种缓慢透析法,用8 mol/L的尿素溶液作为起始透析液,然后逐渐稀释降低透析外液的尿素浓度。变性剂浓度连续缓慢下降,有助于减少蛋白质复性过程中沉淀的出现,提高活性蛋白质的收率。因此,本研究中选择透析复性,蛋白质质量浓度为0.5 mg/mL,复性后离心仅有少量沉淀,复性效果较好。
本试验中制备的两种多克隆抗体均有较高的效价,且效价水平相差不大,说明两种抗原均可刺激动物产生免疫学反应。对比而言,表达蛋白制备的多抗较病毒制备的多抗灵敏度和特异性要好一些。因此,表达的重组蛋白可以应用于ELISA等免疫学检测方法的研究。重组蛋白的成功表达和复性为今后GCRV单克隆抗体的制备提供了较好的方法,也为进一步制备免疫学方面的检测试剂盒研究工作提供了科学依据。
[1]陈燕新,江育林.草鱼出血病病毒形态结构及其理化特性的研究[J].科学通报,1983,28:1138-1140.
[2]中国科学院武汉病毒研究所,中国水产科学研究院长江水产研究所沙市分所草鱼出血病病毒研究协作组.草鱼出血病病毒的电子显微镜观察初报[J].淡水渔业,1983(3):39-40.
[3]柯丽华,方勤,蔡宜权.一株新的草鱼出血病病毒分离物的特性[J].水生生物学报,1990,14(2):153-159.
[4]方勤,柯丽华,蔡宜权.草鱼出血病病毒的生长特性及高滴价培养[J].病毒学杂志,1989,4(3):315-319.
[5]黄捷,柯丽华,蔡宜权.草鱼出血病病毒的RNA转录酶活性研究[J].病毒学报,1992,8(1):50-56.
[6]王炜,蔡宜权,方勤,等.草鱼出血病病毒多肽的基因定位[J].中国病毒学,1994,9(4):356-361.
[7]Fang Qin,Attoui H,Francois J,et al.Sequence of genome segments 1,2 and 3 of the grass carp reovirus(genus Aquareovirus,family Reoviridae)[J].BBRC,2000,274(3):762-766.
[8]Qiu Tao,Lu Ren-hou,Zhang Jiang,et al.Complete nucleotide sequence of the S10 genome segment of grass carp reovirus(GCRV)[J].DAO,2001,44:69-74.
[9]方勤,Shah S.草鱼呼肠孤病毒的三维重构与衣壳蛋白特性[J].生命科学,2005,35(3):231-237.
[10]Fang Q,Seng E K,Ding Q Q.Characterization of infectious particles of grass carp reovirus by treatment with proteases[J].Arch Viro,2008,153(2):675-682.
[11]Ivanovic T,Agosto M A,Nibert M L.A role for molecular chaperone Hsc70 in reovirus outer capsid disassembly[J].Biol Chem,2007,282(16):12210-12219.
[12]王炜,赵桃英,方勤.草鱼出血病病毒多肽的免疫原性[J].中国病毒学,1995,10(2):166-168.
[13]消波.草鱼呼肠孤病毒及其免疫防治研究进展[J].鲁东大学学报:自然科学版,2010,26(1):52-57.
[14]Yue Z Q,Teng Y,Liang C Z,et al.Development of a sensitive and quantitative assay for spring viremia of carp virus based on realtime RT-PCR[J].J Viro Methods,2008,152:43-48.
[15]兰文生,刘荭,高隆英,等.鲤春病毒血症病毒糖蛋白的高效表达和纯化[J].中国动物传染病学报,2010,18(2):18-22.
[16]韩硕,赵前程,吴斌,等.传染性造血器官坏死病毒毒株核蛋白基因片段的克隆及序列分析[J].大连海洋大学学报,2011,26(3):232-237.
[17]Sambrook J,Russell D W.分子克隆实验指南[M].黄培堂,译.北京:科学出版社,2002.
[18]吴成龙,史成银,黄捷,等.大菱鲆红体病虹彩病毒主要衣壳蛋白基因在毕赤酵母中的重组分泌表达[J].渔业科学进展,2009,30(3):55-61.
[19]方敏,黄华梁.包涵体蛋白体外复性的研究进展[J].生物工程学报,2001,17(6):608-612.
[20]万雪,王磊,宁官保.包涵体及其复性研究概况[J].畜牧兽医科技信息,2005(2):13-15.
[21]Mayer M,Buchner J.Refolding of inclusion on body proteins[J].Methods Mol Med,2004,94:239-254.
